|
|
Тема 25. Многоядерные ароматические соединения. Лекция 19 полиядерные ароматические углеводороды план Полиядерные арены с конденсированными циклами
Лекция №19
ПОЛИЯДЕРНЫЕ АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
План
Полиядерные арены с конденсированными циклами.
Полиядерные арены с изолированными циклами.
Полиядерные арены с конденсированными циклами
Классификация, номенклатура, изомерия
Различают три основных типа конденсированных систем: 1) линейно конденсированные (нафталин, антрацен); 2) ангулярно конденсированные (фенантрен); 4) пери-конденсированные (пирен).
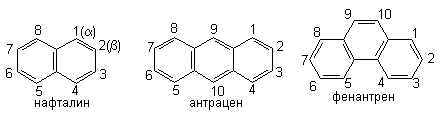 
Нафталин имеет 4 одинаковыхa- и 4 одинаковых b-положения; существует два монозамещенных нафталина - a- и b-. Для указания положения заместителей используют также нумерацию атомов в циклах.
Антрацен имеет три набора одинаковых положений: (1-,4-,5-,8-); (2-,3-,6-,7-); (9-,10-). Таким образом, существует три монозамещенных антрацена (1-, 2- и 9-).
Фенантрен содержит 5 пар равноценных положений: 1 и 8, 2 и 7, 3 и 6, 4 и 5, 9 и 10. Для монозамещенных фенантренов существует 5 изомеров.
Методы получения
Главным источником конденсированных ароматических углеводородов является каменноугольная смола, которая содержит 8-12% нафталина, 4-5% фенантрена, 1-1,8% антрацена. Нафталин выделяют также из продуктов переработки нефти. Масло, получаемое при каталитическом риформинге бензина обогащено алкилнафталинами, которые переводят в нафталин путем гидродеалкилирования в присутствии смеси оксидов Со и Мо.
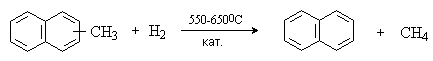
Физические свойства и строение
Нафталин, антрацен и фенантрен – бесцветные кристаллические вещества. Фенанатрен имеет более низкую температуру плавления и лучшую растворимость, чем антрацен.
Молекулы нафталина, антрацена и фенантрена имеют плоское строение, однако длины связей С-С в них различны. В нафталине и антрацене наименьшей длиной и наибольшей кратностью обладает связь С(1)-С(2), в фенантрене – связь С(9)-С(10).
Правило Хюккеля об ароматичности замкнутой p -электронной системы справедливо для моноциклических систем. На полициклические конденсированные системы оно может быть перенесено при условии, что общие для двух циклов связи не вносят серьезных возмущений в p -электронную систему по сравнению с соответствующими аннуленами, а лишь обеспечивают необходимую компланарность. Правило Хюккеля выполняется для полициклических систем, имеющих атомы, общие для двух циклов. Нафталин (содержит 10 p -электронов), а также антрацен и фенантрен (содержат по 14 p -электронов) являются ароматическими углеводородами. Ароматическими свойствами обладает электронный аналог и изомер нафталина – азулен, содержащий конденсированные семи- и пятичленный циклы. Существенный вклад в его строение вносит биполярная структура, представляющая собой сочетание ядер циклопентадиенил-аниона и катиона тропилия:
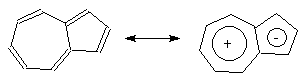
азулен
Для соединений, имеющих атомы, общие для трех циклов, правило Хюккеля неприменимо. Например, пирен является ароматическим углеводородом, хотя его p -система содержит 16 электронов, т е. не подчиняется формуле (4n+2).
Конденсированные ароматические углеводороды стабилизированы в меньшей степени, чем бензол. Энергия делокализации нафталина, определенная из теплот гидрирования, составляет 255 кДж/моль, что меньше, чем для двух изолированных бензольных ядер (150 кДж/моль х 2 = 300 кДж/моль). Энергия стабилизации антрацена составляет 350, а фенантрена – 385 кДж/моль, что меньше утроенной энергии стабилизации бензола.
Химические свойства
1) Реакции электрофильного замещения
Нафталин, антрацен и фенантрен вступают в реакции электрофильного замещения легче, чем бензол. Это связано с меньшими потерями энергии стабилизации на стадии образования s-комплекса. Потеря энергии стабилизации в результате нарушения ароматической системы при образовании s -комплекса в бензоле составляет 150 кДж/моль. Аналогичная величина для нафталина, в котором после разрушения ароматической системы одного кольца остается ароматическая система бензола, составит 255-150 = 105 кДж/моль. В результате нарушения ароматичности центральных колец в антрацене и фенантрене каждый из них будет содержать по два изолированных бензольных ядра и потеря энергии стабилизации составит 350 - 2х150 = 50 кДж/моль для антрацена и 385 - 2х150 = 85 кДж/моль для фенантрена. В случае нарушения ароматичности периферийных ядер в антрацене и фенантрене остается ароматическая система нафталина и потери энергии стабилизации составят 350 – 255 = 95 кДж/моль для анатрацена и 385 – 255 = 130 кДж/моль для фенантрена.
Из приведенных данных можно сделать вывод, что центральные ядра в антрацене и фенантрене будут более реакционноспособными, чем периферийные. Электрофильное замещение в этих системах в большинстве случаев будет идти в 9,10-положения.
Электрофильное замещение в нафталине протекает преимущественно в a - положение. Направление атаки электрофила определяется относительной стабильностью s -комплексов, ведущих к продуктам замещения по a - и b - положениям. Для аренониевого иона, образующегося при атаке по a -положению, можно изобразить две энергетически выгодные резонансные структуры, в которых не затрагивается ароматическая система второго кольца, тогда как при атаке по b -положению - только одну.
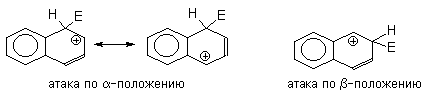
Энергетически менее выгодные резонансные структуры, в которых нарушена ароматичность обоих колец, полностью исключить нельзя, однако их вклад в резонансную стабилизацию невелик.
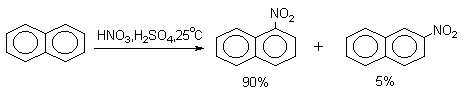
Нафталин нитруется в более мягких условиях, чем бензол, с образованием в качестве основного продукта a -нитронафталина.
Галогенирование нафталина также идет гораздо легче, чем галогенирование бензола. Последний можно использовать как растворитель в этих реакциях. Бром реагирует более селективно, чем хлор.
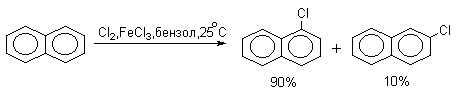
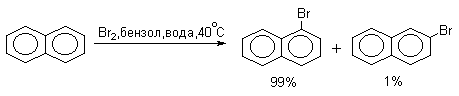
Состав продуктов ацилирования нафталина зависит от природы растворителя.
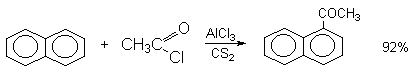
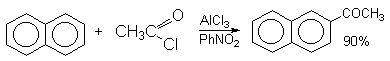
Возможно такая селективность ацилирования нафталина связана с большим объемом комплекса CH3COCl . AlCl3 . PhNO2 по сравнению с комплексом CH3COCl . AlCl3. CS2.
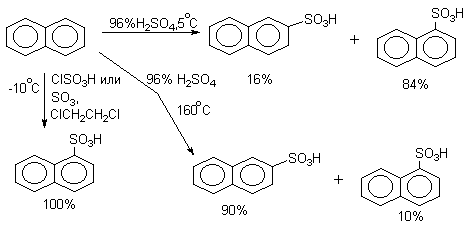
Сульфирование нафталина является классическим примером проявления термодинамического контроля состава продуктов реакции. В очень мягких условиях образуется только a -нафталинсульфокислота. Этому условию отвечает сульфирование нафталина хлорсульфоновой кислотой при низких температурах. Соотношение изомеров при сульфировании 96%-ной серной кислотой зависит от температуры: в мягких условиях преобладает продукт кинетического контроля - a -нафталинсульфокислота, в более жестких условиях преобладает термодинамически более стабильная b -нафталинсульфокислота.
Антрацен и фенантрен. Электрофильное замещение в этих конденсированных системах может протекать как по классическому механизму SEAr с образованием аренониевых ионов, так и по механизму присоединения-отщепления.
Доказано, что галогенирование и нитрование антрацена в мягких условиях протекают через промежуточное образование продуктов 9,10-присоединения, которые легко превращаются в 9-производные антрацена.
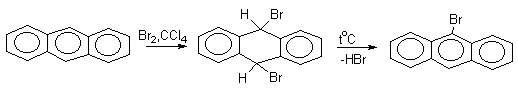
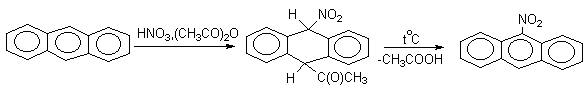
Приведенные примеры демонстрируют "диеновый" характер антрацена и его склонность к реакциям 1,4-присоединения, характерным для сопряженных диенов.
В то же время, ацилирование антрацена проводят в условиях, типичных для процессов SE(Ar).
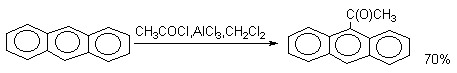
В фенантрене углерод-углеродная связь 9-10 проявляет свойства двойной связи в алкенах. Так, бромирование фенантрена при низкой температуре в растворе CCl4 приводит к преимущественному образованию продукта 9,10-присоединения.
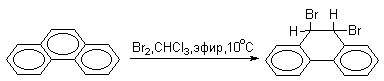
В более жестких условиях или в присутствии кислоты Льюиса образуется только 9-бромфенантрен.
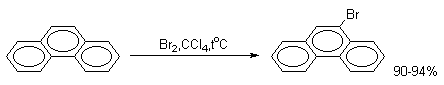
Экспериментальные данные показывают, что не всегда можно заранее предсказать результат конкретной реакции электрофильного замещения в конденсированных системах. Например, ацилирование фенантрена не приводит к образованию 9-ацетилфенантрена, а протекает следующим образом:
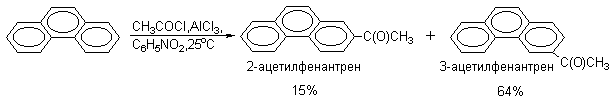
2) Окисление
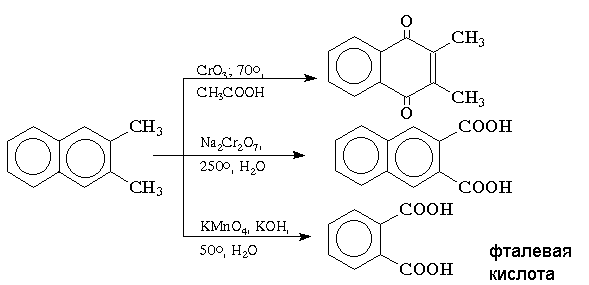
Окисление конденсированных ароматических углеводородов приводит к различным продуктам в зависимости от используемого реагента и условий реакции. Реагенты на основе хрома (VI) в кислой среде окисляют нафталин и алкилнафталины до нафтохинонов, тогда как бихромат натрия в водном растворе окисляет только алкильные группы. Окисление нафталина перманганатом калия в щелочной среде сопровождается деструкцией одного ароматического кольца с образованием моноциклических дикарбоновых кислот:
Антрацен гладко окисляется бихроматом натрия в серной кислоте или оксидом хрома (VI) в уксусной кислоте до антрахинона:
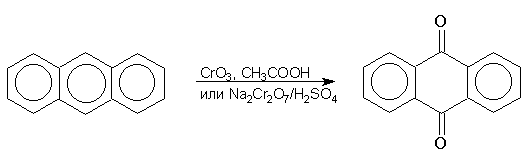
3) Гидрирование
Конденсированные ароматические углеводороды гидрируется легче, чем бензол. При каталитическом гидрировании нафталина происходит последовательное восстановление ароматических колец.
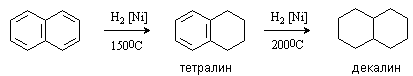
Антрацен и фенантрен гидрируются до 9,10-дигидропроизводных.
2. Полиядерные арены с изолированными циклами
Из углеводородов с изолированными бензольными ядрами наибольший интерес представляют ди- и трифенилметаны, а также бифенил.
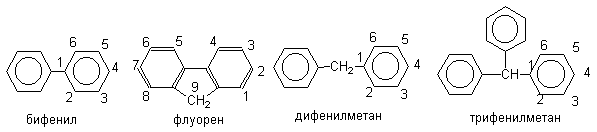
Реакции электрофильного замещения
Экспериментальные данные показывают, что бифенил в реакциях электрофильного замещения более активен, чем бензол. Электрофильные реагенты атакуют орто- и пара-положения фенильных колец, причем преимущественно пара-положение (орто-атомы водорода одного кольца пространственно экранируют орто-положения другого кольца, что затрудняет их атаку электрофилом).
Строениеs -комплекса, образующегося после атаки молекулы бифенила электрофилом можно представить в виде следующего набора граничных структур:
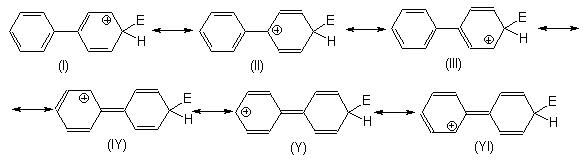
Образование резонансных структур (IY), (Y) и (YI) должно быть затруднено по следующим причинам: 1) оба кольца в них должны быть компланарны, что приведет к довольно сильному взаимному отталкиванию орто-атомов водорода; 2) нарушается ароматическая система второго бензольного кольца, что энергетически не выгодно.С другой стороны, резонансная структура (II) предполагает определенное участие второго кольца в делокализации положительного заряда в s -комплексе. Наиболее вероятно, что в этом случае проявляется положительный индуктивный, а не мезомерный (условие образования резонансных структур IY, Y и YI) эффект второго бензольного кольца.
Бифенил легко галогенируется, сульфируется, нитруется.
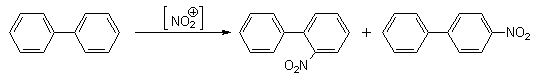
При переходе от бифенила к флуорену, в котором оба бензольных кольца строго компланарны и их взаимное влияние более ярко выражено, скорость реакций электрофильного замещения резко возрастает. При этом, как правило, образуются 2-замещенные флуорены.
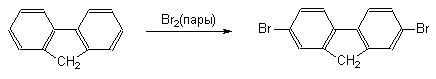
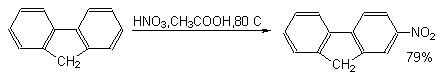
В ди- и трифенилметанах бензольные кольца полностью автономны и в реакциях электрофильного замещения они ведут себя подобно монозамещенным бензолам, содержащим объемные алкильные заместители.
Реакции метиленовой и метиновой групп в ди- и триарилметанах
Особенности химического поведения ди- и трифенилметанов проявляются в свойствах С-Н связи алифатической ("метановой") части молеулы. Легкость гетеро- или гомолитического разрыва этой связи зависит прежде всего от возможности делокализации возникающего положительного или отрицательного заряда (в случае гетеролитического разрыва) или неспаренного электрона (в случае гомолитического разрыва). В ди- и особенно в трифенилметановой системе возможность такой делокализации исключительно велика.
Рассмотрим способность фенилированных метанов к диссоциации С-Н связи с отщеплением протона ( СН-кислотность ). Сила СН-кислот, как и обычных протонных кислот, определяется устойчивостью, а следовательно и легкостью образования, соответствующих анионов (в рассматриваемом случае - карбанионов). Устойчивость и легкость образования анионов, в свою очередь, определяются возможностью делокализации в них отрицательного заряда. Каждое бензольное ядро, связанное с бензильным атомом углерода, может принимать участие в делокализации возникающего на нем отрицательного заряда, что можно представить с помощью резонансных структур:
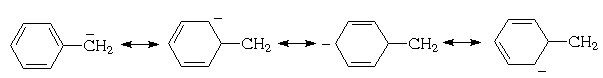
Для дифенилметана можно изобразить уже семь граничных структур:
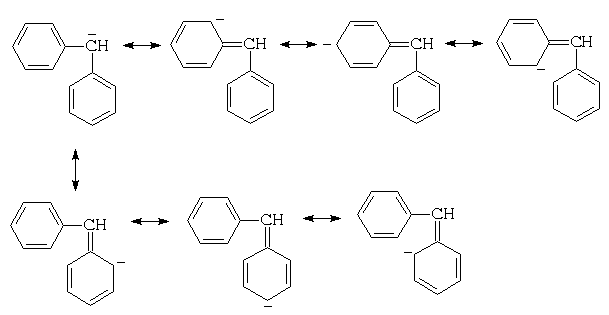
а для трифенилметана – десять. Поскольку с числом возможных граничных структур растет способность к делокализации, ди- и особенно трифенилметил-анионы должны обладать особой устойчивостью. В связи с этим можно ожидать, что СН-кислотность метанов будет увеличиваться с увеличением числа фенильных колец, которые могут принимать участие в делокализации заряда на центральном атоме углерода, т.е. возрастать в ряду:
СН4 < С6Н5СН3 < (С6Н5)2СН2 < (С6Н5)3СН
Значения pKa указанных углеводородов, определенные специальными методами, подтверждают это предположение. Дифенилметан (pKa 33) по кислотности приблизительно равен аммиаку, а трифенилметан (pKa 31.5) - трет-бутанолу и более чем в 1010 раз превосходит по кислотности метан (pKa 40).
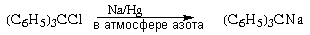
Окрашенный в вишневый цвет три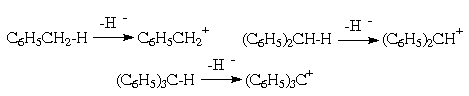 фенилметилнатрий обычно получают восстановлением трифенилхлорметана амальгамой натрия. фенилметилнатрий обычно получают восстановлением трифенилхлорметана амальгамой натрия.
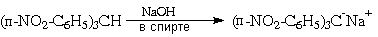
В отличие от обычных СН-связей sp3-гибридного атома углерода, бензильная С-Н связь три-(пара-нитрофенил)метана гетеролитически расщепляется уже спиртовой щелочью.
В последнем случае в делокализации отрицательного заряда в анионе помимо трех бензольных ядер дополнительно участвуют три нитрогруппы.
Другой вид гетеролитического расщепления бензильной СН-связи - отрыв гидрид-аниона с образованием соответствующих карбокатионов бензильного типа:
Поскольку бензольные ядра способны стабилизировать как положительный, так и отрицательный заряды, фенилированные метаны по гидридной подвижности водорода в алифатической части составят тот же ряд, что и по протонной подвижности:
СН4< С6Н5СН3< (С6Н5)2СН2<(С6Н5)3СН.
Однако экспериментально сравнить легкость отрыва гидрид-аниона, как правило, бывает трудно, поскольку для осуществления такого отрыва обычно используют весьма активные кислоты Льюиса. Сравнительные оценки легко могут быть сделаны путем сопоставления подвижности галогена (обычно хлора) в условиях SN1 реакций, поскольку в этом случае, как и при отщеплении гидрид-аниона, стадией, определяющей скорость превращения, является образование соответствующего карбокатиона.
Ar-CR2-Cl ® ArCR2+ + Cl-; (R = H , Ar)
Действительно, оказалось, что в указанных условиях наибольшей подвижностью хлор обладает в трифенилхлорметане, а наименьшей - в бензилхлориде.
(C6H5)3C-Cl > (C6H5)2CH-Cl > C6H5CH2-Cl
Реакционная способность хлора в трифенилхлорметане напоминает таковую в хлорангидридах карбоновых кислот, а в дифенилметане - в аллилхлориде. Ниже приведены данные об относительных скоростях сольволиза хлоридов R-Cl в муравьиной кислоте при 25о С:
R-Cl + HCOOH ® R-O-C(O)H + HCl
Сравнительная устойчивость трифенилметильного (тритильного) катиона подтверждается также многими другими экспериментальными данными. Примером может служить легкость образования его солей с ненуклеофильными анионами, растворы которых в полярных апротонных растворителях электропроводны (а, значит, имеют ионное строение) и характерно окрашены в желтый цвет:
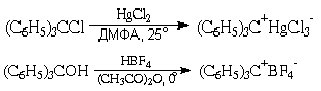
О том же свидетельствует способность трифенилхлорметана к диссоциации на трифенилметил-катион и хлорид-анион в растворе жидкого диоксида серы:
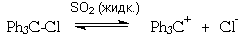
Устойчивость трифенилметильного катиона возрастает при введении в бензольные кольца электронодонорных групп (например, амино-, алкил- и диалкиламино-, гидроксильной, алкоксильной). Дальнейшее увеличение устойчивости карбокатиона приводит к ситуации, когда он становится устойчивым в водном растворе, то есть равновесие реакции
сдвинуто влево.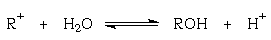
Подобные тритильные катионы окрашены. Примером может служить интенсивно окрашенный в фиолетовый цвет три(4-диметиламинофенил)метильный катион. Его хлорид применяют в качестве красителя под названием "кристаллический фиолетовый". В кристаллическом фиолетовом положительный заряд рассредоточен между тремя атомами азота и девятью атомами углерода бензольных ядер. Участие одного из трех пара-диметиламинофенильных заместителей в делокализации положительного заряда может быть отражено с помощью следующих граничных структур:
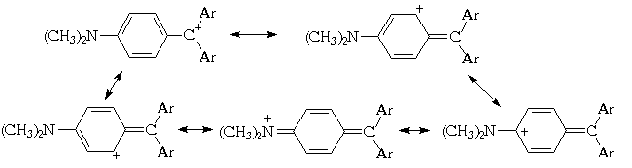
Все трифенилметановые красители, содержащие аминогруппы в бензольном кольце, приобретают окраску в кислой среде, которая способствуют возникновению хиноидной структуры с протяженной цепью сопряжения. Ниже приведены формулы наиболее распространенных трифенилметановых красителей.
(п-R2N-C6H4)2C+(C6H5)Cl-
|
R = CH3 малахитовый зеленый
|
R = C2H5 бриллиантовый зеленый
|
R = H фиолетовый Дебнера
|
(п-R2N-C6H4)3C+Cl-
|
R = H парафуксин
|
R= CH3 кристаллический фиолетовый
|
Аналогичное влияние должны оказывать бензольные ядра и на устойчивость трифенилметильного радикала. Трифенилметильный радикал может быть генерирован из соответствующего хлорида действием цинка, меди или серебра, которые в этом случае выступают как доноры электрона.
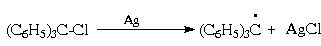
Трифенилметильный радикал достаточно устойчив и в разбавленных растворах (в эфире, бензоле) димеризуется лишь частично. При димеризации возникает связь между центральным углеродным атомом одного радикала и пара-положением одного из фенильных ядер другого радикала.

По-видимому один трифенилметильный радикал атакует наименее пространственно затрудненное место другого, Степень диссоциации таких димеров сильно зависит от природы арильных радикалов. Так, в 0.1 М растворе в бензоле при 25оС трифенилметильный радикал димеризован на 97%, а три-(4-нитрофенил)метильный не димеризуется вообще.
Химия \ Органическая химия
|
|
|
 Скачать 0.63 Mb.
Скачать 0.63 Mb.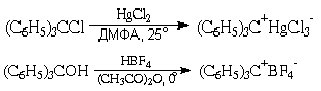

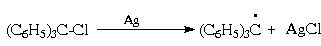



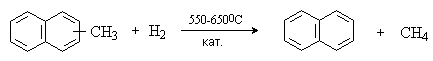
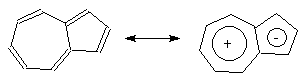


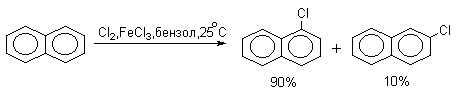
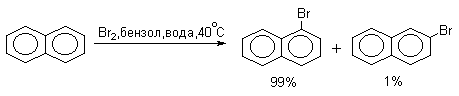
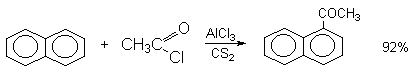
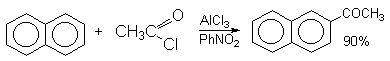



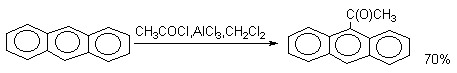
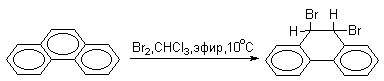
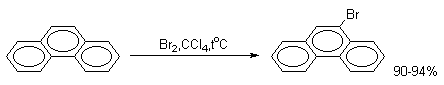
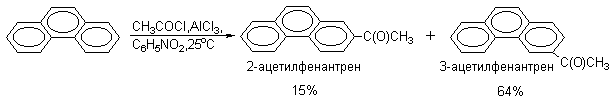

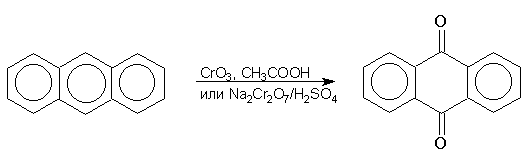

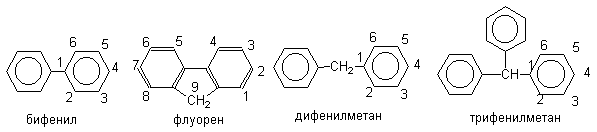

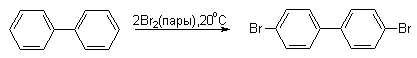
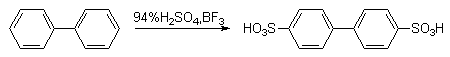
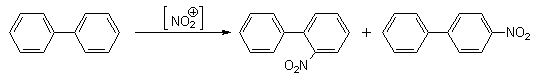
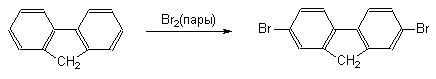
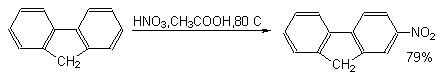
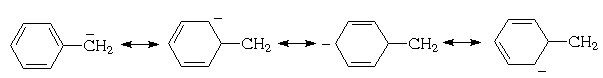

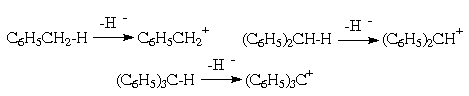 фенилметилнатрий обычно получают восстановлением трифенилхлорметана амальгамой натрия.
фенилметилнатрий обычно получают восстановлением трифенилхлорметана амальгамой натрия.