Лекция по органической химии. Лекция 2. Лекция 2 Алканы. Строение алканов
 Скачать 102.08 Kb. Скачать 102.08 Kb.
|
|
Лекция 2 Алканы. Строение алканов. АЛКАНЫ - это углеводороды с общей формулой Сп Н2п + 2 в молекулах которых между атомами углерода имеются только одинарные (сигма) связи. В молекулах алканов имеются только одинарные - связи. Все четыре валентности атома углерода в молекулах алканов полностью, т.е. до предела, насыщены атомами углерода и водорода. Между атомами углерода отсутствуют кратные связи. Отсюда происходят другие названия этих углеводородов - насыщенные или предельные. Алканы- sp3 гибридизация электронных орбиталей. Строение молекулы метана - тетраэдическое, углы между орбиталями равны 109°28'. 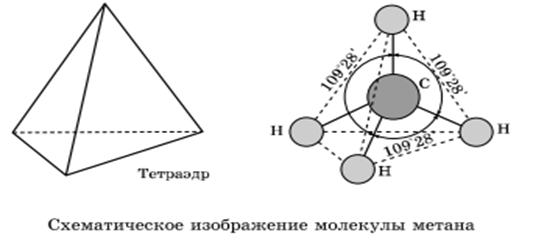 Гомологический ряд: Гомологи — вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СН2. Гомологический ряд метана: СН4-метан С2H6-этан C3H8-пропан C4H10-бутан C5H12-пентан C6H14-гексан C7H16-гептан C8H18-октан C9H20-нонан C10H22-декан Атом углерода во всех органических веществах находится в "возбуждённом" состоянии, имеет на внешнем уровне четыре неспаренных электрона. Каждое электронное облако обладает запасом энергии: s- облако имеет меньший запас энергии, чем р-облако, в атоме углерода они находятся в разных энергетических состояниях. Поэтому при образовании химической связи происходит гибридизация, т. е. выравнивание электронных облаков по запасу энергии. Это отображается на форме и направленности облаков, происходит перестройка (пространственная) электронных облаков. В результате sp3 - гибридизации все четыре валентных электронных облака гибридизованы: валентный угол между этими осями гибридизованных облаков 109° 28', поэтому молекулы имеют пространственную тетраэдрическую форму, форма углеродных цепей зигзагообразна; атомы углерода не находятся на одной прямой, т. к. при вращении атомов валентные углы остаются прежними. Все органические вещества построены в основном за счёт ковалентных связей. Углерод - углеродные и углерод - водородные связи относятся к сигма - связям - это связь, образующаяся при перекрывании атомных орбиталей по линии, проходящей через ядра атомов. Возможно вращение вокруг сигма - связей, поскольку эта связь имеет осевую симметрию. Номенклатура и изомерия Структурные изомеры — соединения, которые обладают идентичным составом, но отличаются порядком связывания атомов в молекуле, то есть молекулы имеют различное химическое строение. Отличие изомеров заключается в разном строении углеродного скелета. К примеру, у н-бутана, то есть алкана с линейной углеводородной цепью, есть изомер — изобутан, который имеет разветвленный углеродный скелет. Бутан: Изобутан 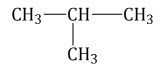 При наличии связи между атомом углерода в молекуле и четырьмя разными заместителями в виде атомов или атомных групп, существует два соединения с идентичной структурой, отличающиеся пространственным расположением атомов. Молекулы подобных соединений являются зеркальным отражением друг друга. При этом невозможно получить одну молекулу из другой путем вращения. Такой вид пространственной изомерии называется оптической изомерией, или энантиомерией. 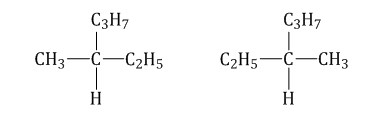 В наименовании алканов используют суффикс «–ан». Простейшие алканы такие, как метан, этан, пропан, бутан и изобутан носят тривиальные названия. Начиная с пятиатомного углероводорода, при формулировке названия неразветвленных (нормальных) алканов используют корень греческого числительного, демонстрирующий количество атомов углерода в молекуле, и прибавляют соответствующий суффикс (для алканов — ан, для алкенов — ен). Правила построения названий разветвленных алканов: Выбор главной углеродной цепи с учетом заместителей в виде углеводородных радикалов. При этом для главной цепи характерна наибольшая длина, она самая разветвленная (с наибольшим количеством заместителей). Нумерация атомов углерода в главной цепи выполняется так, чтобы атомы углерода, обладающие связью с заместителями, имели минимально возможные номера. Названия радикалов начинаются с цифры, обозначающей их положение относительно главной цепи. К примеру, 2-метилпропан. В том случае, когда заместители идентичны, данные цифры отделяют запятыми. Число аналогичных заместителей обозначают приставками ди- (два), три- (три), тетра- (четыре), пента- (пять). Наименования заместителей, включая приставки и цифры, записывают по алфавиту. К примеру, 2,2-диметил-3-этилпентан. Называют главную углеродную цепь, то есть соответствующий нормальный алкан. Например, 2,2,4-триметил-4-этилгексан: 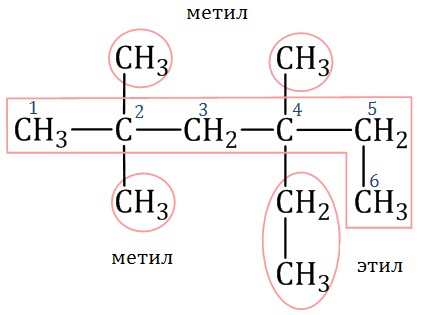 Физические свойства. СН4:C4Н10 - газы T кипения: -161,6:-0,5 °C T плавления: -182,5:-138,3 °C С5Н12:C15Н32 - жидкости T кипения: 36,1:270,5 °C T плавления: -129,8:10 °C С16Н34:и далее- твёрдые вещества T кипения: 287,5 °C T плавления: 20 °C С увеличением относительных молекулярных масс предельных углеводородов закономерно повышаются их температуры кипения и плавления. Газообразные углеводороды при смешивании образуют природный газ. Начиная с n = 16, алканы представляют собой твердые вещества. Очищенные твердые предельные углеводороды получили название «парафин». Получение. В промышленности 1) крекинг нефтепродуктов: C16H34 - C8H18 + C8H16 2) В лаборатории: а) Гидролиз карбидов: Al4C3 +12 H2O = 3 CH4 + 4 Al(OH)3 б) Реакция Вюрца: C2H5Cl + 2Na - C4H10 + 2NaCl в) Декарбоксилирование натриевых солей карбоновых солей: СН3СООNa + 2NaОН - СН4 + Nа2СО3 Химические свойства Для алканов характерны следующие типы химических реакций: замещение атомов водорода; дегидрирование; крекинг; окисление 1) Замещение атомов водорода: А) Реакция галогенирования: CH4 +Cl2 - CH3Cl + HCl Б) Реакция нитрования (Коновалова): CH4 + HNO3 - CH3-NO2 + H2O + Q В) Реакция сульфирования: CH4 + H2SO4 - CH3-SO3 H + H2O + Q 2) Реакция изомеризации: CH3-CH2-CH2-CH2-CH3 - СН3-СН-СН2-СН3 СН3 3) Реакция с водяным паром: CH4 + H2O = CO + 3H2 4) Реакция дегидрирования: 2СН4 - НС=СН + 3Н2 + Q 5) Реакция окисления: CH4 + O2 - Н2C=О + H2O 6) Горение метана: CH4 + 2O2 CO2 + 2H2O + Q Самостоятельно в тетради: «Природные источники алканов. Отдельные представители: вазелин, вазелиновое масло, парафин». |
