Лекция 6 Комплексонометрия. Лекция 6 комплексонометрия (хелатометрия)
 Скачать 3.54 Mb. Скачать 3.54 Mb.
|
|
Лекция 6 КОМПЛЕКСОНОМЕТРИЯ (ХЕЛАТОМЕТРИЯ) Характеристика метода В последнее время в заводских и научно-исследовательских лабораториях широко применяют методы анализа, основанные на использовании реакций, которые сопровождаются образованием комплексных соединений катионов с органическими реактивами — комплексонами. Образующиеся соединения называют внутрикомплексными (клешневидными, хелатными) солями. Понятие о комплексонах. Комплексонами обычно называют органические соединения, представляющие собой производные аминополикарбоновых кислот. Простейший комплексон — нитрилотриуксусная кислота (НТА, комплексон I, сокращенно H3Y): 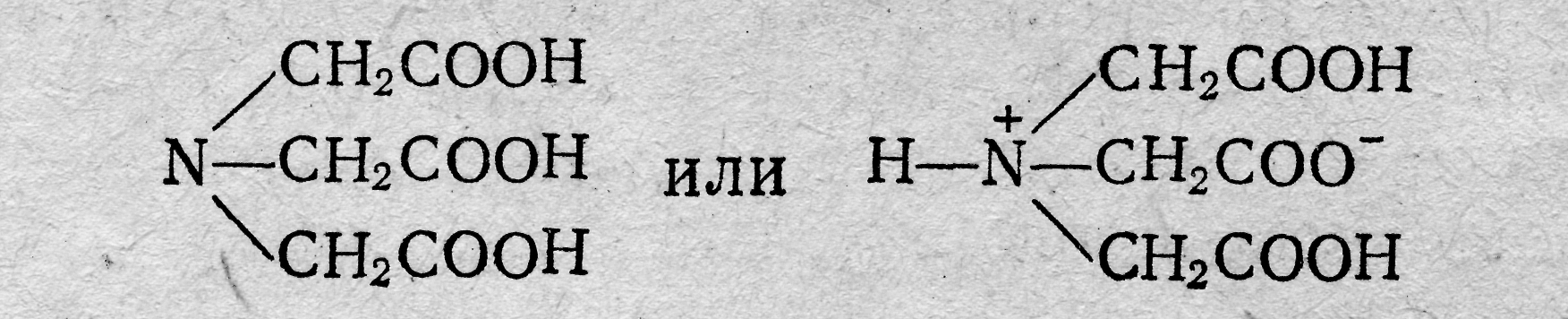 Наибольшее значение имеет четырехосновная этилендиаминтетрауксусная кислота (ЭДТУ, комплексон II, сокращенно H4Y): 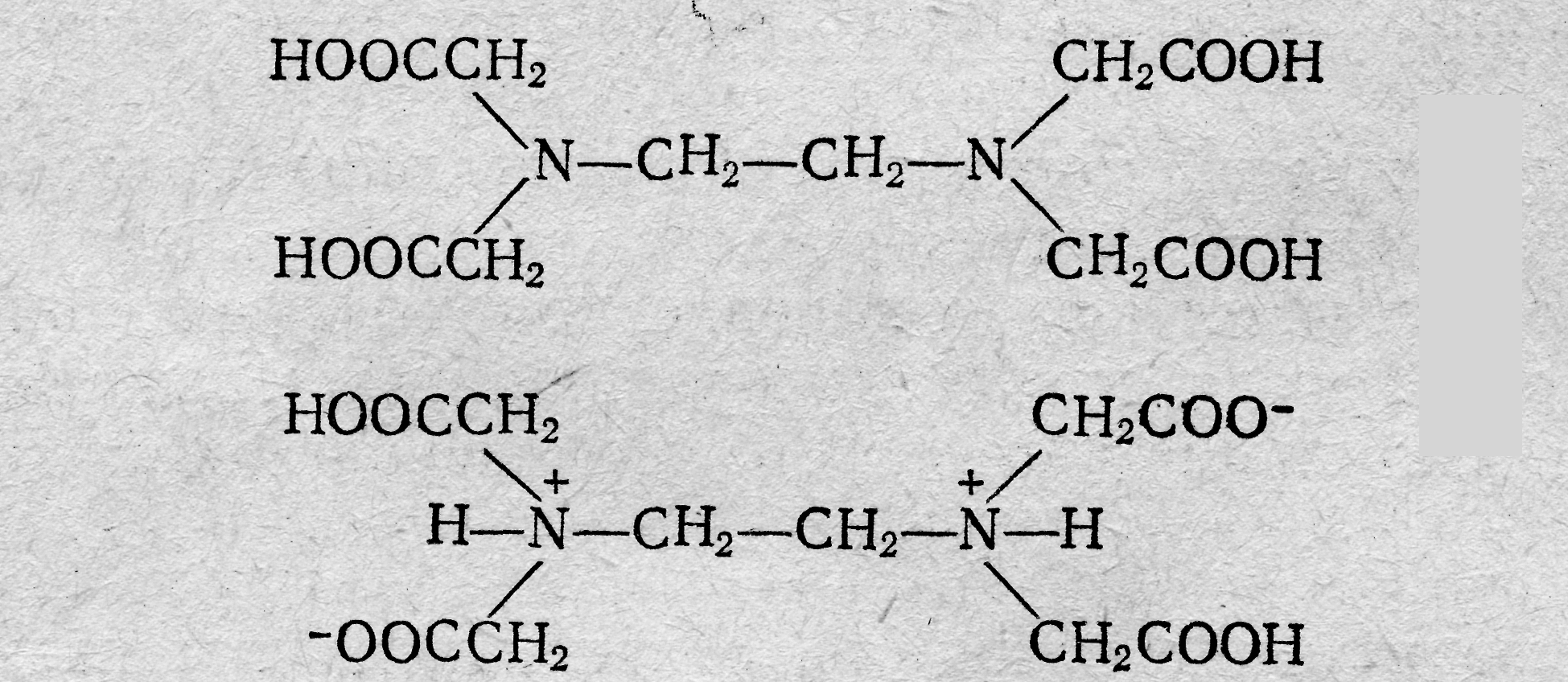 Комплексоны наряду с карбоксильными группами (—СООН) содержат аминный азот (≡≡ N). Благодаря такому строению эти соединения отличаются мульти (поли) дентатностью, т. е. способностью образовывать сразу несколько координационных связей с ионами металлов-комплексообразователей. На практике обычно применяют двунатриевую соль этилендиамин-тетрауксусной кислоты (ЭДТА, Na-ЭДТА, комплексон III или трилон Б, сокращенно Na2H2Y): 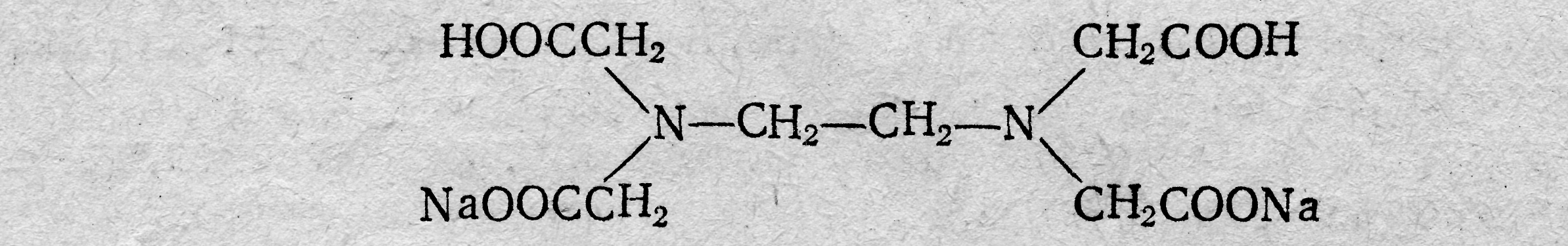 ЭДТА образует со многими катионами устойчивые малодиссоциированные растворимые в воде внутрикомплексные соли, построенные по типу известной комплексной соли диметилглиоксимата никеля. С некоторыми ионами металлов-комплексообразователей комплексоны образуют настолько устойчивые слабые электролиты, что обычными качественными реакциями невозможно доказать присутствие данного катиона в растворе этого комплексного соединения. Реакции между комплексоном и ионами металлов-комплексообразователей протекают стехиометрически, т. е. в строго эквивалентных отношениях; это обстоятельство открывает широкие возможности применения комплексонов для количественного определения многих катионов, в том числе кальция, цинка, меди алюминия, индия и др. Применение комплексонов в аналитической химии. Комплексоны имеют ряд характерных особенностей: 1) хорошо растворимы в воде и некоторых других растворителях; 2) легко реагируют со многими катионами металлов (и в том числе с катионами щелочноземельных металлов, не образующих, как правило, комплексных соединений с другими комплексующими реагентами) с образованием растворимых в воде устойчивых комплексных соединений; 3) некоторые обладают избирательным действием по отношению к тем или иным катионам. Указанные особенности комплексонов обусловили широкое применение их в качестве титрантов в новой области аналитической химии, называемой комплексонометрией, и в качестве маскирующих агентов. Известно большое число методов маскировки ЭДТА и другими комплексонами щелочноземельных, тяжелых, редких и рассеянных металлов, мешающих определению других ионов. Например, ЭДТА маскирует катионы многих металлов, мешающих определению бериллия титриметрическими, фотометрическими, спектрофотометрическими, экстракционно-фотометрическими и другими методами. Использованию комплексонов в качестве маскирующих агентов способствовало то обстоятельство, что комплексонаты металлов имеют различные константы нестойкости (рКнест) и образуются при определенных значениях рН растворов. Комплексонометрическое титрование. Комплексоны широко используются для комплексонометрического титрования многих катионов и анионов (косвенным методом). При этом используют метод прямого и обратного титрования. Впервом случае титрование ведут при определенном значении рН стандартным раствором ЭДТА. Точку эквивалентности устанавливают с помощью индикаторов, представляющих собой органические красители, образующие с катионами окрашенные комплексные соединения (металл-индикаторы). При титровании ЭДТА такого окрашенного комплексного соединения оно постепенно разлагается вследствие образования нового более прочного внутрикомплексного соединения катиона с комплексоном. В точке эквивалентности первоначальный цвет комплексного соединения, образуемого, индикатором с определяемым катионом, исчезает и появляется окраска, свойственная свободномуиндикатору. При" обратном методе титрования к анализируемому раствору прибавляют отмеренный объем стандартного раствора ЭДТА, избыток которого оттитровывают стандартным раствором соли цинка (или другого металла) в присутствии металл-индикатора, реагирующего на ионы цинка (или ионы другого металла). Таким образом, комплексонометрия представляет собой титримет-рический метод анализа, основанный на использовании реакций ионов металлов-комплексообразователей с комплексонами, сопровождающихся образованием устойчивых малодиссоциированных растворимых в воде внутрикомплексных (клешнеевидных) солей. При титровании ЭДТА солей металлов-комплексообразователей протекают следующие реакции в заключительной стадии определения; Na2H2Y ⇆ 2Na+ + H2Y2 ‑ Me2+(Ca2+) + H2Y2 ‑ →MeY2 ‑ + 2H+ Me3+(ln3+) + H2Y2 ‑ →MeY ‑ + 2H+ Me4+ (Тh4+) + H2Y ‑ →MeY + 2H+ Согласно приведенным уравнениям, 1 моль реагирующих с Na-ЭДТА-катионов, независимо от их степени окисления, связывает 1 моль Na-ЭДТА. Типы реакций, используемых при комплексонометрическом титровании. В комплексонометрии применяют реакции разнообразного типа. Реакции непосредственного взаимодействия ионов металла ком-плексообразователя с комплексоном; например, реакции, применяемые для определения ионов цинка в аммиачной буферной среде или ионов кальция в среде КОН и т. д. в присутствии индикатора, реагирующего на изменение рМе аналогично тому, как кислотно-основной индикатор реагирует на изменение рН раствора:
Реакции взаимодействия избытка комплексона со стандартным раствором сульфата цинка, магния, железа (III) и т. п.; например, реакции, используемые для определения алюминия (при рН = 5 ацетатный буферный раствор), при котором комплексон прибавляют в титруемый раствор в избытке (а), а затем избыток реагента оттитровывают стандартным раствором (б):
3. Реакции взаимодействия заместителей с определяемым элементом, завершаемые титрованием выделившихся ионов заместителя стандартным раствором ЭДТА. 4. Реакции кислотно-основного титрования, при которых замещенные ионы водорода оттитровывают стандартным раствором сильного основания в присутствии кислотно-основного индикатора (а) или иодометрическим методом (б):
Выделившийся иод оттитровывают тиосульфатом: 6S2O32 ‑ + 3I2 →3S4О62 ‑ + 6 I ‑ Другие типы комплексонов. К числу новых комплексующих реагентов относятся фосфорорганические комплексоны, являющиеся производными аминоалкилфосфоновых кислот. Например: Этилендиаминтетраметилфосфоновая кислота (ЭДТФ) [(HO)2P(O)CH2]2N—CH2—CH2—N[CH2P (О) (ОН)2]2 и этилендиамин - N,N' - диуксусная - N, N' - диметилфосфоновая кислота (ЭДУФ)
Аминоалкилфосфоновые кислоты обладают комплексующими свойствами благодаря протонно-донорным функциям кислотных групп и наличию аминных атомов азота, склонных к образованию клешневидных соединений. Свойства этих комплексонов настолько разнообразны, что они дают возможность проводить дифференцированные определения в смесях. Например, этилендиаминдиизопропилфосфоновая кислота (ЭДДИФ) не образует комплексов с ионами щелочноземельных металлов. Это позволяет комплексонометрически определять катионы элементов первого переходного периода в присутствии катионов щелочноземельных металлов. Строение образуемых внутрикомплексных солей, Анион этиленди-аминтетрауксусной кислоты как четырехосновной кислоты, содержащей четыре подвижных иона водорода и два атома азота с основными свойствами, обладает всего шестью атомами, которые участвуют в качестве лигандов при построении пятичленных циклов внутрикомплексных соединений. Классическими примерами такого типа соединений являются: гликоколят меди 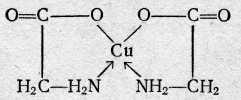 диметилглиоксимат никеля 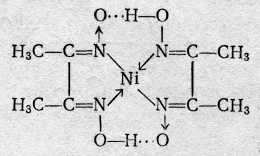 Внутрикомплексные соли образуются во всех случаях, когда ионы металла-комплексообразователя, с одной стороны, замещают активные атомы водорода функциональных групп органического соединения, а с другой стороны, — взаимодействуют с какими-либо группами, способными сочетаться с данным ионом координационной связью. Примерами групп, содержащих ионы водорода, которые способны замещаться на ионы металлов, и взаимодействующих с ионами металла-комплексообразователя за счет главной валентности служат, карбоксильная —СООН, сульфоксильная —SO3H, оксимная =NOH, гидроксильная —ОН и другие группы. Примерами групп, соединяющихся с ионами металла-комплексо-образователя координационной (донорно-акцепторной) связью, служат: аминогруппа —NH2, иминогруппа =NH, оксимная группа =NOH, карбонильная =СО, тиоэфирная —S— и некоторые другие. В комплексонах группами, взаимодействующими с ионами металла-комплексообразователя за счет главной валентности, являются—СООН-группы, а побочной валентности — третичные аминогруппы. Внутрикомплексные соли с ЭДТА образуются, с одной стороны, за счет замещения ионами металла-комплексообразователя активных атомов водорода карбоксильных групп, с которыми он соединяется главными валентностями, а с другой стороны, — взаимодействия с атомами азота, способными сочетаться с данным ионом металла-комплексообразователя посредством побочной (координационной) валентности. Способы фиксирования точки эквивалентности. Определение точки эквивалентности при комплексонометрическом титровании может быть проведено различными способами. Во-первых, используют обычные кислотно-основные индикаторы, так как реакция комплексообразования сопровождается выделением Н+-ионов в количестве, эквивалентном количеству определяемого катиона: Me2+ + H2Y2 ‑ → MeY2 ‑ + 2H+ Выделившуюся кислоту определяют методом нейтрализации с обычными кислотно-основными индикаторами. Во-вторых, применяют металл-индикаторы, представляющие собой органические красители, которые образуют с катионами определяемых элементов растворимые в воде окрашенные комплексные соединения. Получаемые при этом комплексные соединения менее устойчивы, чем внутрикомплексные соли, образуемые определяемыми катионами с комплексонами. Поэтому в процессе титрования комплексоном раствора, содержащего окрашенное комплексное соединение, образуемое определяемыми катионами с индикатором, в точке эквивалентности наблюдается изменение окраски раствора. Это объясняется тем, что комплексное соединение индикатора разрушается и индикатор выделяется в свободном виде. Так как окраска комплексного соединения индикатора отличается от окраски свободного индикатора, то происходит изменение окраски титруемого раствора. Схематично это можно представить следующим образом; Kt2+ + 2HInd ⇄ Ktlnd2 + 2Н+ бесцветный окрашен окрашен в иной цвет Ktlnd2+H2Y2 ‑ →KtY2 ‑ + 2HInd окрашен бесцветен окрашен Таким образом, металл-индикатор реагирует на изменение концентрации катиона аналогично тому, как кислотно-основной индикатор ведет себя при изменении рН титруемого раствора. В-третьих, для фиксирования точки эквивалентности применяют окислительно-восстановительные (ред-окс) индикаторы и инструментальные методы. Индикаторы. В качестве индикаторов при комплексонометрических титрованиях часто применяют красители: кислотный хром темно-синий, кислотный хромоген черный специальный (иначе называемый эриохром черный Т или хромоген специальный ЕТ 00) и др. Эти индикаторы в щелочной среде имеют синюю окраску. Ионы кальция, магния и ряда других металлов образуют с индикаторами внутрикомплексные соединения, окрашенные в вишнево-красный цвет. При титровании ЭДТА раствора, содержащего определяемый катион и индикатор, ионы металла переходят от молекулы индикатора к молекуле ЭДТА, при этом выделяется свободный индикатор. В точке эквивалентности красная окраска раствора переходит в синюю, свойственную индикатору. Эриохром черный Т. Эриохром черный Т является органическим азокрасителем группы о,о’-диоксиазонафталина: 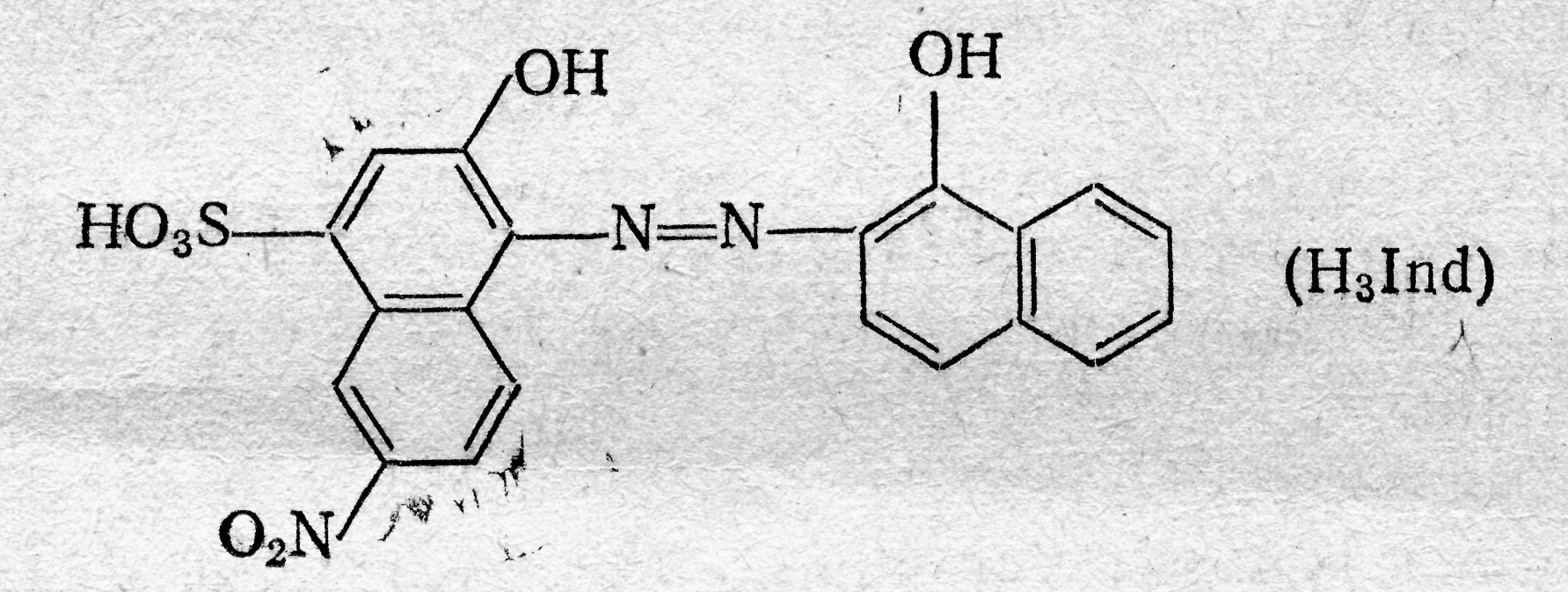 диссоциирующий с образованием Н+, H2Ind ‑, Hind2 ‑, Ind3 ‑. В его молекулу входят две фенольные группы и хромофорная азогруппа. Поэтому Эриохром черный Т способен реагировать с ионами металла-комплексообразователя с образованием комплексных соединений. Сам индикатор окрашен в синий цвет. В нейтральной или щелочной среде при рН = 7 11 он образует с ионами металлов (Cu2+, Mg2+, Zn2+, Mn2+, In3+, Al3+ и др.) соединения красного цвета. Уравнение реакции можно представить в следующем виде: заключительная стадия титрования ЭДТА протекает согласно уравнению Ме2+ + HInd2 ‑ ⇄ Melnd ‑ + H+ синий красный Melnd ‑ + Na2H2Y + ОН‑ → Na2MeY + Hind2 ‑ + Н2О Для поддержания рН раствора на требуемом уровне обычно в титруемый раствор добавляют аммиачную буферную смесь. Мурексид (пурпурат аммония). Мурексид представляет собой темно-красный порошок. Водный раствор мурексида окрашен в фиолетово-красный цвет, изменяющийся в зависимости от среды: при рН = ≤9 - красно-фиолетовый, . рН = 9—10 — фиолетовый, рН >11— сине-фиолетовый. С катионами кальция, никеля, кобальта, меди и другими мурексид образует комплексные растворимые в воде соединения красного или желтого цвета, разлагаемые ЭДТА с образованием более устойчивых внутрикомплексных солей. В процессе титрования солей кальция и других металлов в присутствии мурексида в точке эквивалентности наблюдается изменение красного цвета раствора в сине-фиолетовый цвет. Структурную формулу мурексида можно представить следующим образом: 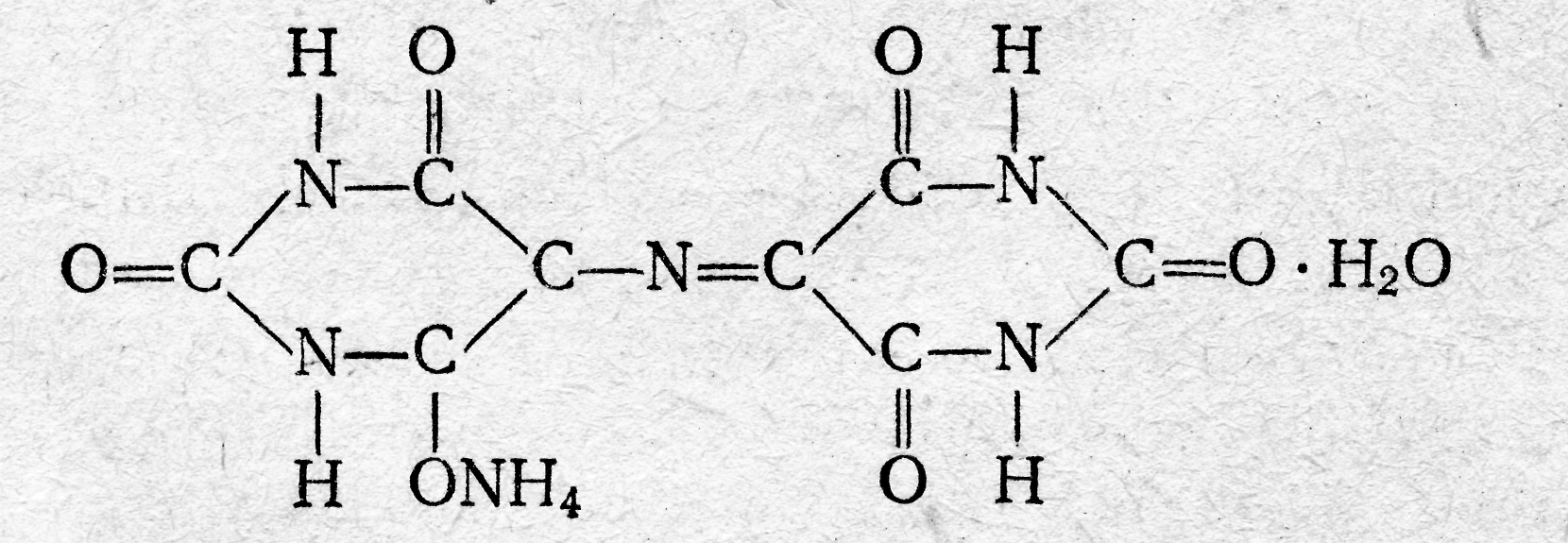 Уравнение электронейтральности раствора при титровании ЭДТА катионов. В процессе взаимодействия ЭДТА с катионами металлов протекают разнообразные реакции, обусловленные состоянием многих динамических равновесий, которые устанавливаются между ионами водорода, гидроксила, анионами ЭДТА, комплексонатов определяемого катиона и самого катиона металла, анионами анализируемой соли и ионами натрия. Уравнение электронейтральности раствора можно представить следующим образом: [H+] + [Na+I + 2[Me2+] = [ОН ‑] + [An ‑] + [H3Y ‑] + 2[H2Y2 ‑] + 2[MeY2 ‑] + 3[НY3 ‑] + 4[Y4 ‑] Взаимодействие катионов металла с комплексоном, рассмотренное в § 26, отражает заключительную стадию титрования. На самом деле реакции титрования комплексоном более сложны. Доказано, что взаимодействие катионов металлов в степени окисления 2+ с ЭДТА протекает с образованием не только комплексов средней соли состава MeY2 ‑, но и кислых (протонированных) форм комплекса состава MeHY ‑; Ме2+ + H2Y2 ‑ ⇄ MeY2 ‑ + 2Н+ (а) Ме2+ + H2Y2 ‑ ⇄MeHY ‑ + Н+ (б) Как видно из уравнения электронейтральности, при всех прочих равных условиях, содержимое Ме2‑ в растворе в значительной степени зависит от рН среды. Условия комплексонометрического титрования. Основным условием комплексонометрического титрования является требование, предъявляемое к реакции, которая должна протекать таким образом, чтобы в точке эквивалентности определяемые катионы были практически полностью связаны в комплекс. Константа нестойкости таких комплексов должна быть очень незначительной. При этом определяемые катионы должны образовывать с металл-индикатором комплексы, отличающиеся меньшей прочностью, чем их комплексы с комплексоном. Титрование ЭДТА проводится при строго определенных условиях, из которых наибольшее значение имеет соблюдение требуемого значения рН. титруемого раствора. В сильно кислых растворах с рН < 3 образуются менее устойчивые кислые комплексные соединения. Комплексообразованию устойчивых комплексных соединений способствует повышение значения рН титруемого раствора. Однако в сильнощелочных растворах при рН >10 наблюдается образование комплексных оксосоединений или осадков гидроокисей определяемых компонентов. Следует также иметь в виду, что при образовании комплекса определяемого катиона с комплексоном освобождаются ионы водорода, рН раствора понижается. Поэтому, если титруемые растворы не защищены действием буферной смеси, рН. раствора может понизиться на несколько единиц и требуемые комплексные соединения не образуются. Чтобы поддержать рН раствора на заданном уровне, необходимо проводить титрование в буферных растворах, отвечающих определенному значению рН. Концентрация свободных анионов Y4 ‑ в кислых растворах ЭДТА ничтожно мала. Числовые значения обратных логарифмов (рК) констант диссоциации H4Y приведены ниже: H4Y ⇄ H+ + H3Y ‑ (pК = 2,0) H3Y ‑ ⇄H+ + H2Y2 ‑ (pК2 = 2,67) H2Y2 ‑ ⇄H+ + HY3 ‑ (рК3=6,16) НY3 ‑ ⇄ H+ + Y4 ‑ (pК4 = 10,26) Суммарная константа, являющаяся произведением отдельных констант, равняется 10 ‑21'09, что соответствует рК — 21,09. Эти данные говорят о том, что HY3 ‑ является очень слабой кислотой и поэтому 6 растворе H4Y концентрация Y4 ‑ очень мала. Можно рассчитать [Y4 ‑], применив закон действия масс; [H+]4[Y4 ‑] ╱ [H4Y] = KH4Y [Y4 ‑] = KH4Y[H4Y] ╱ [H+]4 Это уравнение показывает, что [Y4 ‑] сильно зависит от концентрации ионов водорода. По мере увеличения [Н+] уменьшается [Y4 ‑]. Концентрация свободных Y4 ‑ иohob 0,1 н. раствора ЭДТА в 0,1 н. растворе хлористоводородной кислоты (рН=1) равна: [Y4 ‑] = (10 ‑21,09 • 10 ‑1) ╱ (10 ‑1)4 = 10 ‑18,09 моль/л Только катионы (Fe3+, In3+, Sc3+, ZrIV, ThIV), образующие очень прочные комплексы с комплексоном, титруются в кислой среде. Катионы, образующие менее прочные комплексы с комплексоном, не титруются в кислой среде и не мешают титрованию катионов, определяемых в кислом растворе. Вот почему титрование большинства катионов обычно проводят в аммиачной буферной среде (NH3 + NH4Cl) при рН = 8—9. Во избежание образования осадков гидроокисей и с целью маскировки отдельных катионов наряду с буферными смесями добавляют вспомогательные комплексообразующие вещества: тартраты или цитраты для Mn2+, Pb2+, In3+; тайрон (динатриевая соль 1,2-диоксибензол-3,5-дисульфокислоты) или фторид натрия для Ве2+, Al3+, TiIV; цианид калия для Zn2+, Cu2+, Cd2+ и т. д. Благодаря этому удается успешно проводить комплексонометрическое титрование большинства катионов и косвенным путем анионов. Классификация методов комплексонометрического титрования Метод прямого титрования. Анализируемый раствор, содержащий катионы определяемого металла, разбавляют в мерной колбе и берут для титрования аликвотную часть раствора. Титрование ведут стандартным раствором ЭДТА в щелочной среде с эриохромом черным Т или в кислой среде с ксиленовым оранжевым. Для этого титруемый раствор предварительно перед титрованием доводят до определенного значения рН при помощи буферного раствора. Наряду с буферным раствором иногда добавляют еще вспомогательный комплексующий агент (тартрат, цитрат и др.), связывающий некоторые катионы и удерживающий их в растворимом состоянии во избежание выпадения осадков гидроокисей в щелочном растворе. В процессе прямого титрования концентрация определяемого катиона сначала снижается постепенно, затем вблизи точки эквивалентности резко падает. Этот момент замечается по изменению окраски введенного индикатора, мгновенно реагирующего на изменение концентрации катионов металла-комплексообразователя. Методом прямого комплексонометрического титрования определяют Cu2+, Cd2+, Pb2+, Ni2+, Со2+, Fe3+, Zn2+, ThIV, Al3+, Ba2+, Sr2+, Ca2+, Mg2+ и некоторые другие катионы. Определению мешают комплексующие вещества, удерживающие определяемые ионы в виде комплексных ионов, которые не разрушаются комплексонами. Метод обратного титрования. В тех случаях, когда по тем или иным причинам невозможно провести прямое титрование определяемого катиона, пользуются методом обратного титрования. К анализируемому раствору прибавляют точно измеренный объем стандартного раствора комплексона, нагревают до кипения для завершения реакции комплексообразования и затем на холоду оттитровывают избыток комплексона титрованным раствором MgSO4 или ZnSO4. Для установления точки эквивалентности применяют металл-индикатор, реагирующий на ионы магния или цинка. Метод обратного титрования применяют в тех случаях, когда нет подходящего индикатора на катионы определяемого металла, когда в буферном растворе катионы образуют осадок и когда реакция комплексообразования протекает медленно. Методом обратного титрования также определяют содержание катионов в нерастворимых в воде осадках (Са2+ в СаС2О4, Mg2+ в MgNH4PO4, Pb2+ в PbSO4 и т. п.). Метод титрования заместителя. В некоторых случаях вместо описанных выше методов пользуются методом титрования заместителя. Метод комплексонометрического титрования заместителя основан на том, что Mg2+-ионы дают с комплексоном менее устойчивое комплексное соединение (рК = 8,7), чем подавляющее большинство других катионов. Поэтому, если смешать катионы определяемого металла с магниевым комплексом, то при этом произойдет реакция обмена. Например, эта реакция используется для определения ионов тория, когда в анализируемый раствор предварительно вводят комплексонат магния MgY2 ‑, а затем оттитровывают выделившиеся Mg2+-ионы стандартным раствором ЭДТА (б);
Вследствие того, что ThIV образует с комплексоном более устойчивое комплексное соединение, чем Mg2+, равновесие реакции (а) сдвигается вправо. Если по окончании реакции вытеснения оттитровать Mg2+ стандартным раствором ЭДТА в присутствии эриохром черного Т, то можно рассчитать содержание ТhIV-ионов в исследуемом растворе. Метод кислотно-основного титрования. В процессе взаимодействия комплексона с теми или иными катионами металлов выделяется определенное количество эквивалентов ионов водорода. Образующиеся при этом в эквивалентном количестве ионы водорода оттитровывают обычным алкалиметрическим методом в присутствии кислотно-основного индикатора или другими способами. Существуют и другие методы комплексонометрического титрования, описание которых не входит в нашу задачу. Установка титра раствора ЭДТА Для приготовления стандартного (титрованного) раствора ЭДТА применяют двунатриевую соль этилендиаминтетрауксусной кислоты, кристаллизующуюся с двумя молекулами воды; ее состав отвечает формуле Na2C10N14O8N2 2H2O. Если двунатриевую соль, содержащую кристаллизационную воду, высушить при 120—140°С, то получается безводная соль, состав которой соответствует формуле Na2C10H14O8N2. Обе соли могут служить исходными веществами для приготовления стандартного раствора ЭДТА. Для приготовления 1 л 0,1 н. раствора ЭДТА надо взять: MNa2C10H14O8N22H2O╱2 • 10 = 372,24╱ 2 • 10 = 18,61 г MNa2C10H14O8N2 ╱2 • 10 = 336,21╱ 2 • 10 = 16,81 г Для установки титра ЭДТА применяют х. ч. карбонат кальция, х. ч. ZnO или х. ч. металлический цинк, рассчитанную навеску которых растворяют в х. ч. хлористоводородной или серной кислоте, нейтрализуют едким натром или аммиаком, разбавляют аммиачным буферным раствором и титруют стандартным раствором ЭДТА в присутствии необходимого индикатора. Под „конец титруют медленно. Титр раствора может быть установлен также по фиксаналу соли магния (в продаже имеются 0,01 и 0,05 н. растворы сульфата магния). По результатам титрования рассчитывают Т, N и К раствора ЭДТА. Определение содержания кальция Методы количественного определения кальция. Существуют различные методы определения кальция. Гравиметрические методы. 1. Осаждение в виде оксалата СаС2О4-Н2О и взвешивание в виде СаСО3 или СаО (см. «Гравиметрический анализ»). 2. Осаждение в виде сульфата CaSO4 из спиртового раствора. 3. Осаждение в виде пикролоната Ca(C10H7O5N4)28H2O. Титриметрические методы. 1. Осаждение в виде оксалата кальция и последующее определение связанного с кальцием оксалат-иона методом перманганатометрии или цериметрии. 2. Осаждение в виде молибдата СаМоО4, восстановление молибдена и титрование его ванадатом аммония. 3. Комплексонометрический метод. Гравиметрический метод определения кальция имеет весьма существенные недостатки. 1. Определение содержания кальция в различных технических объектах гравиметрическим методом представляет собой весьма длительную операцию. 2. Осаждение ионов кальция в виде СаС2О4 связано с большими трудностями, обусловливаемыми невозможностью достижения количественного выделения оксалата кальция; 3. Осадок оксалата кальция бывает часто загрязнен посторонними примесями, и его трудно выделить в химически чистом виде. 4. Получение весовой формы (СаО) связано с применением относительно высокой температуры, необходимой для термического разложения оксалата кальция. 5. Получаемая весовая форма (СаО) нестабильна и подвергается действию влаги и двуокиси углерода воздуха, вследствие чего ее масса меняется в зависимости от условий получения и хранения. Поэтому в настоящее время гравиметрический метод определения кальция утратил прежнее свое значение и вытеснен более прогрессивными титриметрическими методами анализа. Перманганатометрический метод определения кальция отличается рядом преимуществ по сравнению с гравиметрическим методом анализа. Одним из таких преимуществ является более быстрое завершение операции определения. Однако перманганатометрическому методу определения кальция, основанному на осаждении ионов кальция в виде оксалата и последующем титровании оксалат-ионов перманганатом, свойственны многие недостатки анализа, связанные с невозможностью полного количественного осаждения и отделения оксалата кальция. Из титриметрических методов анализа наиболее точным и быстрым методом определения кальция, несомненно, является комплексонометрическое титрование ионов кальция ЭДТА. Комплексонометрический метод определения кальция. Комплексо-нометрическое определение кальция, основано на прямом методе титрования его ионов стандартным раствором ЭДТА в присутствии мурексида или кислотного хром темно-синего. Индикатор образует с ионами кальция комплексное соединение красного цвета. При титровании раствора ЭДТА в точке эквивалентности красная окраска переходит в окраску, характерную для свободного индикатора. В результате титрования солей кальция ЭДТА происходит образование комплекса CaY2 ‑ и кислоты: Са2+ + H2Y2 ‑ ⇄CaY2 ‑ + 2Н+ Образующийся комплекс CaY2 ‑ относительно неустойчив: [Ca2+][Y4 –]╱[CaY2 ‑] =310 ‑11 Образование свободной кислоты во время реакции или прибавление ее в титруемый раствор перед титрованием сдвигает указанное равновесие влево, т. е. в сторону разрушения комплекса. ЭДТУ является четырехосновной кислотой, характеризуется следующими константами: pK1= 2; рК2 = 2,7; рК3 = 6,2; рК4 = 10,3 и представляет собой относительно слабую кислоту, поэтому рН раствора ее комплекса с Са2+ не должен быть ниже 10,3. Если рН будет меньше, то Y4 ‑ с Н+ образует соответствующие гидроанионы: HY3 ‑, H2Y2 ‑, H3Y ‑ и кислоту H4Y. При этом комплекс CaY2 ‑ разрушается или не образуется совсем. Таким образом, устойчивость внутрикомплексной соли, образуемой ионами кальция с ЭДТА, зависит от рН раствора. Для обеспечения оптимального течения реакции образования комплекса CaY2 ‑ титрование солей кальция раствором ЭДТА нужно проводить в сильнощелочной среде при рН > 12. В этом случае достигается полная нейтрализация образующейся в процессе титрования свободной кислоты и наблюдается максимальный скачок кривой титрования.
Объем ЭДТА , мл Рис. 6.1 Кривые титрования ионов кальция комплексонометрическим методом при различных значения рН раствора: 1 – рН =6; 2 – рН = 8; 3 – рН = 10; 4 – рН = 12 Определение жесткости воды комплексонометрическим методом Жесткость воды выражают числом миллиграмм-эквивалентов кальция и магния в 1 л. Определение общей жесткости проводят путем комплексонометрического титрования раствором ЭДТА в присутствии эриохром черного или хром темно-синего. Обычно определяют суммарное количество кальция и магния. При необходимости раздельного определения кальция и магния сначала определяют суммарное их количество. Затем в отдельной пробе осаждают кальций в виде оксалата кальция и оттитровывают ионы магния. Кальциевую жесткость определяют по разности. В присутствии некоторых примесей ход анализа изменяется. Ионы меди и цинка переводят в сульфиды и, чтобы марганец не окислялся, прибавляют гидроксиламин. Присутствие в воде СI ‑, SO42 ‑ и НСО3‑ не мешает определению общей жесткости. Так как рПРCа2CO3 < pK компл. Са2+, осадок карбоната кальция растворяется и кальций количественно оттитровывают ЭДТА. Расчет. Жесткость воды вычисляют по формуле: Ж = 0,05VK 1000 ∕ VH2O = 50VK∕VH2O где Ж — жесткость воды, мг-экв/л; V — объем израсходованного раствора ЭДТА, мл; К— поправочный коэффициент 0,05 н. раствора ЭДТА; VH2O— объем взятой для исследования воды, мл, Анализ смеси ионов кальция и магния Раздельное определение ионов кальция и магния при их совместном присутствии основано на предварительном определении общего содержания ионов кальция и магния титрованием аликвотной части анализируемого раствора стандартным раствором ЭДТА в присутствии эриохром черного Т (или кислотного темно-синего) и последующем определении в отдельной пробе содержания ионов кальция титрованием аликвотной части в присутствии мурексида. Методика определения. Пробу анализируемой смеси помещают в мерную колбу, разбавляют дважды перегнанной дистиллированной (или деионизированной) водой, доводят до метки и тщательно перемешивают. Из мерной колбы отбирают аликвотную часть полученного раствора, добавляют 50 мл дважды перегнанной дистиллированной воды, 25 мл аммиачной буферной смеси, 2—3 капли эриохром черного Т (или кислотного хром темно-синего) и титруют стандартным, раствором ЭДТА до перехода винно-красной окраски раствора в фиолетово-синюю. Под конец титрование проводят очень медленно. На титрование смеси ионов кальция и магния идет объем раствора ЭДТА — К’ЭДТА. Для определения содержания ионов кальция вновь отбирают аликвотную часть раствора, добавляют 5 мл 20%-ного раствора NaOH, доводят общий объем до 100 мл, вносят на кончике шпателя 30—40 мг смеси мурексида с хлоридом натрия и титруют стандартным раствором ЭДТА до перехода красной окраски в фиолетовую. На титрование ионов кальция идет объем раствора ЭДТА, равный V”эдта. Расчет. Содержание ионов кальция вычисляют по формуле: g Са2+ = ЭСа2+ (V”ДЭТАNЭДТАVк∕1000 VА Содержание ионов магния вычисляют по формуле: g Mg2+ ‑ ЭMg2+ (V'ЭДТА – V”ЭДТА) NЭДТА VK ∕ l000 VA | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


 етиловый красный
етиловый красный Н = 2
Н = 2 Са
Са 3
3 2
2 1
1