1.1. Болезни кроветворной системы. Лекция Болезни кроветворной системы
 Скачать 188.33 Kb. Скачать 188.33 Kb.
|
|
Лекция 1.1. Болезни кроветворной системы Гематологические заболевания могут быть первичными, то есть вызванными болезнью собственно кроветворных органов, или вторичными, отражающими поражение каких-либо других систем. Морфологическое исследование клеток крови (цитологическое, гистологическое, гистохимическое, иммуногистохимическое и т.п.) проводят либо в мазке, либо в пунктате костного мозга или лимфатического узла. Изучают аспирационные биоптаты и трепанобиоптаты (трепанобиопсия - прокол кости с помощью специальной иглы, обычно в области гребня подвздошной кости). Кроветворение (син. гемопоэз) - процесс, заключающийся в серии клеточных дифференцировок, в результате которых образуются зрелые клетки крови. ДИФФЕРЕНЦИРОВКА КЛЕТОК КОСТНОГО МОЗГА Согласно современной теории кроветворения, различают 6 классов кроветворных клеток. Нормальное кроветворение - поликлональное, т.е. осуществляется одновременно многими клеточными клонами. Современная теория кроветворения основана на унитарной теории гистолога А.А. Максимова (1874-1928), согласно которой все гемопоэтические клетки имеют костномозговое происхождение, т.е. клетки крови происходят из единой родоначальной клетки - полипотентной (плюрипотентной) стволовой кроветворной клетки. При делении стволовая клетка образует две клетки, причем одна из них сохраняет свойства стволовой, а другая обладает способностью к дифференцировке во все без исключения клетки крови, и дает начало двум коммитированным клеткам - родоначальницам миелоидного и лимфоидного ростков. Дифференцированными клетками миелоидного ростка являются эритроциты, моноциты, гранулоциты (нейтрофилы, эозинофилы, базофилы), мегакариоциты (при их фрагментации образуются безъядерные элементы - тромбоциты). Производные лимфоидного ростка - Т-лимфоциты, В-лимфоциты (конечный продукт их развития - плазматические клетки) и естественные (натуральные) киллеры (NK). Степень дифференцировки может быть установлена на основе экспрессии ряда дифференцировочных антигенов (кластеров дифференцировки - CD) на цитолемме. В настоящее время можно определять около 200 CD. Дифференцировка клеток управляется программами, закодированными в ДНК, которые приводят в действие сигналы, идущие к ядрам клеток от рецепторов плазмолеммы. Регуляция пролиферации и дифференцировки клеток-предшественников осуществляется цитокинами (ИЛ-1, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, фактор стволовых клеток), эритропоэтином и другими гуморальными факторами. Гены, кодирующие большинство гуморальных факторов, по сути играющих роль факторов роста, находятся в длинном плече хромосомы 5, которая чаще всего подвергается аберрации при болезнях крови. У взрослого человека гемопоэз осуществляется в красном костном мозге проксимальных отделов длинных трубчатых костей, тел позвонков, ребер, грудины, костей таза и черепа. Биопсию костного мозга делают в любом из указанных мест, кроме костей черепа. Жировой костный мозг способен возвращаться к состоянию кроветворного органа в тех случаях, когда организм нуждается в увеличенном количестве форменных элементов крови или при опухолевой пролиферации клеток крови. Если регенераторные возможности костного мозга исчерпаны, развивается экстрамедуллярный (внекостномозговой) гемопоэз сначала в печени, затем селезенке и лимфатических узлах. Клеточная продукция нормального кроветворения составляет более 300 млн клеток в минуту. Каждый день происходит потеря 1×10 11 клеток крови. Объем циркулирующей крови у взрослого человека достигает 5 л. При центрифугировании столбика венозной крови 45% ее массы представлены клетками, общее количество которых отражает гематокрит, т.е. отношение объема форменных элементов крови к объему плазмы. Оставшиеся 55% массы крови составляет ее плазма. Повышение гематокрита происходит либо при увеличении общей массы эритроцитов, например при эритроцитозе, либо вследствие снижения объема плазмы крови. Снижение гематокрита - это следствие уменьшения эритроцитарной массы крови (при анемии) или возрастания объема плазмы. Концентрация эритроцитов и содержание белков в плазме определяют вязкость крови. Полицитемия (греч. poly много + гистологическое cytus клетка + haima кровь; синоним: истинная полицитемия, эритремия, болезнь Вакеза) возникает при одновременном изменении количества нескольких типов клеток. Это заболевание - вариант миелопролиферативных заболеваний (см. ниже). Панцитопения (pancytopenia; пан- + гист. cytus клетка + греч. penia бедность, недостаток; син. пангемоцитопения) - низкое содержание всех форменных элементов крови, ведущий лабораторный признак апластической анемии, один из ранних признаков развивающегося острого лейкоза; причинами панцитопении могут быть токсические вещества и аутоиммунные процессы. НАРУШЕНИЯ СИСТЕМЫ ЭРИТРОЦИТОВ. ИЗМЕНЕННЫЕ ЭРИТРОЦИТЫ Дифференцировка и созревание клеток эритропоэза происходят в костном мозге. Эритрон - система, объединяющая самые ранние предшественники эритроидного ряда, морфологически идентифицируемые пролиферирующие и непролиферирующие ядросодержащие клетки, ретикулоциты и эритроциты. Родоначальными клетками красного ростка являются коммитированные предшественники эритропоэза, которые образуются из стволовой полипотентной клетки, претерпевая 5-10 делений. Дифференцировка и созревание эритроидных клеток опосредуются эритропоэтином, связывание которого с соответствующим рецептором предотвращает апоптоз клеток. Синтез гемоглобина начинается со стадии проэритробласта. По мере созревания размер клетки уменьшается, на стадии ретикулоцита ядро не определяется. Некоторые клетки на стадии базофильного эритробласта (10%) достигают критической массы гемоглобина и погибают, это называется неэффективным эритропоэзом. Снижение митотической активности приводит к увеличению размеров эритроцитов (макроцитозу), что встречается при мегалобластной (макроцитарной) анемии. Повышение митотической активности сопровождается уменьшением размеров эритроцитов (микроцитозом), что наблюдается, например, при железодефицитной анемии. Продолжительность жизни эритроцитов в норме 120 дней, ежесуточно заменяется 1/120 часть общего их количества. Разрушение старых эритроцитов осуществляется путем фагоцитоза макрофагами, преимущественно в селезенке. Вновь поступающие в кровоток клетки называются ретикулоцитами, их количество в периферической крови взрослого человека колеблется в пределах 0,5-2% от общего количества эритроцитов. Абсолютное содержание ретикулоцитов в норме у взрослых 25-75×10 9/л. Содержание ретикулоцитов в крови отражает эритропоэтическую активность костного мозга, оно возрастает при кровопотерях, гемолизе, в ответ на гемотерапию, и уменьшается при гипои апластической анемиях, обострении В12-фолиеводефицитной анемии, метастазах рака в костный мозг и др. Некоторые нормальные характеристики эритроцитов, гематокрита и уровня гемоглобина представлены в табл. 9.1. Таблица 9.1. Нормальные показатели для эритроцитов (в средних величинах ± стандартные отклонения)
Снижение количества эритроцитов часто встречается в клинической практике и является одним из характерных признаков анемий и острой кровопотери. Эритроцитоз Эритроцитозы - увеличение содержания гемоглобина и количества эритроцитов, не обусловленное заболеваниями системы крови. Эритроцитозы могут быть: • абсолютными, вызванными реактивным усилением нормального эритропоэза, при которых масса циркулирующих эритроцитов увеличена; • относительными - гемоконцентрационными, характеризующимися уменьшением объема циркулирующей плазмы и относительным преобладанием клеточных элементов крови, при этом масса циркулирующих эритроцитов не изменена. По патогенезу среди абсолютных выделяют эритроцитозы, обусловленные генерализованной тканевой гипоксией (артериальной гипоксемией и изолированной тканевой гипоксией с нормальным насыщением артериальной крови кислородом), эритроцитозы, вызванные локальной ишемией почек (почечные эритроцитозы), и паранеопластические. При гипоксических и почечных эритроцитозах источником повышенного образования эритропоэтинов являются почки, при паранеопластических - опухоли. Гипоксические эритроцитозы являются компенсаторными, почечные и паранеопластические - дисрегуляторными, не выполняющими полезных функций. Первичные эритроцитозы - группа различных наследственных заболеваний, характеризующихся повышенной продукцией эритропоэтина или понижением чувствительности к кислороду кислородных рецепторов почек. У здоровых людей при микроскопии с помощью иммерсионной системы окрашенных препаратов эритроциты имеют округлую форму, розовую окраску с небольшим просветлением в центре (нормохромия) и по размеру примерно одинаковы. По величине эритроцитов у здорового человека нормоциты (эритроциты диаметром 7,5 мкм) составляют 68%, микроциты (диметр < 7,0 мкм) - 15% и макроциты (диаметр > 7,9 мкм) - 17%. Различают также мегалоциты (клетки диаметром >11 мкм). Птологические изменения в морфологии эритроцитов заключаются в появлении клеток различной формы (пойкилоцитоз), размера (анизоцитоз; показатель степени анизоцитоза RDW (red cel ldistributionwidth) в норме 11,5-14,5%), окраски (анизохромия) и с различными внутриклеточными включениями. Микроцитоз развивается при нарушении синтеза гемоглобина и сопровождается уменьшением концентрации гемоглобина в эритроцитах. Макроцитоз возникает в результате нарушения синтеза ДНК. Мегалоцитоз характеризуется значительным увеличением размеров эритроцитов и повышенной концентрацией гемоглобина. Циркулирующие эритроциты имеют ряд дополнительных характеристик. Средний объем эритроцита (MCV - Mean Corpuscuar Volume), который выражается в фемтолитрах, в норме равен 80-100 фл. Среднее содержание гемоглобина в эритроците (MCH - Mean Corpuscular Hemoglobin) - в норме 27-32 пиктограмм - пг. Средняя концентрация гемоглобина в эритроците (MCHC - Mean Corpuscular Hemoglobin Concentration) - в норме 300-360 г/л. Повышение последнего показателя больше 37% в клинике практически не встречается, так как это значение является верхним пределом растворимости гемоглобина в воде. Изменение количества гемоглобина в эритроцитах сопровождается изменением их окраски, что определяется по цветовому показателю, т.е. цветовой показатель характеризует среднее содержание гемоглобина в одном эритроците. У здоровых людей цветовой показатель находится в пределах 0,86-1,05, его используют для деления анемий на гипохромные (меньше нормы), нормохромные и гиперхромные (больше нормы). Полихроматофилы - эритроциты с недостаточным накоплением гемоглобина и остатками базофильной субстанции, их увеличение является показателем регенераторной активности костного мозга. В эритроцитах могут встречаться внутриклеточные включения, которые, как правило, представляют собой остатки внутриклеточных органелл, в основном ядра (тельца Жолли, кольца Кебота), или гранулы пигмента (тельца Паппенгейма). Тельца Гейнца-Эрлиха свидетельствуют о деструкции, денатурации гемоглобина. При инфекциях, гемолитических анемиях, хронических отравлениях свинцом и миелодиспластических состояниях в эритроцитах можно видеть множество мелких синих гранул (групп РНК) - это пятнистая базофилия эритроцитов, так называемая токсическая зернистость. Скорость оседания эритроцитов (СОЭ) - позволяет оценить свойство эритроцитов осаждаться на дно сосуда или капилляра, расположенного вертикально. К факторам, увеличивающим СОЭ, относятся повышение уровня фибриногена, диспротеинемия, парапротеинемия, гиперхолестеринемия, повышение уровня С-реактивного белка, алкалоз, анемия. Повышение СОЭ отмечается при заболеваниях инфекционно-воспалительного характера, патологии почек, печени, ревматических заболеваниях, сахарном диабете, тиреотоксикозе, анемиях, лимфогранулематозе, миеломной болезни, неходжкинских лимфомах с парапротеинемией и ряде других онкологических заболеваний. Замедляют СОЭ гипербилирубинемия, повышение уровня желчных кислот, ацидоз, уровень гематокрита более 50%. Снижение СОЭ наблюдают при эритроцитозе, сгущении крови. Анемия Анемия (малокровие) - состояние, характеризующееся уменьшением концентрации гемоглобина в единице объема крови ниже нормы; часто, но не всегда, одновременно уменьшается общая масса эритроцитов в единице объема крови. Анемия развивается, если при разрушении или потере эритроцитов одновременно снижается темп их воспроизводства в костном мозге. Диагностические критерии анемии у мужчин: число Эр <4,0% млн/мкл, гемоглобин <13 г/%, ГК <39%; у женщин - соответственно <3,8 млн/мкл, <12 г%, <36%. Для определения анемии также исследуют абсорбцию 59Fe 3+ в кишечнике, концентрацию сывороточного железа, трансферрина и растворимых рецепторов для трансферрина, общую железосвязывающую способность. Функции переносчика кислорода из легких в ткани, а также углекислоты от тканей к легким выполняет гемоглобин. Гемоглобин состоит из не содержащего железо гема и глобина. Нарушения обмена железа или недостаточность ферментов вызывают изменения гема и гемоглобина. 4 молекулы гема обернуты полипептидными цепями, которые все вместе представляют собой белковую часть молекулы - глобин. Глобин состоит из двух цепей типа-α и двух цепей другого типа (β, γ, δ). К нормальным типам гемоглобина относятся HbA (α-2, β-2 - основной гемоглобин взрослого человека, 97%), HbA2 (α-2, δ-2 - минорный гемоглобин взрослого человека, 2-3%), HbF (α-2, γ-2 - фетальный гемоглобин). Смена гемоглобина F на гемоглобин А происходит во время рождения ребенка. К 4-6-му месяцу жизни уровень фетального гемоглобина в крови составляет менее 1%. При патологии за счет замены аминокислот строение молекул гемоглобина может изменяться. Известно множество типов аномального гемоглобина (HbH, Hbl, HbS и др.). Существуют 2 большие классификационные группы анемий, каждая из которых включает 2 подгруппы: • анемии после кровопотери или разрушения эритроцитов (постгеморрагические и гемолитические анемии); • анемии при недостаточном воспроизводстве эритроцитов (дисэритропоэтические и гипопластические), а также апластические анемии. Главные клинические проявления анемии связаны со снижением способности крови к переносу кислорода, что приводит к гипоксии тканей. Больные становятся бледными, жалуются на утомляемость, головокружения, парестезии (спонтанно возникающие чувства онемения, покалывания в конечностях), одышку при физическом напряжении. Возникают изменения ногтей (койлонихия - ложкообразные ногти, признак дефицита железа), жировая дистрофия и липофусциноз печени, миокарда. Жировая дистрофия миокарда может привести к сердечной недостаточности и отяготить течение ИБС у пациентов с атеросклерозом (анемия усиливает гипоксию миокарда, вызванную стенозом коронарной артерии). Повышение сосудистой проницаемости, обусловленное гипоксией, приводит к отеку, склерозу стромы, диапедезным кровоизлияниям и местному гемосидерозу. Одновременно развиваются компенсаторные процессы: повышается минутный объем сердца (МОС), уменьшается время циркуляции и, соответственно, возрастает уровень перфузии тканей. Если болезнь прогрессирует, сердечная недостаточность с высоким МОС становится угрозой для жизни. Анемии при кровопотерях и разрушении эритроцитов Постгеморрагическая анемия может быть острой и хронической. Кровопотерю считают смертельной при утрате 40-50% общего объема крови (в среднем 2-3 л). Потерю крови более 20-25% считают угрожающей жизни. При острой кровопотере причинами смерти становятся острая гипоксия головного мозга и постгеморрагический шок. В первые часы после кровотечения такая анемия является нормохромной нормоцитарной, восстановление объема плазмы после острой кровопотери вызывает временное разжижение крови и снижение гематокрита. Первым признаком регенерации красных кровяных телец является ретикулоцитоз. В течение нескольких часов после кровопотери мобилизация гранулоцитов и тромбоцитов из депо приводит к умеренной нейтрофилии и тромбоцитозу. Хроническая постгеморрагическая анемия возникает при хронической кровопотере, может быть симптомом гинекологических, онкологических заболеваний, болезней ЖКТ. Характерные признаки анемии: гипохромия, микроцитоз, фокусы регенерации в костном мозге трубчатых костей (красный костный мозг трубчатых костей), наличие очагов внекостномозгового кроветворения, а также изменения, обусловленные хронической гипоксией. Гемолитические анемии - многочисленная группа анемий, основными диагностическими признаками которых являются повышенная деструкция и укорочение жизни эритроцитов. Классификация гемолитических анемий основана на 3 показателях: • причине гемолиза (эндоэритроцитарные, т.е. связанные с аномалиями самого эритроцита, или экзоэритроцитарные); • вне или внутрисосудистой локализации гемолиза; • врожденном или приобретенном характере заболевания. У большинства людей с гемолитическими заболеваниями патологически измененные эритроциты разрушаются с помощью макрофагов в селезенке, печени и костном мозге путем внесосудистого гемолиза. Внутрисосудистый гемолиз сопровождается выделением гемоглобина в кровь и встречается при тяжелом повреждении плазмолеммы нормальных эритроцитов под действием внешних причин, например антител, комплемента, токсичных химикатов или механических факторов. Вслед за фагоцитозом эритроцитов молекула гемоглобина распадается на гем и глобин. Если конверсия гемоглобина в билирубин превышает способность печени конъюгировать билирубин и выделять его с желчью, развивается желтуха. Неконъюгированный билирубин не может проходить через гломерулярную мембрану, этот билирубин не появляется в моче (ахолурическая желтуха). Конъюгированный билирубин секретируется в желчные канальцы. Увеличение концентрации билирубина в желчи предрасполагает к формированию пигментных желчных камней. Чаще это происходит при врожденных гемолитических анемиях. Высокий уровень билирубина плазмы при гемолитической болезни новорожденных может обусловить токсическое повреждение головного мозга и билирубиновую энцефалопатию (токсическое повреждение желчными пигментами и кислотами клеток базальных ядер головного мозга). При гемолитических состояниях в костном мозге может значительно, до 6 раз, увеличиться воспроизводство эритроцитов (компенсаторный эритропоэз). Количество ретикулоцитов всегда повышено. Анемия, как правило, нормоцитарная, может быть небольшой макроцитоз. В костном мозге развивается эритробластическая гиперплазия, иногда с явлениями эритрофагоцитоза (фагоцитоз макрофагами поврежденных эритроцитов - внутриклеточный гемолиз). Костномозговая ткань распространяется по каналам длинных трубчатых костей, постепенно каналы и полости (в губчатых костях) расширяются, костные трабекулы атрофируются и исчезают, а кортикальная кость истончается, кость может деформироваться. Из-за присоединяющейся недостаточности фолиевой кислоты возможны мегалобластические (макроцитарные) изменения эритроцитов. При тяжелом и хроническом вариантах анемии наблюдаются экстрамедуллярный гемопоэз и общий гемосидероз с накоплением гемосидерина в звездчатых эндотелиоцитах (клетках Купфера) печени и макрофагах селезенки, а также спленомегалия. Измененные эритроциты теряют пластичность - физиологическую способность к деформации, что может быть причиной тромбозов и, следовательно, инфарктов. Наследственные анемии, обусловленные эндоэритроцитарными факторами, для которых характерен внесосудистый гемолиз (патологический внутриклеточный гемолиз), в зависимости от характера изменений эритроцитов подразделяют на: • гемолитические анемии, связанные с нарушением структуры плазмолеммы эритроцитов (эритроцитопатии, мембранопатии - стоматоцитоз, микросфероцитоз, овалоцитоз; анемии, обусловленные нарушением структуры липидов мембраны эритроцитов и т.д.); • гемолитические анемии, обусловленные дефицитом ферментов эритроцитов (ферментопатии - недостаточная активность ферментов гликолиза, пентозофосфатного шунта, глютатионовой системы); • гемолитические анемии, связанные с нарушенным синтезом глобина (гемоглобинопатии). Причинами гемоглобинопатий могут быть носительство аномальных гемоглобинов (HbS, HbC, HbD и др.); носительство аномальных нестабильных гемоглобинов (неустойчивость глобина к воздействию окислителей или нагреванию в результате замен аминокислот); талассемии (дисбаланс и снижение синтеза полипептидных цепей). Примерами приобретенных анемий с внесосудистым внутриклеточным гемолизом являются анемия при конфликте по групповой и Rh (резус)-принадлежности крови матери и плода, пароксизмальная ночная гемоглобинурия, обусловленная соматической мутацией клеток-предшественников миелопоэза. Патологический внутриклеточный гемолиз возникает и при избыточном количестве эритроцитов (физиологическая желтуха, эритробластоз новорожденного, эритремия) - более 6-7×10 12/л. Наследственные мембранные дефекты эритроцитов проявляются в двух основных формах: сфероцитозе и овалоцитозе (эллиптоцитозе). Наследственный сфероцитоз - хроническое гемолитическое заболевание с аутосомно-доминантным типом наследования, может возникать вследствие спонтанной мутации. Дефект в молекуле спектрина - одного из белков плазмолеммы эритроцитов - приводит к неустойчивости плазмолеммы, эритроциты вследствие этого приобретают сферическую форму и теряют пластичность. Для наследственного овалоцитоза характерно появление в периферической крови эллипсовидных или вытянутых эритроцитов, по-видимому, также вследствие повреждения спектрина. Различают 2 важнейшие формы наследственных ферментных повреждений эритроцитов: недостаточность глюкозо-6-фосфатдегидрогеназы и недостаточность пируваткиназы. Жизнь нормальных эритроцитов зависит от главного источника энергии - глюкозы. После проникновения в клетку она превращается в лактат либо путем анаэробного гликолиза (90%), либо через гексозомонофосфатный шунт (10%). Недостаточность глюкозо-6-фосфатдегидрогеназы - одно из наиболее часто встречающихся наследственных заболеваний, эта аномалия, сцепленная с Х-хромосомой, проявляется у мужчин и у гомозиготных женщин. У пациентов гемоглобин свободно окисляется до метгемоглобина, который затем формирует преципитаты в виде телец Гейнца. Самое частое клиническое проявление - острый гемолитический приступ в ответ на оксидантный стресс, например, на острую инфекцию или лекарственную терапию. Ятрогенными факторами, действующими в качестве оксидантов, могут быть противомалярийные препараты, сульфаниламиды, фурадонин, аспирин и витамин К. Анемия, обусловленная недостаточностью пируваткиназы, наследуется по аутосомно-рецессивному типу, гемолиз наблюдается лишь у гомозигот. Гемоглобинопатии развиваются в результате нарушения синтеза глобиновых цепей, группы гема остаются нормальными. Встречаются 2 основных варианта гемоглобинопатий. Первый - гемоглобиновые варианты или гемоглобинопатии, при которых мутации генов приводят к продукции аномальных глобиновых цепей. Группа включает носительство аномальных гемоглобинов (HbS, HbC, HbD и др.) и носительство аномальных нестабильных гемоглобинов. Второй - синдромы талассемии, когда сложные генетические дефекты приводят к нарушению количественного соотношения между глобиновыми цепями, структура цепей гемоглобина не изменена. Гемоглобинопатии сопровождаются снижением эритропоэза и продолжительности жизни эритроцитов. Таким образом, анемия имеет частично дисэритропоэтическую и частично гемолитическую природу. Гемоглобиновые варианты у 90% больных являются следствием замены одного аминокислотного остатка в молекуле гемоглобина. Самым частым и важным вариантом таких гемоглобинопатий является серповидноклеточная анемия. При серповидноклеточной анемии образуется HbS, который отличается от HbA заменой остатка валина на остаток глутаминовой кислоты в 6-й позиции аминокислотной последовательности β-цепи. Гомозиготы (HbSS), у которых весь гемоглобин представляет собой HbS, всегда имеют признаки заболевания. Гетерозиготы (HbAS) имеют примерно 40-50% HbS, и, как правило, заболевание протекает бессимптомно до наступления тяжелого аноксического (гипоксического) состояния. Такая разновидность болезни получила название серповидноклеточной аномалии эритроцитов. Для нее характерно географическое распределение, которое связано с распространением малярии, вызываемой Plasmodium falciparum. Носители гена серповидноклеточной аномалии от малярии защищены. Серповидная форма эритроцитов - результат полимеризации деоксигенированных молекул HbS, которые в таком состоянии складываются особым линейным способом. Симптоматика появляется у гомозигот уже в 6-месячном возрасте. Развиваются хроническая гемолитическая анемия и рецидивирующие болезненные кризы, связанные с окклюзией мелких сосудов серповидными эритроцитами, ишемией тканей и инфарктами. Чаще других бывают поражены печень, селезенка, кости, легкие, головной мозг и сетчатка глаз. Наступление кризов может быть спровоцировано инфекциями, простудой, физической нагрузкой, обезвоживанием и беременностью. Несмотря на развитие спленомегалии в раннем детском возрасте, позднее повторяющиеся кризы с инфарктами селезенки приводят к атрофии этого органа и аутоспленэктомии, т.е. выключению функции селезенки. Такие люди подвержены тяжелым бактериальным инфекциям, особенно респираторным, у них могут развиться септицемия, менингит и остеомиелит. Тяжелая инфекция способна приводить и к гипоплазии костного мозга (апластический криз). Варианты с заменой внутренних аминокислот представлены тремя группами заболеваний. Самую большую группу составляют анемии с нестабильным гемоглобином. При замене аминокислотных остатков повреждается место прикрепления гема. Нестабильный гемоглобин легко денатурируется, в эритроцитах появляются тельца Гейнца. Вторая группа, HbM-варианты, представлена врожденной метгемоглобинемией. Она характеризуется цианозом тканей вследствие неспособности метгемоглобина связываться с кислородом. Третья группа - гемоглобины с измененными свойствами. В большинстве случаев эти гемоглобины слишком прочно связывают кислород, что приводит к последующей гипоксии тканей и эритроцитозу. Талассемии - гетерогенная группа наследственно обусловленных заболеваний, в основе которых лежит нарушение синтеза одной из полипептидных цепей глобина, что приводит к увеличению синтеза других цепей и развитию дисбаланса между ними. Цепи, синтезируемые в избыточном количестве, накапливаются и откладываются в эритрокариоцитах костного мозга и эритроцитах периферической крови, вызывая повреждение клеточной мембраны и ускоренную гибель клеток. Дисбаланс синтеза глобиновых цепей вызывает развитие неэффективного эритропоэза, гемолиз эритроцитов и развитие гипохромной анемии различной степени тяжести. В типичном варианте это анемии нормохромные, гиперрегенераторные или регенераторные. Талассемии относят к количественным гемоглобинопатиям, так как структура цепей гемоглобина не изменена. Различают α-талассемию и β-талассемию. Подтверждают диагноз результаты измерения соотношения α- и ß-цепей (в норме оно равно 1:1). Гомозиготная β-талассемия (большая талассемия) - очень тяжелое заболевание. Гетерозиготная β-талассемия (малая талассемия) имеет меньшее клиническое значение. Пароксизмальная ночная гемоглобинурия характеризуется появлением соматической мутации плюрипотентной стволовой клетки. У потомков аномальной стволовой клетки (эритроцитов, лейкоцитов и тромбоцитов) определяется дефицит одного из семейств протеинов, связанных с клеточной мембраной. Небольшое снижение рН плазмы во время ночного сна сопровождается активацией гемолиза и вызывает ночную гемоглобинурию. В почках накапливаются гранулы гемосидерина, которые можно обнаружить в моче. Поскольку с мочой выводится много железа, у таких больных часто отмечается недостаточность железа. Диагностика основана на повышенной чувствительности эритроцитов к лизису, опосредованному комплементом. Анемии, обусловленные экзоэритроцитарными факторами (характерен внутрисосудистый гемолиз) являются приобретенными, процесс эритропоэза не нарушается. Гемолиз эритроцитов может иметь аутоили изоиммунную природу, его вызывают механическое повреждение эритроцитов, лекарства, инфекционные агенты и иммунные реакции при инфекционных заболеваниях, гемолитические токсины, повышенная активность селезенки. Иммунная гемолитическая анемия изоиммунного или аутоиммунного генеза проявляются некомпенсированным гемолизом, который развивается вследствие иммунных реакций, направленных против измененных или неизмененных антигенов эритроцитов. Аутоиммунные гемолитические анемии встречаются преимущественно после 40 лет и у детей до 10 лет, при этом клетки иммунной системы синтезируют антитела к собственным неизмененным антигенам эритроцитов. Наиболее распространенной формой является аутоиммунная гемолитическая анемия, обусловленная неполными тепловыми агглютининами. Заболевание может быть как идиопатическим, так и симптоматическим. Также встречаются анемия, ассоциированная с холодовым агглютинином, и анемия, ассоциированная с холодовым гемолизином (пароксизмальная холодовая гемоглобинурия). Симптоматические, или вторичные, аутоиммунные гемолитические анемии развиваются на фоне лимфопролиферативных заболеваний и других злокачественных опухолей, болезней соединительной ткани, инфекций, аутоиммунных заболеваний. Изоиммунные гемолитические анемии наиболее часто представлены гемолитической болезнью новорожденных (фетальный эритробластоз) и трансфузионной гемолитической реакцией. Механическое повреждение эритроцитов с развитием анемии характерно для маршевой гемоглобинурии - острого пароксизмального заболевания, развивающегося после долгих пеших переходов или продолжительного бега по твердой поверхности. Травматическая фрагментация эритроцитов может возникнуть при прохождении через искусственные сердечные клапаны или поврежденные сосуды. Фрагментацией эритроцитов и тромбоцитопенией характеризуется также микроангиопатическая гемолитическая анемия, которая наблюдается при тяжелом токсикозе у беременных, злокачественной гипертензии, тромботической тромбоцитопенической пурпуре и т.д. Лекарственный иммунный гемолиз реализуется через продукцию антител к лекарствам или эритроцитам, его вызывают различные препараты (пенициллин, хинидин, фенацетин, дигоксин, метилдофа, сульфаниламиды и т.д.). Гемолитические нарушения при инвазии паразитов в эритроциты встречаются при малярии и бартонеллезе (лихорадке Ороя, перуанской бородавке, т.е. болезни, вызываемой Bartonella bacilliformis, эндемичной для Перу и других стран Южной Америки). У больных малярией гемолиз может быть внутри- и внесосудистым. Анемии, вызванные гемолитическими токсинами и веществами, могут развиваться при инфицировании некоторыми патогенными бактериями (Clostridium welchii и Streptococcus pyogenes), выделяющими токсины, например фосфолипазы, которые вызывают тяжелый внутрисосудистый гемолиз. Из гемолитических химикатов следует назвать фенилгидразин, соединения свинца, мышьяка и меди, сапонины (природные пенообразующие гликозиды) и хлорат калия. При хронической свинцовой интоксикации отмечают микроцитоз, пятнистую базофилию и гипохромию. Анемия при гиперспленическом синдроме связана с повышенным разрушением эритроцитов, депонирующихся в селезенке. Дисэритропоэтические анемии Количество клеток в костном мозге при дисэритропоэтических анемиях нормальное или повышенное, но продукция эритроцитов снижена, что вызвано нарушенным или недостаточным эритропоэзом; чаще это приобретенные анемии. Типичные примеры анемий этой группы - мегалобластные анемии, обусловленные дефицитом витамина B12 и фолиевой кислоты, который может быть вызван недостаточностью веществ в пище, нарушением всасывания, транспорта, абсорбции, повышением потребности. Витамин B12 и фолиевая кислота действуют как коферменты, они необходимы для нормального функционирования и деления клеток. Снижение синтеза ДНК приводит к мегалобластному гемопоэзу, атрофии активно регенерирующей в нормальных условиях слизистой оболочки ЖКТ (атрофический глоссит, изъязвления слизистой оболочки полости рта, хронический атрофический гастрит, атрофия ворсин тонкой кишки) (рис. 9.1). Нарушение созревания зародышевых клеток у пациентов обоих полов, приводит к бесплодию. Наблюдается неврологическая симптоматика, поскольку этот витамин необходим также для образования миелиновой оболочки нервов. Наиболее характерно подострое комбинированное поражение в виде перемежающейся демиелинизации длинных пирамидных путей и задних рогов среднегрудного отдела спинного мозга. Очаговая демиелинизация встречается и в крупных периферических нервах, и в полушариях головного мозга. 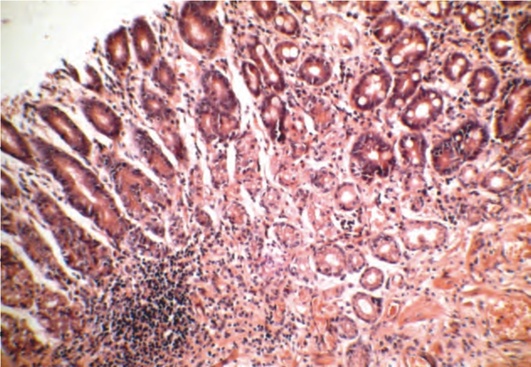 Рис. 9.1. Мегалобластная В12-дефицитная анемия. Хронический атрофический гастрит. Окраска гематоксилином и эозином Картина крови при недостаточности и витамина В12, и фолиевой кислоты характеризуется панцитопенией. У эритроцитов повышается средний объем клетки, наблюдаются анизоцитоз, макроцитоз, пойкилоцитоз. В наиболее развитых стадиях в эритроцитах появляются ядра и тельца Хауэлла-Джоули. Количество ретикулоцитов уменьшается. Отмечаются нейтропения и появление крупных нейтрофилов (макрополицитов) с гиперсегментированными ядрами, содержащими по 6 долей и более. Тромбоцитов тоже становится меньше, причем в ряде случаев тяжелая тромбоцитопения завершается пурпурой (геморрагическим синдромом). Костный мозг трубчатых костей становится красным, приобретает вид малинового желе. Все элементы гемопоэза в какой-то степени повреждены, наблюдаются эритроидная гиперплазия, мегалобластные изменения, сохранение ядер в дифференцирующихся клетках, полиплоидия и фрагментация ядер. Синтез гемоглобина в развивающихся эритробластах нарушается меньше. Появляются гигантские метамиелоциты, эритрофагия (фагоцитоз и разрушение аномальных эритробластов макрофагами) и гемосидероз. Часто отмечается небольшое увеличение селезенки, связанное с интенсивным разрушением эритроцитов или экстрамедуллярным мегалобластным гемопоэзом. Один из вариантов мегалобластных анемий - пернициозная анемия (pernicious - характеризующаяся тяжелым злокачественным течением), которая развивается при хроническом атрофическом аутоиммунном гастрите (гастрите типа А), а также после гастрэктомии. Решающую роль в развитии болезни играет недостаточность внутреннего фактора (гастромукопротеина), вырабатываемого наряду с хлористоводородной (соляной) кислотой париетальными клетками в фундальном отделе желудка. К снижению синтеза внутреннего фактора приводит аутоиммунная реакция против него или париетальных клеток, сопровождающаяся атрофией слизистой оболочки желудка. Наличие аутоиммунного процесса доказывает ряд фактов. Во-первых, в сыворотке крови и в желудочном соке больных обнаружены 3 типа антител. У 90% больных - париетальные каналикулярные антитела, реагирующие с микроворсинками каналикулярной системы париетальных клеток. У 60% пациентов - блокирующие антитела (блокируют образование комплекса B12 и внутреннего фактора, вследствие чего витамин разлагается в желудке). У 50% больных - связывающие антитела, реагирующие с комплексом B12внутренний фактор и препятствующие его присоединению к эпителию подвздошной кишки. Во-вторых, лица, страдающие пернициозной анемией, а также их родственники часто заболевают аутоиммунным тиреоидитом, болезнью Аддисона и сахарным диабетом 1-го типа. В-третьих, частота определения в сыворотке антител к внутреннему фактору у пациентов возрастает при наличии других аутоиммунных заболеваний. Неадекватное поступление фолиевой кислоты с пищей встречается при хроническом алкоголизме, у пожилых лиц и недоношенных младенцев. Нарушением всасывания фолиевой кислоты сопровождаются глютеновая энтеропатия, гастрэктомия, тяжелая форма болезни Крона, диффузная лимфома тонкой кишки и некоторые виды лекарственной терапии. Дефицит может вызвать наследственное нарушение транспорта фолата в слизистой оболочке кишки. Повышенная потребность в фолиевой кислоте развивается при беременности, болезнях с повышенной гемопоэтической активностью (например, хронических гемолитических состояниях) и запущенных злокачественных опухолях, когда для интенсивного синтеза ДНК требуются дополнительные количества фолиевой кислоты. Многочисленные лекарственные средства (метотрексат, триметоприм, триамтерен, сульфасалазин) действуют как антагонисты фолиевой кислоты. Железодефицитная анемия - один из наиболее часто встречающихся вариантов анемий. Около 70% из тех 3-4 г железа, которые имеются в организме, содержится в геме гемоглобина; 5% железа - в миоглобине. Небольшое его количество включено в клеточные цитохромы, каталазу, пероксидазу, ксантиноксидазу и рибонуклеотидредуктазу. Остальное железо (0,3-1,4 г) сохраняется в макрофагах селезенки, костного мозга и печени, а также в клетках разных органов, в частности в гепатоцитах. Уровень железа в плазме крови в норме колеблется от 13 до 32 мкмоль/л; 95% этого количества находится в форме трансферрина. Уровень плазменного железа оценивают на основании содержания ферритина в сыворотке крови. Отрицательный баланс железа появляется в результате избыточной потери и (или) недостаточного уровня поступления или усвоения. Основная причина железодефицитной анемии - хроническая кровопотеря. Если больной ежедневно лишается 10-15 мл крови, содержащих 5-7 мг железа, это эквивалентно максимальному суточному количеству железа, абсорбируемого при нормальном питании. Тяжелые менструальные кровотечения, скрытые кровоизлияния (особенно из пептических язв или изъязвленных опухолей), геморрой, глистная инвазия часто сопровождаются железодефицитной анемией. Дефицит железа также может быть обусловлен недостаточным его поступлением с пищей и мальабсорбцией (нарушением всасывания в тонкой кишке) при глютеновой энтеропатии, ахлоргидрии, а также после гастрэктомии. В пунктате костного мозга определяется отрицательная реакция на берлинскую лазурь. Выявляется эритроидная гиперплазия, эритроциты становятся гипохромными и микроцитарными. Появляются гипохромия, микроцитоз, пойкилоцитоз, и при тяжелом дефиците встречаются кольцевидно окрашенные эритроциты, овалоциты и палочковидные красные кровяные тельца. Внекостномозговое кроветворение нехарактерно (из-за дефицита железа). При латентной железодефицитной анемии картина крови может быть нормальной, но сывороточный уровень железа оказывается ниже нормы. Изменения в других органах и тканях обусловлены истощением железосодержащих ферментов и хронической гипоксией; нарушается регенерация. Ногти становятся бороздчатыми, полосатыми и ломкими, приобретая со временем ложкообразную (вогнутую) форму - койлонихия. Могут возникать атрофический гастрит, атрофический глоссит, трещины в углах рта (ангулярный стоматит) и дисфагия (нарушение глотания) из-за складчатой деформации слизистой оболочки в шейных отделах пищевода. Ахлоргидрия при гастрите усиливает дефицит железа. Анемии вследствие нарушения метаболизма железа проявляются патологией его реутилизации или утилизации. Тяжелые хронические инфекции, ревматоидный артрит, СКВ, диссеминированные злокачественные опухоли и прочие заболевания сопровождаются нарушением реутилизации железа и микроцитарной анемией. Причина анемии - блокада освобождения железа из макрофагов, в результате чего железо не может быть утилизировано в костном мозге, созревание эритробластов задерживается. Количество сывороточного ферритина в норме или повышено. В костном мозге отмечаются уменьшение эритропоэтической активности и небольшое укорочение продолжительности жизни эритроцитов. При хроническом воспалении подавление эритропоэза и нарушение депонирования и перемещения железа из мест хранения могут быть связаны с действием медиаторов воспаления, таких как ИЛ-1, ФНО и т. д. Атрансферринемия - очень редкая анемия, связанная с нарушением транспорта железа; возникает при дефектах переноса железа из-за отсутствия трансферрина или его конформационных изменениях. Сидеробластные анемии развиваются при нарушенной утилизации железа. Анемии этой группы характеризуются дефектами синтеза порфирина, которые приводят к недостаточной утилизации железа для синтеза гема, несмотря на нормальное или даже повышенное содержание железа в митохондриях эритробластов. Сидеробластные анемии относятся к группе микроцитарных гипохромных. Важный признак дефектного синтеза гема - присутствие в периферической крови полихроматофильных зернистых мишеневидных эритроцитов. Реакция на берлинскую лазурь выявляет наличие гранул железа, расположенных в митохондриях вокруг ядер эритробластов в виде колец (кольцевидные сидеробласты). Характерны высокое содержание железа и ферритина в сыворотке крови, повышенное насыщение трансферрина железом. К сидеробластным относятся и рефрактерные анемии - проявление миелодиспластического синдрома. Апластическая анемия - заболевание, характеризующееся резким угнетением костномозгового кроветворения, торможением процессов пролиферации и дифференцировки клеточных элементов с развитием глубокой панцитопении в периферической крови. Врожденные варианты - апластическая анемия Фанкони (часто сочетается с костными пороками или врожденными пороками сердца), семейная гипопластическая анемия Эстрена-Дамешека и врожденная парциальная гипопластическая анемия Джозефса-Даймонда-Блекфена. Приобретенная апластическая анемия может быть обусловлена либо первичным дефектом стволовой клетки, либо иммунными механизмами. Примерно 50% вторичных апластических анемий являются идиопатическими (причина неизвестна). Аплазия костного мозга нередко является следствием облучения (например, при ядерных катастрофах), лечения злокачественных опухолей массивными дозами цитотоксических миелотоксических препаратов, использованием ряда лекарств (левомицетина или хлорамфеникола, сульфонамидов и т.д.). Другие вероятные причины - идиосинкразия (повышенная чувствительность) к лекарственным препаратам, вирусные инфекции. В патогенезе аплазии костного мозга определенную роль могут играть аутореактивные Т-лимфоциты, в некоторых случаях анемия поддавалась терапии, направленной на подавление Т-клеток. Возможно, вирусные инфекции, цитотоксические препараты или генетические нарушения приводят к появлению в стволовых клетках новых антигенов, против которых направлены Т-лимфоциты. Основное проявление апластической анемии - недостаточность пролиферации и дифференцировки стволовых клеток гемопоэза. У больных развивается тяжелый гипоскемический комплекс симптомов, вторичный иммунодефицит с развитием инфекционных осложнений, а также склонность к кровотечениям. Костный мозг при трепанобиопсии представлен жировой тканью с островками миелоидной (гемопоэтической) ткани. Эритроциты нормоцитарные, макроцитарные, нормохромные, ретикулоциты отсутствуют. Спленомегалия не характерна. При дифференциальной диагностике следует исключать предлейкозные состояния и миелодиспластический синдром. Парциальная эритроцитарная аплазия возникает, как правило, у взрослых, часто в связи с доброкачественной тимомой. По клинической картине апластическую анемию может напоминать миелофтизная анемия, которая возникает при замещении нормальных элементов костного мозга метастазами опухолей, миелофиброзе, гранулематозных заболеваниях. |
