Лекции. Лекция Введение. Общепланетарное значение и функции почв
 Скачать 2.04 Mb. Скачать 2.04 Mb.
|
|
О 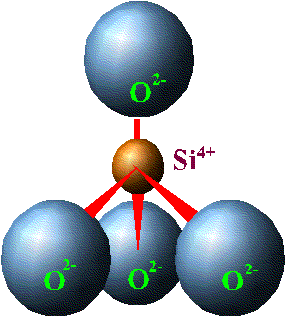 тношение радиуса катиона к радиусу аниона определяет не только его координационное число, а также форму кристаллической решетки и характер элементарной ячейки.  Элементарной ячейкой кремнекислородного соединения является тетраэдр, четыре вершины которого заняты крупными анионами О2+ (r = 1,32 А0), а в центре находится катион с небольшим радиусом Si4+ (r = 0,39 А0). Данный тетраэдр является основной структурной ячейкой всех существующих соединений кремния с кислородом. Ячейка SiO4 заряжена отрицательно (на 4 положительных заряда Si приходится 8 отрицательных зарядов кислорода). Отрицательный заряд ячейки может быть компенсирован путем присоединения катионов или соединением с другими кремнекислородными тетраэдрами. Элементарной ячейкой кремнекислородного соединения является тетраэдр, четыре вершины которого заняты крупными анионами О2+ (r = 1,32 А0), а в центре находится катион с небольшим радиусом Si4+ (r = 0,39 А0). Данный тетраэдр является основной структурной ячейкой всех существующих соединений кремния с кислородом. Ячейка SiO4 заряжена отрицательно (на 4 положительных заряда Si приходится 8 отрицательных зарядов кислорода). Отрицательный заряд ячейки может быть компенсирован путем присоединения катионов или соединением с другими кремнекислородными тетраэдрами. 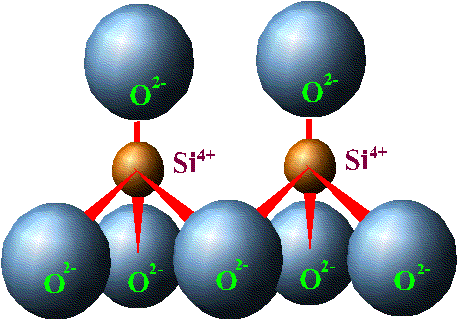 Соединение тетраэдров между собой происходит через вершины, при этом определенные ионы кислорода одновременно связаны с двумя ионами кремния. Оставшиеся свободные валентности кислородных анионов нейтрализуются катионами. Кремнекислородные тетраэдры могут образовывать непрерывные структуры в виде одинарных цепочек, что характерно для пироксенов - энтатита (Mg2Si2O6), гиперстона ((Mg1Fe)2Si2O6). Двойные цепочки образует группа амфиболов - антофиллит (Mg1Fe)7Si4O11(ОН)2. Листы, как у слюды, образуются в том случае, когда тетраэдры соединяются друг с другом тремя вершинами и образуют сетку гексагональной (шестиугольной) формы в виде плоского слоя. При этом по каждой стороне имеются ионы кислорода со свободной валентностью, направленной в одну сторону. Каждый слой соединяется с последующим, что придает слюдам пластичность. В случае, когда кремнекислородные тетраэдры соединяются между собой таким образом, что каждый из четырех кислородных ионов принадлежит двум тетраэдрам, получается структура, не имеющая свободных ионов кислорода. Подобную структуру имеет кварц (SiO2)n , который отличается большой прочностью. Такая же форма трехмерных каркасов характерна и для полевых шпатов, однако в некоторых из тетраэдров Si заменен Al3+. В результате такого замещения образуется алюмокислородный комплекс (AlO4)5ˉ. Он несет на единицу больший отрицательный заряд, чем SiO4, который компенсируется тем или иным катионом. Этим можно объяснить химический состав алюмосиликатов, к которым принадлежат полевые шпаты: альбит Na[Al,Si3O8], анортит Ca[Al2Si2O8] и др. В альбите из четырех ионов Si один замещен на Al3+, возникший отрицательный заряд компенсирован Na. В анортите из четырех ионов Si4+ два иона замещены на Al3+, два отрицательных заряда компенсируются Ca2+. Минералы, в которых ион Si4+ замещается ионом Fe3+ , называются феррисиликатами. Изоморфные замещения происходят в кристаллической решетке в период ее образования, качество и количество замещающих ионов зависит от состава и концентрации окружающего раствора. Вторичные минералы. Как отмечалось раньше, в результате химического выветривания первичные минералы изменяют свой состав и внутреннюю структуру. Выветривание в первую очередь затрагивает поверхность минералов, поэтому с их измельчением возрастает суммарная поверхность, и процессы разрушения ускоряются. Важнейшим фактором химического выветривания является вода, а также присутствующие в почве кислород и углекислота. Основными типами реакций, происходящими в почве являются: гидратация, гидролиз, растворение, окисление-восстановление. Гидратация - это притяжение молекул воды к поверхности минералов. Вследствие полярности молекул воды она представляет собой диполь. При измельчении минералов часть зарядов ионов кристаллической решетки высвобождаются, к ним притягиваются молекулы воды тем конусом, который имеет противоположный заряд. Диполи воды стремятся “выдернуть” ионы из кристаллической решетки минерала, вследствие чего происходит ее расшатывание и разрыхление. Реакции гидролиза приводят к замене катионов кристаллической решетки на Н+ - ионы воды. Схематически данная химическая реакция для полевого шпата описывается следующим образом: Присутствие в минералах Fe2+ также способствует выветриванию, так как окисление Fe2+ до Fe3+ приводит к изменению объемов, занимаемых ионами в кристаллической решетке, что вызывает в конечном итоге ее разрушение. Наибольшей устойчивостью обладает кварц, на состояние которого большинство описанных реакций заметного влияния не оказывают, однако и он в некоторой степени подвергается гидратации. При полном разрушении силикатов образуются простые продукты выветривания: гидрата окислов Fe, Al, одно- и двухвалентных оснований, гидрат окиси кремния (кремниевая кислота) и некоторые другие кислоты - угольная, серная, соляная, фосфорная и другие, образующиеся при окислении элементов, содержащихся в горных породах. Высвободившаяся при выветривании кремниевая кислота при слабокислой реакции частично переходит в состояние геля (SiO2nH2O), при слабощелочной - золя. В дальнейшем аморфный кремнегель может терять воду и закристаллизоваться, образуя вторичный кварц. Кроме этого, часть кремниевой кислоты может образовывать с основаниями растворимые в воде соли, которые впоследствии могут быть вымыты. В коллоидном и растворенном состоянии кремниевая кислота может вступать в реакцию с полуторными окислами, образуя при этом сложные соединения. Аморфные соединения, содержащие SiO2 и R2O3 в разных соотношениях называются аллофонами. Теряя воду, гидраты полуторных окислов могут постепенно кристаллизоваться, образуя вторичные минералы: лимонит - 2Fe2O3 · 3H2O, гетит - Fe2O3 · H2O, гематит - Fe2O3, гиббсит - Al2O3 · 3H2O, бемит - Al2O3 · H2O. Освобождающиеся при выветривании основания, реагируя с кислотами, образуют простые соли, являющиеся вторичными минералами: карбонаты, сульфаты, нитраты, хлориды, фосфаты, силикаты. В разной степени растворяясь в воде, они могут накапливаться в условиях засушливого климата. Помимо простых вторичных минералов, при выветривании могут образовываться вторичные алюмосиликаты и феррисиликаты. Эти минералы входят в состав различных глин и поэтому носят название глинных. Являясь частью почв, они определяют очень важные для развития растений почвенные свойства (поглотительная и обменная способность, кислотность, буферность, водоудерживающая способность и др.). Из большого числа глинных минералов, для почв наибольшее значение имеют группы: каолинита, мантмориллонита и гидрослюд. Минералы группы каолинитаимеют двухслойную кристаллическую решетку, которая состоит из двух слоев: слоя кремнекислородных тетраэдров и слоя алюмо-кислородно-гидроксильных октаэдров. 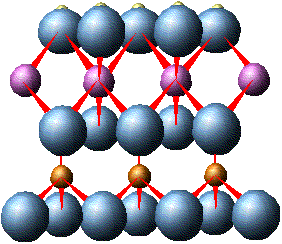 В кремнекислородном слое вершины тетраэдров повернуты в одну сторону и являются “кислородными мостиками”, связывающими тетраэдрический и октаэдрический слои: О2¯ одновременно связан с атомами Si4+ и Al3+. В целом, элементарная ячейка каолинита электронейтральна и соответствует формуле Al4Si4O10(OH)8 или Al2Si2O5(OH)4. При разламывании пакетов боковые поверхности кристаллов имеют ненасыщенные валентности, что может вызывать адсорбцию ионов из окружающего раствора. Расстояние между пакетами каолинита равна 7,2 А0 и не изменяется. Он не впитывает воду в межпакетные пространства и поэтому не набухает. К этой группе минералов относятся, кроме каолита, галлузит (структурная формула Al2Si2O5(OH4) · 2Н2О), метагаллузит (Al2Si2O5(OH)4 · 4Н2О), диккит и накрит. 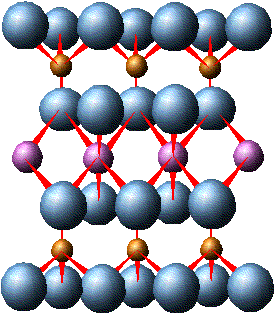 Монтмориллонит состоит из трехслойных пакетов: октаэдрический слой заключен между двумя тетраэдрическими. Межпакетные расстояния монтмориллонита изменяются от 9,4 до 21,4 А0 и варьируют в зависимости от количества поглощенной воды. Способность монтмориллонита к набуханию значительна. Структура монтмориллонита отвечает химической формуле Al4Si8O20(OH)4 · nН2О. В этой формуле nН2О - вода, разделяющая пакеты. Кристаллическая решетка электрически нейтральна и содержит по 44 положительных и отрицательных заряда. Минералам группы монтмориллонита характерны разнообразные изоморфные замещения: Si в тетраэдрических слоях может быть частично замещен на Al3+, а аллюминий в октаэдрическом слое замещается Fe2+ и Fe3+, Mg2+ и другими металлами. Например, у минерала бейделлита в отличие от монтмориллонита один из четырех ионов Si4+ тетраэдрического слоя замещен Al3+, появившийся избыточный отрицательный заряд компенсируется ионом гидроксила (Al3Si3O9(OH)3 · nH2O. К этой же группе принадлежит минерал нонтронит с формулой Fe2Si4O10(OH)3 · nH2O, где в октаэдрах ион Al3+ замещен на Fe3+. Из глинных минералов в почвах большое место принадлежит группе гидрослюд, в которую входят гидромусковит (иллит), гидробиотит и другие гидротизированные слюды. Кристаллическая решетка иллита построена так же, как и у монтмориллонита. Разница состоит в том, что в тетраэдрах часть Si4+ (до 1/4) защищена Al3+. При этом образовавшийся отрицательный электрический заряд компенсируется ионом К+, который прочно связывает пакеты между собой. Поэтому межпакетная вода в иллите отсутствует. Гидробиотит образуется из биотита - слюды темного цвета, в которой все октаэдрические места заняты Mg2+ и Fe2+. Кроме распространенных индивидуальных глинистых минералов, в природе существуют так называемые смешанно-слоистые минералы, пластинки которых состоят из чередующихся пакетов различных минералов, например, иллита, монтмориллонита и т.д. Существует так же еще группа вторичных минералов: аллофоны. Они состоят из тетраэдров и октаэдров, но расположены беспорядочно, поэтому вследствие отсутствия кристаллического строения они обладают аморфными свойствами. Глинистые минералы в природе образуются двумя путями. Первый путь представляет собой постепенное изменение первичных минералов, что приводит к образованию новых форм кристаллических решеток. Вторичные минералы могут возникать также путем синтеза из простых продуктов распада первичных минералов: полевых шпатов, амфиболов, вулканических стекол и т.д. Образующиеся при распаде вещества вступают между собой в реакции взаимодействия, продукты которых выпадают в осадок. Известно, что химическое выветривание выражается следующими стадиями: 1) гидратации силиката; 2) окисление закиси железа; 3) постепенного гидролиза - уменьшения содержания щелочей и замене Н+; 4) переход Al из четверной комбинации в шестерную; 5) частичный вынос кремнезема. Образование слюдоподобных минералов из полевых шпатов происходит вследствие выноса части SiO2, K2O, CaO. Гидратация способствует замещению некоторого количества ионов К+ ионами Н+, что приводит к образованию слюд. Этот процесс можно проиллюстрировать на примере превращения монтмориллонита в гиббсит.  При отслоении одного тетраэдрического слоя у монтмориллонита приводит к образованию каолинита, при этом ионы кислорода “кислородных мостиков” замещаются гидроксилами. В дальнейшем при присоединении воды каолинитом из него образуется гиббcит и SiO2. Скорость разрушения первичных и механизм образования вторичных минералов зависят от ряда факторов: 1) особенности первичного минерала (кристаллическая структура, степень дисперсности, химический состав и т.д.), 2) сочетание первичных минералов, 3) температуры, 4) влажности, 5) реакции среды, 6) условий выноса продуктов выветривания, 7) жизнедеятельности организмов. Основные породы разрушаются быстрее кислых и поэтому продукты их выветривания в большей мере обогащены каолинитом. Поэтому более древние почвы, подвергавшиеся процессам выветривания и почвообразования, содержат относительно много минералов группы каолинита, гибсита и гетита, которые являются конечными продуктами выветривания. Сухой и холодный климат замедляет разрушение минералов, а теплый и влажный - ускоряет. В условиях промывного режима происходит вымывание щелочей, щелочноземельных оснований, кремнезема, и, как следствие, из гидрослюд и монтмориллонита образовывается каолинит и галлузит. Растения, которые в процессе жизни взаимодействуют с почвой (поглощение воды, элементов питания, кислорода, а так же выделение продуктов жизнедеятельности), вносят существенные изменения в состав и свойства почвенного раствора, реакцию среды, значение окислительно-восстановительного потенциала, что в значительной мере оказывает влияние на условия разрушения и синтеза минералов. Как отмечалось выше, число первичных минералов в природе невелико, поэтому и количество вторичных минералов не отличается большим разнообразием. Наиболее часто встречающимися минералами являются группы гидрослюд (гидробиотит) и монтмориллонита (монтмориллонит, белделлит, нотронит), далее следуют каолинит, галлузит, вермикулит, гиббсит. Основная масса рыхлых пород состоит из относительно небольшого числа минералов. Из группы первичных минералов в их состав входят кварц, полевые шпаты, слюды и роговые обманки, из вторичных - слоистые алюмосиликаты, окиси и гидроокиси железа и алюминия. Так как в различных гранулометрических фракциях преобладают различные минералы, поэтому рыхлые породы, подвергаясь сортировке по фракциям, сортируются также по минералогическому составу. Например, в песках содержатся в основном, первичные минералы (кварц, полевые шпаты), в глинах - вторичные, в суглинках - смесь первичных и вторичных. Минералогический состав илистой фракций (< 0,001мм) резко отличается от состава более крупных фракций. Из первичных минералов в этой фракции встречается главным образом кварц, который из-за химической устойчивости может сохраниться в виде очень мелких частиц, другие минералы этой группы присутствуют в очень малых количествах. В данной фракции сосредотачивается основная масса вторичных алюмосиликатов - монтмориллонит, каолинит, иллитовые минералы, вермикулит. Сохранность полевых шпатов обуславливается главным образом их механической прочностью, которая позволяет им сохраняться в виде относительно крупных частиц. Этим объясняется небольшое содержание полевых шпатов в составе мелких фракций. Химические элементы, входящие в состав литосферы, содержатся в ней в неодинаковых количествах. При этом состав литосферы значительно отличается от состава почвы (табл.2.4.1) Таблица 2.4.1. Среднее содержание химических элементов в литосфере и почвах, в весовых % (по Виноградову, 1950)
|
