Профессиональные болезни. Липосомы. Преимущества и перспективы применения липосомальных форм лекарственных средств
 Скачать 1.33 Mb. Скачать 1.33 Mb.
|
РЕФЕРАТ на тему «Липосомы. Преимущества и перспективы применения липосомальных форм лекарственных средств.» Выполнил: студент 3 курса очного обучения специальность лечебное дело группа ЛД-О-17/7 Майгула Максим Владиславович Дата сдачи: 06.04.2020 г. г. Ульяновск, 2020 г. СОДЕРЖАНИЕ
ВВЕДЕНИЕ Сегодня по номенклатуре Международного союза теоретической и прикладной химии (IUPAC) наночастицы – это объекты, размеры которых по крайней мере по одному измерению не превышают 100 нм. Липосомы - это наночастицы шаровидной формы, ограниченные билипидной мембраной, в полости которой находится водная среда. Активное вещество может располагаться в ядре липосомы (водорастворимые вещества) либо в ее липидной оболочке (жирорастворимые вещества). Диаметр липосом может калебаться от 25 до 10000 нм. Большинство липосом имеют диаметр менее 400 нм. Вначале липосомы использовали только как модели биологических мембран. В дальнейшем было установлено, что их можно применять как микроконтейнеры, которые способны доставлять разнообразные лекарственные препараты в различные органы и ткани. В липосомы могут быть заключены ферменты, гормоны, витамины, антибиотики, цитостатики, циклические нуклеотиды и т.д. ОСНОВНАЯ ЧАСТЬ. Свойства липосом. На сегодняшний день фармакология и медицина – это наиболее активно развивающиеся направления практического использования липосом. Значительный интерес на фармацевтическом рынке представляют исследования по разработке и созданию ЛЛФ различных препаратов, которые находят применение главным образом в диагностике, химиотерапии и ФДТ опухолевых заболеваний, в иммунологии, офтальмологии, дерматологии, неврологии и других областях медицины. 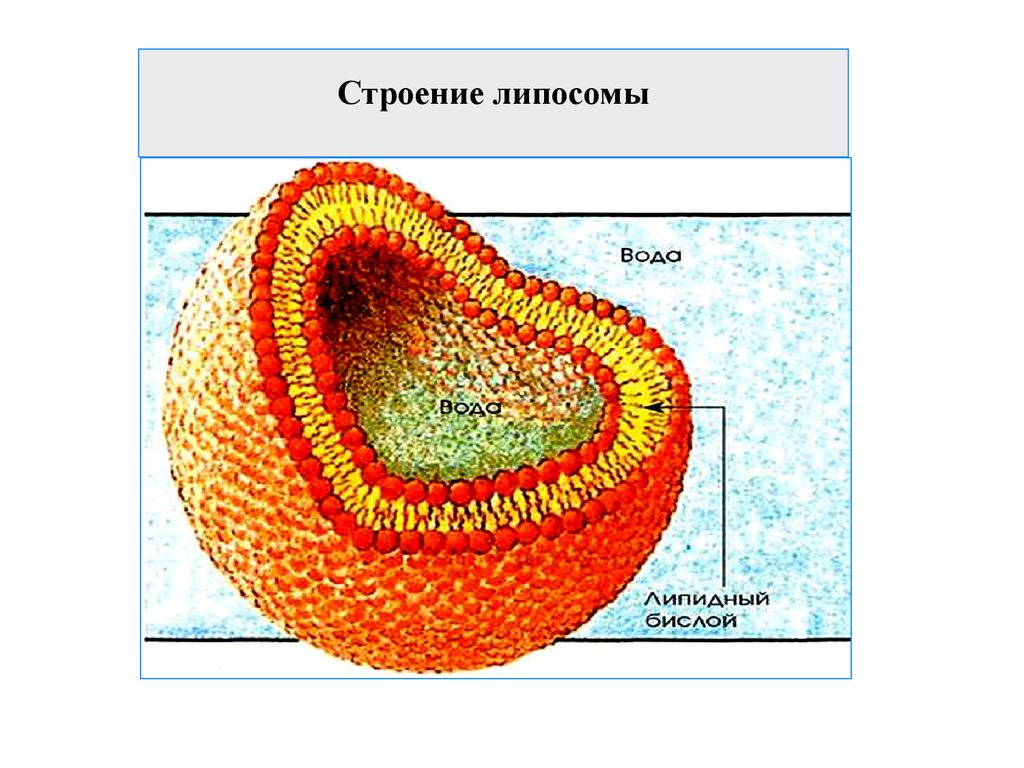 Рис. 1. Строение липосом. Широкие возможности применения липосом обусловлены уникальным комплексом их физико-химических и биологических свойств. С точки зрения биологической совместимости с системами организма, главным образом клеточными мембранами, липосомы на протяжении уже довольно долгого периода считаются наиболее реальными нанотранспортерами ЛВ. Липосомы получают из природных липидов, поэтому они не токсичны, не вызывают иммунных реакций и кумулятивной токсичности, биодеградируемы. Для практического применения липосом исключительно важна их способность включать в себя и удерживать самые разные вещества практически без ограничений в отношении их химической природы, свойств и размера молекул. Данное свойство липосом дает поистине уникальные возможности для решения некоторых медицинских проблем. Так, многие лекарственные препараты (ЛП) имеют низкий терапевтический индекс. В других случаях ЛП при введении в организм могут быстро терять активность под действием инактивирующих агентов. Инкапсулирование таких препаратов в липосомы может значительно повысить их терапевтическую эффективность. С одной стороны, препарат защищен липосомальной мембраной от действия неблагоприятных факторов, от деградации и преждевременного клиренса, при этом пролонгируется действие введенного в организм ЛВ. С другой стороны, та же мембрана не позволяет токсичному препарату превысить допустимую концентрацию в биологических жидкостях организма. Таким образом, липосомы защищают окружающие ткани организма от цитотоксического действия ЛВ, в том числе предупреждают местнотканевые реакции при введении. Кроме того, липосомы позволяют инкапсулировать как гидрофильные, так и гидрофобные ЛВ, увеличивая тем самым их биодоступность. Включение в липосомы гидрофобных ЛВ позволяет вводить их в организм внутривенно без использования солюбилизаторов (этанол, кремафор и др.), которые часто вызывают побочные эффекты. Липосомы наряду с низким поступлением ЛВ в чувствительные здоровые ткани повышают его накопление в опухоли посредством как пассивного, так и активного нацеливания, и обеспечивают проникновение препарата в опухолевую клетку. Это приводит к более высокой концентрации ЛВ в патологическом очаге и снижению общей токсичности. Способность наноструктурированных СДЛВ, в том числе липосом, накапливаться в опухолевой ткани благодаря эффекту пассивного транспорта, связана с особенностями строения стенок сосудов в опухоли. К характерным свойствам неопластических клеток относится их способность воздействовать на окружающие клетки нормальных тканей и вызывать в них ряд реакций, способствующих прогрессивному росту опухолей. Одной из таких важнейших реакций является процесс формирования сосудистой сети опухоли за счет развития существующих сосудов, образования новых сосудов (ангиогенез) и привлечения эндотелиальных клеток костного мозга (постнатальный ангиогенез). Образующаяся в результате ангиогенеза сосудистая система опухоли оказывается неполноценной как в структурном, так и в функциональном отношении. Сосуды имеют аномальное строение, неправильную форму, сильно извиты, обладают неравномерным диаметром и повышенной проницаемостью, часто сообщаются между собой случайными шунтами. Базальная мембрана сосудов обычно утолщена или отсутствует, а между морфологически поврежденными эндотелиальными клетками, выстилающими их, имеются разрывы. Эти дефекты имеют размеры от сотен нанометров до нескольких микрон. Например, для карциномы молочной железы мышей МСа-IV характерно наличие дефектов размером 1200-2000 нм, для опухоли молочной железы Shionogi – 200-380 нм, для карциномы толстой кишки LS 174Т – 400-600 нм. Для сравнения функциональная проницаемость у капилляров в нормальных тканях обнаружена при размере пор около 7 нм. В связи с этим кровоток в опухоли становится дезорганизованным и неравномерным. Кроме того, безудержно пролиферирующие опухолевые клетки дополнительно оказывают давление на кровеносные и лимфатические сосуды. В результате, в опухоли образуются очаги некроза и участки с патологической микросредой, характеризующиеся интерстициальной гипертензией (вызывающей развитие внесосудистого гидростатического давления), гипоксией и ацидозом (рН ниже 7,0). Неполноценный кровоток и интерстициальное давление препятствуют доставке к опухолевым тканям низкомолекулярных химиотерапевтических агентов, в отличие от молекул размером от 90 до 220 нм, которые способны накапливаться и длительно удерживаться в опухолях. Феномен, благодаря которому в опухоли избирательно накапливаются макромолекулярные препараты и СДЛВ, называется эффект повышенной проницаемости и удерживания (рис. 2.)  Рис. 2. Эффект повышенной проницаемости и удерживания Активный транспорт ЛВ в органы, ткани и отдельные клетки осуществляется за счет присоединения к поверхности липосом специфических лигандов. Проникновение содержимого липосомы в клетку представляет сложный процесс, который в разных условиях происходит по различным механизмам. Большинство липидных нанокапсул интернализуются в клетку двумя путями – слиянием с цитоплазматической мембраной и эндоцитозом. Хотя липосомы в большинстве случаев входят в клетку с помощью разных путей эндоцитоза, слияние с цитоплазматической мембраной возможно и желательно для прямой доставки содержимого, в частности олигонуклеотидов и белков, в цитозоль для предотвращения лизосомального разрушения. Механизм слияния липосомы с клеткой зависит от размера и состава липосомы, а также от типа клеток-мишеней. Состав и структура липосом. В середине 60-х гг. прошлого века английский ученый А. Бэнгхем, выясняя роль фосфолипидов (ФЛ) в свертывании крови, изучал структуру коллоидных дисперсий, образующихся при набухании ФЛ в избытке воды. На электронных микрофотографиях он увидел слоистые частицы, удивительно похожие на мембранные структуры клетки. Следующее исследование показало, что неорганические ионы, присутствующие в растворе в момент набухания ФЛ, включаются внутрь этих частиц и удерживаются там длительное время, обмениваясь с ионами наружного раствора с очень малой скоростью. Так впервые было установлено, что ФЛ, являющиеся основными компонентами клеточных мембран, способны самопроизвольно образовывать в воде замкнутые мембранные оболочки. Эти оболочки захватывают в себя часть окружающего водного раствора, а образующая их фосфолипидная мембрана обладает свойствами полупроницаемого барьера, легко пропускающего воду, но препятствующего диффузии растворенных в ней веществ. Липидные частицы в дальнейшем получили название липосомы (от греч. lipos – жир и soma – тело или частица). В 70-е гг. начались первые систематические исследования свойств липосом в качестве удобной модели клеточных мембран. Тогда же появилось убеждение, что такие липидные наноструктуры, будучи нагружены соответствующей субстанцией, могут стать перспективной ЛФ для многих медицинских препаратов. Липосомы представляют собой небольшие самообразующиеся фосфолипидные везикулы сферической формы, размером от 50 до 1000 нм . Очень важными факторами, обеспечивающими опухолетропность липосомальных препаратов, являются, с учетом особенностей ангиогенеза опухолей, размеры везикул, липидныйсостав и поверхностные характеристики липосом . Основным компонентом липосом являются ФЛ. ФЛ относятся к классу полярных липидов и представляют собой сложные эфиры жирных кислот и глицерола. Уникальное строение природных ФЛ, в молекулах которых одновременно находятся гидрофобные и полярные фрагменты, предопределяет их незаменимую роль во многих важнейших биологических процессах. ФЛ являются одними из основных компонентов биомембран эукариотических и прокариотических клеток, среди них есть биологически активные вещества, которые используются в пищевой и фармацевтической промышленности. Широкое использование липидов в медицине основано на их высокойфункциональной активности, малой токсичности, биосовместимости и биодеградируемости. ФЛ для медицинских целей производятся в основном из желтков куриных яиц или соевых бобов, в небольших количествах используется также другое растительное сырье и ткани животных. Наиболее частое применение нашел фосфатидилхолин, получаемый из природного сырья. Фосфатидилхолин – главный ФЛ большинства типов животных. Его содержание обычно составляет не менее 50% суммы ФЛ. 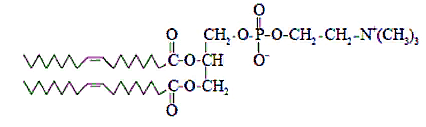 Рис. 3. Структурная формула фосфатидилхолина. Другие ФЛ – фосфатидилэтаноламин, фосфатидилглицерин, сфингомиелин – обычно присутствуют как минорные компоненты фосфолипидной смеси при получении липосом или эмульсий. Заслуживают упоминания и несколько других соединений: фосфатидилинозит, дифосфатидилглицерин (кардиолипин), фосфатидилсерин, фосфатидная кислота. Многие ФЛ при диспергировании в воде самопроизвольно образуют гетерогенную смесь бислойных везикулярных структур. Выбор типа ФЛ определяет «жесткость» (или «текучесть») и заряд бислоя. Насыщенные ФЛ сдлинными ацильными цепями, такие как дипальмитоилфосфатидилхолин, образуют жесткую, довольно непроницаемую бислойную структуру, в то время как ненасыщенный фосфатидилхолин из природных источников (яичный или соевый) придает большую проницаемость и меньшую стабильность бислою. Использование положительно или отрицательно заряженных липидов при получении липосом обеспечивает им поверхностный заряд. Благодаря включению в заряженные липосомы ЛВ приобретают новые фармакокинетические свойства по сравнению со свободными препаратами. В случае инкапсулирования в катионные липосомы таких препаратов как этопозид и фотосенс, значительно увеличивалась их противоопухолевая активность и снижалась общая токсичность. В состав липосом может также включаться холестерин. Холестерин является самым распространенным липидом класса стеролов, который содержится в плазматических мембранах животных клеток, лизосомах, эндосомах и аппарате Гольджи, составляя около 30% всей массы мембранных липидов. Его молекула состоит из компактного, жесткого гидрофобного ядра, а полярной головкой является гидроксильная группа. В структуре стеролов можно выделить три участка, важных при связывании с ФЛ: 1) плоский скелет, 2) длинная боковая цепочка в положении С17, 3) группа ОН в β-положении у атома С3. Между полярными группами ФЛ и ОН-группами холестерина образуются водородные связи, а между жирнокислотными остатками и кольцевой системой холестерина осуществляется гидрофобное взаимодействие. 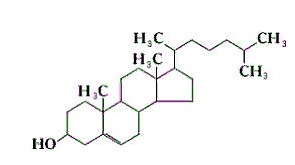 Рис.4. Структурная формула холестерина Поскольку основным структурным элементом биомембран являются ФЛ, долгое время функциональная роль стеринов была непонятна. Однако на модельных мембранах было показано, что стеролы участвуют в стабилизации определенных физических свойств мембран. Роль холестерина в "жидком" бислое сводится к уменьшению размеров динамических дефектов между кластерами за счет непосредственного их заполнения и уменьшения наклона углеводородных цепей фосфолипидных молекул в самих кластерах. В результате смеси ФЛ-холестерол занимают по упорядоченности промежуточное положение между гелевым и жидкокристаллическим состояниями чистого ФЛ. По сути, холестерин играет роль своеобразного «наполнителя», снижая силы притяжения между углеродными цепями липидов. Это приводит к уменьшению проницаемости и увеличению механической устойчивости бислоя. В водной среде молекулы ФЛ и холестерина самоорганизуются в липидный бислой, при этом полярные «головки» ФЛ обращены к растворителю, а хвостовые части обращены друг к другу, таким образом, формируя внутреннее водное пространство или ядро. Внутреннее гидрофильное ядро липосом наиболее подходит для инкапсулирования водорастворимых агентов. В то время как гидрофобные, жирорастворимые и амфифильные ЛВ могут быть включены в липидный бислой. 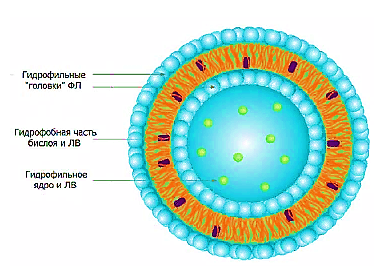 Рис. 5. Структура липосомы. Включение лекарственных веществ в липосомы. Способность липосом включать в себя различные вещества можно охарактеризовать с помощью двух параметров – внутренний водный объем (ВВО) и эффективность включения (ЭВ). ВВО, или «захватывающий» объем, – это объем, ограниченный данным количеством липида. Определяется как количество водорастворимого вещества в расчете на моль липида. ЭВ – один из важнейших параметров липосомальных препаратов вычисляется как отношение массы вещества, ассоциированного с липосомами, к общей массе вещества, взятого для приготовления липосомальной дисперсии. ЭВ зависит от коэффициента распределения (Кр) и от доли объема дисперсии, занимаемого липосомами. Чем больше Кр, тем больше вещества будет находиться в мембране, то есть в липосомах. Поэтому ЭВ липофильных и гидрофобных веществ, в основном, определяется концентрацией липидов и растворимостью конкретного липофильного вещества в этой фазе. Не включившееся гидрофобное вещество вследствие нерастворимости в воде образует отдельную фазу, которую, как правило, можно отделить фильтрованием. Доля полярных веществ внутри липосом зависит от их растворимости в воде и пропорциональна только доле ВВО липосом, которая возрастает с увеличением размера липосом и с ростом концентрации липидов (т.е. количества липосом). Кроме того, необходимо отметить, что холестерин уплотняет фосфолипидный бислой. И, таким образом, объем липидной фазы липосом, содержащих холестерин, для одной и той же массы липидов меньше, чем объем липидной фазы липосом без холестерина и, следовательно, ЭВ будет меньше. |
