Профессиональные болезни. Липосомы. Преимущества и перспективы применения липосомальных форм лекарственных средств
 Скачать 1.33 Mb. Скачать 1.33 Mb.
|
|
Поскольку ЭВ вещества зависит от его свойств, в частности от растворимости в воде, существует и два технологических подхода к загрузке препаратов в везикулы – пассивная и активная загрузка. Самым простым из них является пассивное инкапсулирование. Липофильные соединения способны распределяться в липосомальной мембране, поэтому их растворяют вместе с липидами в подходящем органическом растворителе. Далее растворитель упаривают под вакуумом до образования липидной пленки, которую высушивают и гидратируют водным раствором для получения липосом. Учитывая Кр препарата, можно добиться высокой степени его включения и стабильного удерживания в двойном слое липидов. В случае пассивной загрузки в липосомы гидрофильных соединений их обычно растворяют в водной среде, используемой для гидратации липидной пленки. В зависимости от условий гидратации и свойств препарата ЭВ меняется от 5 до 20%, а не загрузившийся препарат остается в водной среде, окружающей везикулы. В редких случаях пассивная загрузка гидрофильного препарата достигает 90%. В дальнейшем не включившийся препарат необходимо удалить с помощью дополнительных технологических приемов. Для увеличения включения гидрофильных ЛВ в липосомы применяются методы активной загрузки, при которой вещества инкапсулируются в уже готовые везикулы с помощью определенного трансмембранного градиента. При этом процент включившегося вещества может достигать 100% от исходного количества при соотношении ЛВ/липид 0,1-0,3, что недостижимо в большинстве случаев для методов пассивной загрузки. Но, хотя активная загрузка и увеличивает количество попадающих в липосомы молекул ЛВ, нередко это приводит к ухудшению последующего высвобождения, например, в случае активной загрузки доксорубицина с использованием градиента сульфата аммония. Поэтому представляется целесообразным использовать активную загрузку при создании липосом, расчитанных на интернализацию в клетки-мишени, путем присоединения «молекулярного адреса». Классификация липосом. В зависимости от размера везикул и числа образующих их липидных слоев (ламелл) выделяют следующие классы липосом (Рис. 6): многослойные или мультиламеллярные везикулы (МЛВ). Они состоят из нескольких десятков, а то и сотен липидных бислоев, разделенных водными промежутками, и имеют довольно крупные размеры – от 500 нм до 50 мкм. олиголамеллярные везикулы (ОЛВ) в отличие от многослойных состоят из 2-4 бислоев с диаметром от 100 до 1000 нм. однослойные или моноламеллярные везикулы, которые образованы одним липидным бислоем. Данные везикулы подразделяются на малые (20-100 нм) и большие (100-1000 нм) (ММВ и БМВ соответственно). олиговезикулярные (ОВЛ) и мультивезикулярные липосомы состоят из крупной липосомы, внутри которой располагается несколько более мелких. 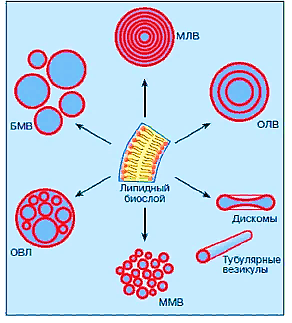 Рис. 6. Различные виды липосом. Липосомы не всегда внешне могут выглядеть как глобулы. Иногда они принимают уплощенную дискообразную форму (так называемые дискомы) или имеют вид очень длинных и тонких трубок, которые называют тубулярными липосомами. Одноламеллярные везикулы обычно используют для доставки одного ЛВ. МЛВ могут применяться для транспортировки в опухоль двух и более компонентов, а также для транспортировки макромолекул, таких как белки, пептиды и нуклеиновые кислоты (мультифункциональные липосомы). Так в исследовании была продемонстрирована высокая цитотоксическая активность новых противоопухолевых препаратов – координационных комплексов европия, которые включались в МЛВ в комбинации с визуализирующим агентом. Согласно исследованиям наиболее оптимальными для доставки химиотерапевтических агентов являются липосомы с диаметром 100 – 200 нм. Липосомы по своей структуре и функциям подразделяются на следующие типы: простые липосомы, стерически стабилизированныелипосомы, липосомы для направленного транспорта, катионные липосомы, липосомы с эндогенными и экзогенными воздействиями. Простые (классические) липосомы состоят только из ФЛ или ФЛ и холестерина. Введенные различными путями in vivo, они циркулируют в кровотоке в течение довольно короткого периода времени и быстро накапливаются в ретикулоэндотелиальной системе (РЭС). Большое количество фагоцитов и обильное кровоснабжение являются главными причинами захвата везикул преимущественно печенью и селезенкой. Благодаря этому свойству липосомы можно использовать для доставки в макрофаги иммуномодуляторов, цитотоксических и противомикробных соединений, а также для диагностики, например, в качестве носителей радиоизотопов и контрастных средств для визуализации. Стерически стабилизированные липосомы (Stealth-липосомы). Для предотвращения опсонизации и поглощения липосом клетками РЭС их поверхность модифицируют гидрофильными полимерами (полиэтиленгликоль (ПЭГ) 2000, 5000 и др.), которые формируют защитный слой и препятствуют распознаванию везикул белками плазмы. В результате отмечается значительное снижение клиренса и увеличение продолжительности циркуляции липосом в крови, обеспечивая пролонгированный терапевтический эффект ЛВ. Кроме ПЭГ для стабилизации липосом в кровотоке используют фосфатидилинозит. Остатки миоинозита молекул фосфатидилинозита создают на поверхности мембраны высокогидратированную стерически стабилизированную оболочку, подобно остаткам ПЭГ. Уникальной особенностью липосом является возможность доставки химиотерапевтических агентов внутрь опухолевой клетки с целью повышения эффективности и селективности их действия. Направленный транспорт осуществляется за счет присоединения векторных молекул (лигандов) к поверхности липосом. Лиганды способствуют селективному связыванию с опухоль-ассоциированными антигенами или рецепторами, расположенными на поверхности опухолевых клеток. В качестве векторных молекул могут выступать МКА или их фрагменты (Fab-фрагменты МКА), пептиды, факторы роста и другие специфические лиганды. Липосомы, к поверхности которых присоединены МКА или Fab-фрагменты МКА, называются иммунолипосомами. Иммунолипосомы являются весьма перспективным средством доставки противоопухолевых ЛВ. При выборе антитела для конструирования иммунолипосом следует учитывать ряд факторов: МКА должно сохранять свою специфичность при конъюгировании с липосомами, обладать высокой аффинностью к клетке-мишени и низкой иммуногенностью. Одним из подходов по улучшению доставки терапевтических агентов является использование лизосомо-направленных липосом. Суть данного подхода заключается в том, что, попав в клетку, подобная липосома связывается с лизосомой посредством специфического лиганда и поглощается ею. Внутри лизосомы под действием ферментов происходит разрушение липидного бислоя с последующим высвобождением ЛВ, которое оказывает необходимое терапевтическое воздействие. В исследовании изучалась эффективность новых лизосомотропных лигандов на основе нейтрального красного и родамина В посредством их прикрепления к поверхности липосом, которые содержали модельное соединение, обладающее флюоресцентными свойствами. С помощью конфокальной микроскопии было доказано, что уровень доставки модельного соединения посредством модифицированных липосом, значительно выше по сравнению с простыми липосомами. Липосомы также активно изучаются в качестве потенциальных средств направленной доставки генов в определенные участки тела. Для доставки генетического материала используют катионные липосомы, которые взаимодействуют с отрицательно заряженной молекулой ДНК, нейтрализуютее и сжимают в более компактную структуру, обеспечивая при этом защиту от нуклеаз, клеточную интернализацию путем эндоцитоза и экспрессию сжатой плазмиды. Известно, что важнейшим этапом процессинга виросом является слияние ее мембраны с мембраной эндосомы, происходящее под действием гемагглютинина. При этом содержимое липосомы попадает в цитозоль, то есть избегает лизосомальных ферментов. Именно этот путь считается предпочтительным для липосом, нагруженных генетическим материалом. В последние годы большой интерес представляют исследования в области применения липосомальных препаратов в сочетании с различными эндогенными (пониженное значение рН, наличие специфических ферментов) и экзогенными воздействиями (свет, ультразвук , нагрев , а также их сочетания), что позволяет увеличить избирательность доставки ЛВ к опухоли и контролировать его высвобождение внутри нее. В основе механизма действия подобных систем доставки лежит ответная реакция на триггерное воздействие, способствующее разрушению структуры липосомальной мембраны (ее деструкции), в результате чего происходит высвобождение инкапсулированного ЛВ из липосомы в поврежденную ткань/опухолевую ткань. Контролируемое высвобождение особенно важно при химиотерапии быстро прогрессирующих опухолей, в которых необходимо незамедлительное создание высоких концентраций ЛВ для получения стойкого цитотоксического эффекта. Методы получения липосом. Существенным образом на свойства липосом влияют методы их получения. От технологии приготовления зависит размер везикул, степень окисления липидов, входящих в состав оболочки, их внутренний объем, стабильность при хранении и другие характеристики. Известны различные способы получения липосом, каждый из которых имеет свои преимущества и недостатки, поэтому выбор метода, в основном зависит от задач, поставленных при разработке той или иной ЛЛФ. В большинстве случаев получение липосом начинается с приготовления МЛВ по классической методике Бенгхема (пленочный метод, гидратация липидной пленки). Это наиболее широко используемый и простой метод получения МЛВ в лабораторных и полупромышленных масштабах. В основе данного метода лежит упаривание раствора липидов до получения тонкой пленки на дне круглодонной колбы с последующей ее сушкой для удаления остаточного растворителя. Полученную пленку затем гидратируют с образованием липосомальной дисперсии. Гидратацию проводят при температуре выше температуры фазового перехода (Т.ф.п.) липидов, либо выше Т.ф.п. самого высокоплавящегося компонента в липидной смеси. Вещества для инкапсулирования в зависимости от их растворимости добавляют в растворитель для гидратации (гидрофильные) или растворяют с липидами в органическом растворителе (гидрофобные и жирорастворимые). Недостатками метода является образование гетерогенных по размеру везикул с небольшим внутренним объемом и низкой ЭВ гидрофильных веществ. Разработаны методы получения липосом, основанные на смене растворителя и имеющие множество модификаций: инжекция растворителя, детергентный диализ, обращение фаз. Метод инжекции – получение липосом посредством впрыскивания раствора ФЛ в органическом растворителе (диэтиловый эфир, смесь эфир/метанол, этанол) в водную среду. Последующее удаление органического растворителя под вакуумом приводит к образованию липосом. В условиях метода можно контролировать размер формируемых липосом путем регулирования температуры водной среды, природы растворителя для ФЛ, концентрации ФЛ и скорости перемешивания. Недостатками метода являются низкая ЭВ вещества в липосомы, нестандартность и низкая стабильность получаемых липосом. Метод удаления детергента (детергентный диализ). Детергенты в критической концентрации мицеллообразования используются для солюбилизации липидов. В процессе удаления детергента путем диализа ФЛ объединяются в везикулы гетерогенные по размеру. Метод отличается хорошей воспроизводимостью . Метод обращения фаз. Метод обеспечивает максимальное включение водной фазы в структуру липидных везикул. Данный метод имеет ряд и других преимуществ: он технологичен и дает возможность включать в липосомы как гидрофильные, так и гидрофобные соединения; ЭВ во внутреннюю оболочку гидрофильных веществ достигает уровня 80%; позволяет максимально избежать загрязнения липосом посторонней микрофлорой в процессе получения, за счет использования хлороформа, являющегося хорошим дезинфицирующим средством. Метод дает возможность частичной автоматизации технологического процесса. Однослойные липосомы получают в основном путем разрушения МЛВ различными способами: обработкой УЗ, экструзией с использованием пресса Френча или фильтрующих мембран, гомогенизацией/микрофлюидизацией, методом «замораживание-оттаивание» и др. УЗ обработка. Метод представляет собой обработку МЛВ пульсирующими звуковыми волнами высокой частоты, в результате которой происходит разрыв везикул с образованием дисперсии однослойных липосом. Озвучивание дисперсии липосом может производиться двумя способами: в соникаторе банного типа или с использованием зондирующего соникатора путем непосредственного погружения наконечника зонда в липосомальную дисперсию. Полученные таким способом липосомы недостаточно устойчивы при хранении, что требует введения стабилизирующих веществ, и отличаются неоднородностью состава. Кроме того, в процессе озвучивания происходит интенсивное нагревание липосомальной дисперсии, что приводит к окислению и гидролизу ФЛ. Повышение температуры можетмпривести также к инактивации включаемых в липосомы термочувствительных веществ, например белков, ДНК и др. Экструзия с использованием фильтрующих мембран. Согласно методу, дисперсии МЛВ пропускают через мембранные фильтры под высоким давлением с помощью специального оборудования – экструдеров. Подбирая фильтры с подходящим размером пор, можно получить липосомы желаемого диаметра. При продавливании МЛВ сквозь малые поры снимаются последовательные слои мембран, и остается только один слой. Кроме уменьшения размера липосом, метод позволяет получить липосомы с гомогенным распределением по размеру. С применением этого метода могут использоваться различные липиды для получения стабильных липосом. Гомогенизация и микрофлюидизация. Для крупномасштабного производства липосом предложена техника гомогенизации (микроэмульгирования). Преимуществами этого метода является высокая производительность метода (до 150 л препарата в сутки), стандартность и реальная возможность постоянного контроля температуры и давления. Процесс проводят в гомогенизаторе высокого давления, в результате происходит разрушение крупных везикул при пропускании дисперсии МЛВ под высоким давлением через специальный клапан. В ходе процесса дисперсия подвергается неоднократной циркуляции через гомогенизатор, при этом дисперсию необходимо непрерывно охлаждать для отвода тепла, выделяемого насосом при сжатии. Условия гомогенизации необходимо подбирать для каждого вида липосом, причем определяющими являются величина липосом и степень включения субстанции. На стабильность липосом и включение вещества в их состав оказывает влияние ионная сила, величина рН, температура проведения процесса. Кроме того, самостоятельное значение имеет стабильность самого ЛВ (субстанции), включаемого в липосомы . Большое влияние на размер везикул, полученных в результате гомогенизации, оказывают давление гомогенизации и число циклов. Размер липосом непрерывно уменьшается при постоянной рециркуляции и, в конечном счете, приближается к постоянной величине. Однако в некоторых случаях после достижения минимального размера при дальнейшем измельчении липосомы могут укрупняться. Стерилизация липосом. Технология получения ЛЛФ ряда препаратов в настоящее время достаточно хорошо разработана, но во всей цепи технологических процессов есть по крайней мере один этап, еще не нашедший удовлетворительного технического решения, – этап стерилизации, необходимый потому, что липиды являются хорошей питательной средой для развития многих видов микроорганизмов. Наиболее часто применяемый метод стерилизации липосом – фильтрация. Стерилизующая фильтрация – метод стерилизации, представляющий собой фильтрацию препаратов через стерильный фильтрующий материал под давлением. С целью подбора оптимального фильтра должны производиться исследования, приводящие к минимальной сорбции активной субстанции и компонентов липосом. Для стерилизации могут быть использованы мембранные и глубинные фильтры которые задерживают частицы диаметром более 200 нм. Этот способ стерилизации подходит для термолабильных веществ, в том числе липосом, так как не включает какой-либо формы нагревания и условий, которые могут приводить к образованию продуктов деградации или утечке липосомального содержимого. Однако, в ряде случаев при работе с липосомами размером более 0,2 мкм, например, в случае липосомальных вакцин, стерилизующая фильтрация неприемлема. Традиционные термические методы стерилизации не подходят, поскольку приводят к разрушению структуры липосом. Однако некоторые исследователи не исключают возможность применения данных методов для стерилизации ЛЛФ. Возможность использования термической стерилизации липосом определяется сочетанием двух факторов: их стабильностью к окислению и термостойкостью веществ, вводимых в липосомы. Например, при тепловой стерилизации липосом, содержащих липиды с насыщенными жирными кислотами, не обнаружено изменения физико-химических и биологических свойств препаратов. В отличие от термических методов «холодная» стерилизация парами этиленоксида может быть использована для стерилизации термочувствительных препаратов, поскольку не вызывает деградации продукта. Кроме того, данный метод не влияет на размер везикул. Являясь алкилирующим агентом для бактериальных белков и генетического материала, этиленоксид может служить эффективным антибактериальным средством широкого спектра действия, он также эффективен в отношении вирусов. Необходимо отметить, что этиленоксид легко воспламеним, канцерогенен и мутагенен, и после стерилизации препараты должны быть тщательно дегазированы . Наибольшее распространение получила радиационная стерилизация. Особенно данный метод стерилизации актуален при масштабном производстве липосомальных препаратов. Радиационная стерилизация позволяет добиться гибели микроорганизмов из-за деградации ДНК и разрушения мембраны посредством образования свободных радикалов. К сожалению, образующиеся при γ-облучении радикалы не только инактивируют микроорганизмы в стерилизуемом препарате, но и неизбежно воздействуют также на инкапсулируемое ЛВ и липидную оболочку мембран, вызывая перекисное окисление ненасыщенных ФЛ. Поэтому для выбора условий стерилизации с наименьшим нарушением свойств ЛП требуется изучение роли этих процессов. |
