М.И.Кузин. Хирургические болезни. Литература для студентов медицинских вузов Хирургические болезни Под редакцией
 Скачать 10.27 Mb. Скачать 10.27 Mb.
|
ПРЕДИСЛОВИЕТретье издание учебника "Хирургические болезни" основательно переработано и дополнено новыми сведениями о патогенезе, диагностике и лечении хирургических болезней. В книгу включена новая глава "Синдром системной реакции на воспаление", в которой представлены современные взгляды на воспаление и иммунитет, подчеркнута роль цитокиновой системы и межклеточных взаимоотношений, регулирующих физиологические и патологические процессы в организме. Мы сочли целесообразным перед изложением частных вопросов хирургии поместить специальную главу "Малоинвазивные технологии в хирургии" для того, чтобы сразу познакомить читателя с видеоэндоскопической аппаратурой и видеоэндоскопическими оперативными вмешательствами, а также с методами интервенционной радиологии и мини-инвазивными вмешательствами под контролем ультразвуковой техники. Учитывая распространенность морбидных форм ожирения и социальную значимость этой болезни, мы включили специальную главу о хирургическом лечении ожирения, поскольку различные варианты оперативного лечения ожирения получают все большее распространение как за рубежом, так и в России. Заново написана глава "Трансплантация органов" с учетом новых достижений в этой области. Третье издание соответствует программе и квалификационной характеристике врача по разделу "Хирургические болезни". Как и в предыдущем издании, в учебник не включены те разделы хирургии, которые студенты изучают по специальным учебникам стоматологии, нейрохирургии, урологии, ортопедии и травматологии. Авторы будут благодарны читателям за ценные замечания и предложения. Глава 1 СИНДРОМ СИСТЕМНОГО ОТВЕТА НА ВОСПАЛЕНИЕСреди хирургических заболеваний значительное место занимают острые воспалительные болезни органов брюшной и грудной полостей, мягких тканей тела. Достижения молекулярной биологии дали основание для пересмотра прежних представлений о сути воспаления и регуляции иммунного ответа на него. Установлено, что универсальным механизмом, определяющим физиологические и патологические процессы в организме, являются межклеточные взаимоотношения. Основную роль в регуляции межклеточных взаимоотношений играет группа белковых молекул, получившая название цитокиновои системы. В связи с этим мы сочли целесообразным перед изложением частных вопросов воспалительных заболеваний дать краткие сведения о современных представлениях о сути воспаления и регуляции иммунного ответа на него. Ответная реакция организма на воспаление, независимо от локализации воспалительного процесса, развивается в соответствии с общими закономерностями, свойственными всякому острому воспалению. Воспалительный процесс и ответная реакция на него развиваются при участии многочисленных медиаторов воспаления, в том числе цитокиновои системы, по одним и тем же закономерностям, как при внедрении инфекции, так и при воздействии травмы, очагов некроза тканей, ожогов и некоторых других факторов. Клинические проявления острых воспалительных заболеваний наряду с общими для воспаления симптомами имеют специфические симптомы, обусловленные поражением того или другого органа, его локализацией: например, при остром аппендиците и остром холецистите общими свойственными воспалению симптомами являются боли, повышение температуры тела, лейкоцитоз, увеличение частоты пульса. При физикальном исследовании выявляются специфические для каждого заболевания симптомы, позволяющие дифференцировать одно заболевание от другого. Реакция организма на воспаление, при которой не нарушаются функции жизненно важных систем организма, называется местной. При флегмоне или гангрене пораженного органа симптомы, свойственные воспалению, становится более выраженными, обычно начинают появляться признаки нарушения функции жизненно важных систем организма в виде значительной тахикардии, тахипноэ, гипертермии, высокого лейкоцитоза. Реакция на тяжелое воспаление принимает системный характер и протекает как тяжелое общее заболевание воспалительной природы, вовлекающее в ответную реакцию практически все системы организма. Такой тип реакции по предложению согласительной комиссии американских хирургов (1992) называют синдромом системной реакции организма на воспаление (SystemicInflammatoryResponseSyndrome — SIRS). Воспаление представляет собой приспособительную реакцию организма, направленную на уничтожение агента, вызвавшего воспалительный процесс, и восстановление поврежденной ткани. Воспалительный процесс, развиваясь при обязательном участии медиаторов воспаления, может сопровождаться преимущественно местной реакцией с типичными местными проявлениями болезни и умеренной, малозаметной общей реакцией органов и систем организма. Местная реакция защищает организм, освобождает его от патогенных факторов, отграничивает "чужеродное" от "своего", чем способствует выздоровлению. Медиаторы воспаления. В эту группу входит множество активных химических соединений: 1) цитокины (провоспалительные и антивоспалительные); 2) интерфероны; 3) эйкозаноиды; 4) активные кислородные радикалы; 5) комплемент плазмы крови; 6) биологически активные вещества и стрессорные гормоны (гистамин, серотонин, катехоламин, кортизол, вазо-прессин, простагландины, гормон роста); 7) фактор активации тромбоцитов; 8) монооксид азота (N0) и др. Воспаление и иммунитет функционируют в тесном взаимодействии, они очищают внутреннюю среду организма как от чужеродных элементов, так и от поврежденных, измененных своих тканей с последующим отторжением их и ликвидацией последствий повреждения. Нормально функционирующие контрольные механизмы иммунной системы препятствуют бесконтрольному выделению цитокинов и других медиаторов воспаления, обеспечивают адекватную местную реакцию на процесс (см. схему). 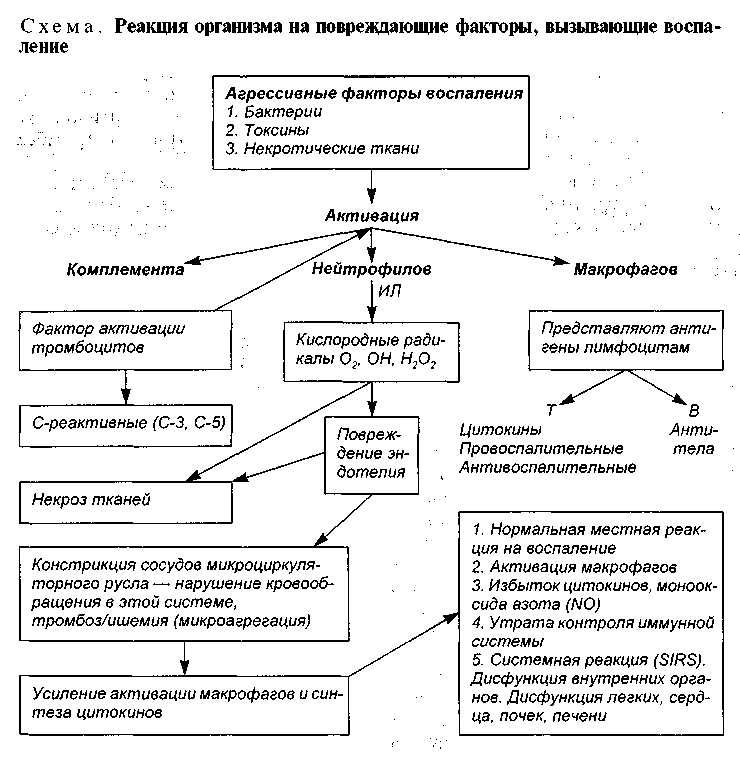 Местная реакция организма на воспаление. Проникновение инфекции и воздействие других повреждающих факторов вызывают активацию комплемента, который в свою очередь способствует синтезу С-реактивных белков (С-3, С-5), стимулирует продукцию фактора активации тромбоцитов, образование опсонинов, участвующих в процессе фагоцитоза и хемотаксиса. Основная задача воспалительной фагоцитарной реакции заключается в удалении микроорганизмов и ограничении воспаления. В этом периоде может появляться транзиторная бактериемия. Проникшие в кровь микроорганизмы уничтожаются нейтрофильными лейкоцитами, макрофагами, свободно циркулирующими в крови, и купферовскими клетками, выполняющими роль макрофагов. Наиболее важная роль в удалении микроорганизмов и других чужеродных веществ, а также в продукции цитокинов и различных медиаторов воспаления принадлежит активированным макрофагам, как свободно циркулирующим в крови, так и резидентным, фиксированным в печени, селезенке, легких и других органах. Следует подчеркнуть, что купферовские клетки, относящиеся к резидентным макрофагам, составляют более 70% всех макрофагов организма. Им принадлежит главная роль в удалении микроорганизмов в случае появления транзиторной или персистирующей бактериемии, продуктов распада белков, ксеногенных веществ, обезвреживании эндотоксинов. Одновременно с активацией комплемента происходит активация нейтрофилов и макрофагов. Нейтрофилы — первые фагоцитирующие клетки, появляющиеся в очаге воспаления, выделяют активные кислородные радикалы, которые приводят к п о в р е ж д е н и ю и одновременно к активации э н д о т е л и а л ь н ы х клеток. Нейтрофилы начинают выделять провоспалительные и антивоспалительные интерлейкины (ИЛ), относящиеся к цитокиновой системе. При этом антивоспалительные способны ослабить действие провоспалительных интерлейкинов. Благодаря этому достигаются их баланс и уменьшение тяжести воспаления. Активация макрофагов. Макрофаги появляются в очаге повреждения в течение 24 ч с начала воспалительной реакции. Активированные макрофаги осуществляют транскрипцию антигенов (бактерий, эндотоксинов и др.). С помощью этого механизма они представляют антигены лимфоцитам, способствуют их активации и пролиферации. Активированные Т-лимфоциты приобретают значительно большие цитотоксические и цитолитичесие свойства, резко увеличивают продукцию цитокинов. В-лимфоциты начинают продуцировать специфические антитела. В связи с активацией лимфоцитов резко увеличивается продукция цитокинов и других медиаторов воспаления, возникает гиперцитокинемия. Включение активированных макрофагов в развивающееся воспаление является гранью между локальной и системной реакцией на воспаление. Взаимодействие макрофагов с Т-лимфоцитами и клетками "натуральных киллеров" при посредничестве цитокинов обеспечивает необходимые условия для уничтожения бактерий и обезвреживания эндотоксинов, локализации воспаления, предотвращения генерализации инфекции. Важную роль в защите организма от инфекции играют натуральные (естественные) клетки-киллеры (Natural Killer — NK-клетки). Они происходят из костного мозга и представляют собой субпопуляцию больших гранулярных лимфоцитов, способных в отличие от Т-киллеров лизировать бактерии и клетки-мишени без предварительной их сенсибилизации. Эти клетки, так же как макрофаги, удаляют из крови чуждые организму частицы и микроорганизмы, обеспечивают адекватную продукцию медиаторов воспаления и местную защиту от инфекции, сохраняют баланс между провоспалительными и антивоспалительными медиаторами воспаления. Таким образом они препятствуют нарушению микроциркуляции и повреждению паренхиматозных органов избыточным количеством продуцируемых цитокинов, локализуют воспаление, предупреждают развитие тяжелой общей (системной) реакции жизненно важных органов в ответ на воспаление, препятствуют развитию дисфункции паренхиматозных органов. Большое значение для регуляции острого воспаления через посредство фактора некроза опухоли имеют молекулы белка, известные под названием "ядерный фактор каппа В" (Nuclear factor к-kappa В), играющие важную роль в развитии синдрома системной реакции на воспаление и синдрома полиорганной дисфункции. В терапевтических целях можно ограничить активацию данного фактора, что приведет к снижению продукции медиаторов воспаления и может оказать благоприятный эффект, уменьшив повреждение тканей медиаторами воспаления и снизив опасность развития дисфункции органов. Роль клеток эндотелия в развитии воспаления. Клетки эндотелия являются связующим звеном между клетками паренхиматозных органов и циркулирующими в кровеносном русле тромбоцитами, макрофагами, нейтрофилами, цитокинами и их растворимыми рецепторами, поэтому эндотелий микроциркуляторного русла тонко реагирует как на изменения концентрации медиаторов воспаления в крови, так и на содержание их вне сосудистого русла. В ответ на повреждение клетки эндотелия продуцируют монооксид азота (N0), эндотелии, фактор активации тромбоцитов, цитокины и другие медиаторы. Эндотелиальные клетки находятся в центре всех реакций, развивающихся при воспалении. Именно эти клетки после стимуляции их цитокинами приобретают способность "направлять" лейкоциты к месту повреждения. Активированные лейкоциты, находящиеся в сосудистом русле, совершают вращательные движения по поверхности эндотелия микроциркуляторного русла; возникает краевое стояние лейкоцитов. На поверхности лейкоцитов, тромбоцитов и клеток эндотелия образуются адгезивные молекулы. Клетки крови начинают прилипать к стенкам венул, движение их останавливается. В капиллярах образуются микротромбы, состоящие из тромбоцитов, нейтрофилов и фибрина. В результате этого сначала в зоне очага воспаления нарушается кровообращение в микроциркуляторном русле, резко повышается проницаемость капилляров, появляется отек, облегчается миграция лейкоцитов за пределы капилляров, возникают типичные признаки местного воспаления. При тяжелой агрессии происходит гиперактивация клеток, продуцирующих цитокины и другие медиаторы воспаления. Количество цитокинов и монооксида азота увеличивается не только в очаге воспаления, но и за его пределами в циркулирующей крови. В связи с избытком цитокинов и других медиаторов в крови в той или иной мере повреждается микроциркуляторная система органов и тканей за пределами первичного очага воспаления. Нарушается функция жизненно важных систем и органов, начинает развиваться синдром системной реакции на воспаление (SIRS). При этом на фоне выраженных местных признаков воспаления возникает нарушение функции дыхательной и сердечно-сосудистой систем, почек, печени и воспаление протекает как тяжелое общее заболевание с вовлечением всех функциональных систем организма. Цитокины представляют собой сравнительно крупные молекулы белка с молекулярной массой от 10 000 до 45 000 дальтон. По химической структуре они близки друг к другу, однако обладают разными функциональными свойствами. Они обеспечивают взаимодействие между клетками, активно участвующими в развитии местной и системной реакции на воспаление путем усиления или угнетения способности клеток продуцировать цитокины и другие медиаторы воспаления. Цитокины могут оказывать влияние на клетки-мишени - эндокринное, паракринное, аутокринное и и н т е р к р и н н о е действие. Эндокринный фактор выделяется клеткой и влияет на клетку-мишень, расположенную от нее на значительном расстоянии. Он доставляется к клетке-мишени током крови. Паракринный фактор выделяется клеткой и оказывает влияние только на близкорасположенные клетки. Аутокринный фактор выделяется клеткой и влияет на ту же клетку. Интеркринный фактор действует внутри клетки, не выходя за ее пределы. Многие авторы рассматривают эти взаимоотношения как "микроэндокринную систему". Цитокины продуцируются нейтрофилами, лимфоцитами, клетками эндотелия, фибробластами и другими клетками. Цитокиновая система включает в себя 5 обширных классов соединений, объединенных по их доминирующему действию на другие клетки. 1. Цитокины, продуцируемые лейкоцитами и лимфоцитами, называют интерлейкинами (ИЛ, IL), потому что, с одной стороны, они продуцируют ся лейкоцитами, с другой — лейкоциты являются клетками-мишенями для ИЛ и других цитокинов. Интерлейкины подразделяют на провоспалительные (ИЛ-1,6,8,12); антивоспалительные (ИЛ-4,10,11,13 и др.).
5. Факторы, вызывающие рост мезенхимальных клеток. Большинство цитокинов относится к ИЛ (см. таблицу). Таблица
Список сокращений терминов в таблице
В норме продукция цитокинов незначительна и предназначена для поддержания взаимодействия между клетками, продуцирующими цитокины, и клетками, выделяющими другие медиаторы воспаления. Но она резко возрастает при воспалении в связи с активацией клеток, вырабатывающих их. В начальной стадии развития воспаления одновременно выделяются провоспалительные и антивоспалительные интерлейкины. Повреждающее действие провоспалительных интерлейкинов в значительной степени нейтрализуется антивоспалительными, в их продукции сохраняется баланс. Антивоспалительные цитокины оказывают полезное действие, они способствуют ограничению воспаления, уменьшению общей реакции на воспаление, заживлению раны. Большинство реакций при развитии воспаления осуществляется через посредничество цитокинов . Так, например, ИЛ-1 активирует Т- и В-лимфоциты, стимулирует образование С-реактивных белков ранней фазы воспаления, продукцию провоспалительных медиаторов (ИЛ-6, ИЛ-8, ФНО) и фактора активации тромбоцитов. Он увеличивает прокоагулянтную активность эндотелия и активность адгезивных молекул на поверхности клеток эндотелия, лейкоцитов и тромбоцитов, вызывает образование микротромбов в сосудах микроциркуляторного русла, вызывает повышение температуры тела. ИЛ-2 стимулирует Т- и В-лимфоциты, рост NK-клеток, продукцию ФНО и интерферона, увеличивает пролиферацию и цитотоксические свойства Т-лимфоцитов. ФНО обладает наиболее сильным провоспалительным действием: стимулирует секрецию провоспалительных интерлейкинов (ИЛ-1, ИЛ-6), выделение простагландинов, усиливает активацию нейтрофилов, эозинофилов, моноцитов; активирует комплемент и коагуляцию, увеличивает молекулярную адгезию эндотелия лейкоцитов и тромбоцитов, в результате чего образуются микротромбы в сосудах микроциркуляторного русла. При этом повышается проницаемость сосудистой стенки, нарушается кровоснабжение жизненно важных органов, в которых возникают очаги ишемии, что проявляется различными признаками дисфункции внутренних органов. Избыточная продукция цитокинов и других медиаторов воспаления вызывает нарушение регулирующей функции иммунной системы, приводит к их бесконтрольному выделению, нарушению баланса между провоспалительными и антивоспалительными цитокинами в пользу провоспалительных. В связи с этим медиаторы воспаления из факторов, защищающих организм, становятся повреждающими. Монооксид азота (N0) — потенциально токсичный газ. Он синтезируется из а-аргинина и преимущественно действует как ингибирующий нейротрансмиттер. Оксид азота синтезируется не только лейкоцитами, но и эндотелием сосудов. Малые размеры этой частицы, отсутствие электрического заряда и липофильность позволяют ей легко проникать через мембраны клеток, принимать участие во многих реакциях, изменять свойства некоторых белковых молекул. NO является наиболее активным из медиаторов воспаления. Оптимальный уровень N0 в крови необходим для поддержания нормального венозного тонуса и проницаемости сосудистой стенки. В микроциркуляторном русле. N0 защищает эндотелий сосудов (в том числе печени) от повреждающего действия эндотоксинов и фактора некроза опухоли. Монооксид азота сдерживает чрезмерную активацию макрофагов, тем самым способствуя ограничению синтеза избыточного количества цитоки-нов. Это ослабляет степень нарушения регулирующей роли иммунной системы в продукции цитокинов, способствует сохранению баланса между про-воспалительными и антивоспалительными цитокинами, ограничивает возможности медиаторов воспаления вызывать нарушение функции паренхиматозных органов и развитие синдрома системной реакции на воспаление. Монооксид азота расслабляет мышечные клетки в стенках сосудов, участвует в регуляции сосудистого тонуса, релаксации сфинктеров и проницаемости сосудистой стенки. Чрезмерная продукция N0 под влиянием цитокинов способствует снижению венозного тонуса, нарушению перфузии тканей, возникновению очагов ишемии в различных органах, что благоприятствует дальнейшей активации клеток, продуцирующих цитокины и другие медиторы воспаления. Это увеличивает тяжесть нарушения функции иммунной системы, нарушает ее способность регулировать продукцию медиаторов воспаления, приводит к увеличению содержания их в крови, прогрессированию синдрома системной реакции на воспаление, снижению венозного тонуса, уменьшению периферического сосудистого сопротивления, развитию гипотен-зии, депонированию крови, развитию отека, возникновению полиорганной дисфункции, нередко заканчивающейся необратимой полиорганной недостаточностью. Таким образом, действие NO может быть как повреждающим, так и защитным по отношению к тканям и органам. Клинические проявления синдрома системной реакции на воспаление включают характерные для него признаки: 1) повышение температуры тела выше 38°С или снижение ее ниже 36°С при анергии; 2) тахикардию — увеличение числа сердечных сокращений свыше 90 в 1 мин; 3) тахипноэ — увеличение частоты дыханий свыше 20 в 1 мин или снижение РаС02 менее 32 мм рт.ст.; 4) лейкоцитоз свыше 12 • 103 в 1 мм3, или снижение количества лейкоцитов ниже 4 • 103 в 1 мм3, или палочкоядерный сдвиг более чем на 10% Тяжесть синдрома определяется числом имеющихся признаков нарушения функций органов у данного пациента. При наличии двух из четырех вышеописанных признаков синдром оценивают как умеренной (легкой) степени тяжести, при трех признаках — как средней степени тяжести, при четырех — как тяжелый. При выявлении трех и четырех признаков синдрома системного ответа на воспаление риск прогрессирования болезни, развития полиорганной недостаточности, требующей специальных мероприятий для коррекции, резко возрастает. Микроорганизмы, эндотоксины и локальные медиаторы асептического воспаления обычно поступают из первичного очага инфекции или очагов асептического воспаления. При отсутствии первичного очага инфекции микроорганизмы и эндотоксины могут поступать в кровоток из кишечника за счет т р а н с л о к а ц и и через стенку кишки в кровь или из первично-стерильных очагов некроза при остром панкреатите. Обычно это наблюдается при выраженной динамической или механической кишечной непроходимости, обусловленной острыми воспалительными заболеваниями органов брюшной полости. Легкий синдром системного ответа на воспаление — это в первую очередь сигнал об избыточной продукции цитокинов чрезмерно активированными макрофагами и другими цитокинпродуцирующими клетками Если вовремя не будут предприняты меры профилактики и лечения основного заболевания, синдром системной реакции на воспаление будет непрерывно прогрессировать, а начинающаяся полиорганная дисфункция может перейти в полиорганную недостаточность, которая, как правило, является проявлением генерализованной инфекции — сепсиса. Таким образом, синдром системной реакции на воспаление — это начало непрерывно развивающегося патологического процесса, являющегося отражением избыточной, недостаточно контролируемой иммунной системой секреции цитокинов и других медиаторов воспаления, вследствие нарушения межклеточных взаимоотношений в ответ на тяжелые антигенные стимулы как бактериальной, так и небактериальной природы. Синдром системной реакции на воспаление, возникающий вследствие тяжелой инфекции, неотличим от реакции, возникающей в ответ на асептическое воспаление при массивной травме, остром панкреатите, травматичных хирургических вмешательствах, трансплантации органов, обширных ожогах. Это обусловлено тем, что в развитии данного синдрома участвуют одни и те же патофизиологические механизмы и медиаторы воспаления. Диагностика и лечение. Определение и оценка степени тяжести синдрома системной реакции на воспаление доступны любому лечебному медицинскому учреждению. Этот термин принят международным сообществом врачей разных специальностей в большинстве стран мира. Знание патогенеза синдрома системной реакции на воспаление позволяет разрабатывать антицитокиновую терапию, профилактику и лечение осложнений. Для этих целей применяют моноклональные антитела против цитокинов, антитела против наиболее активных провоспалительных цитокинов (ИЛ-1, ИЛ-6, фактора некроза опухоли). Имеются сообщения о хорошей эффективности плазмофильтрации через специальные колонки, позволяющие удалять избыток цитокинов из крови. Для угнетения цитокинпродуцирующей функции лейкоцитов и снижения концентрации цитокинов в крови применяют (правда, не всегда успешно) большие дозы стероидных гормонов. Важнейшая роль в лечении больных принадлежит своевременному и адекватному лечению основного заболевания, комплексной профилактике и лечению дисфункции жизненно важных органов. Частота синдрома системного ответа на воспаление у пациентов отделений интенсивной терапии в хирургических клиниках достигает 50%. При этом у больных с высокой температурой тела (это один из признаков синдрома), находящихся в отделении интенсивной терапии, синдром системного ответа на воспаление наблюдается у 95% больных. Кооперативное исследование, охватывающее несколько медицинских центров в США, показало, что из общего числа больных с синдромом системной реакции на воспаление только у 26% развился сепсис и у 4%— септический шок. Летальность возрастала в зависимости от степени тяжести синдрома. При тяжелом синдроме системного ответа на воспаление она составляла 7%, при сепсисе — 16%, при септическом шоке — 46%. Синдром системной реакции на воспаление может длиться всего несколько дней, но он может существовать и в течение более длительного времени, до уменьшения содержания цитокинов и монооксида азота (N0) в крови, до восстановления баланса между провоспалительными и антивоспалительными цитокинами, восстановления функции иммунной системы контролировать продукцию цитокинов. При уменьшении гиперцитокинемии симптомы могут постепенно идти на убыль, в этих случаях опасность развития осложнений резко уменьшается, в ближайшие дни можно рассчитывать на выздоровление. При тяжелой форме синдрома имеется прямая корреляция между содержанием цитокинов в крови и тяжестью состояния пациента. Про- и антивоспалительные медиаторы могут, в конце концов, взаимно усиливать свое патофизиологическое действие, создавая нарастающий иммунологический диссонанс. Именно при этих условиях медиаторы воспаления начинают оказывать повреждающее действие на клетки и ткани организма. Сложное комплексное взаимодействие цитокинов и цитокиннейтрали-зующих молекул, вероятно, определяет клинические проявления и течение сепсиса. Даже тяжелый синдром системного ответа на воспаление нельзя рассматривать как сепсис, если у пациента нет первичного очага инфекции (входных ворот), бактериемии, подтвержденной выделением бактерий из крови при многократных посевах. Сепсис как клинический синдром трудно поддается определению. Согласительная комиссия американских врачей определяет сепсис как очень тяжелую форму синдрома системной реакции на воспаление у пациентов с наличием первичного очага инфекции, подтвержденной посевом крови, при наличии признаков угнетения функции ЦНС и полиорганной недостаточности. Не следует забывать о возможности развития сепсиса при отсутствии первичного очага инфекции. В таких случаях микроорганизмы и эндотоксины могут появляться в крови вследствие транслокации кишечных бактерий и эндотоксинов в кровь. Тогда кишечник становится источником инфекции, который не был учтен при поиске причин бактериемии. Транслокация бактерий и эндотоксинов из кишечника в кровеносное русло становится возможной при нарушении барьерной функции слизистой оболочки кишечника в связи с ишемией стенок его при перитоните, острой кишечной непроходимости, шоке и других факторах. В этих условиях кишечник становится похожим на "недренированную гнойную полость". |
