анализ теории висбрекинга. Литературный обзор
 Скачать 496 Kb. Скачать 496 Kb.
|
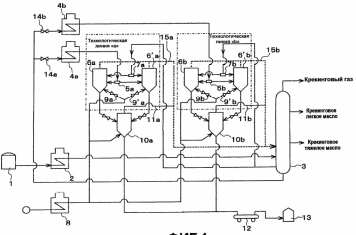 1- Бункер для сырьевого материала; 2 - Печь для предварительного нагревания сырьевого материала; 3 - Дистилляционная колонна; 4 - Трубчатая крекинг-печь (крекинг-печь); 5, 7, 14 - Переключающие клапаны; 6 - Реакционная емкость; 8 - Пароперегреватель; 9 - Клапан; 10 - Резервуар для хранения жидкого пека; 11 - Магистраль; 12 - Установка отверждения пека; 13 - Установка последующего хранения пека; 14 - Входной клапан; 15 - Трубопровод; Рисунок 2 – Технологическая схема крекинга масляных дистиллятов Технический результат – снижение нестабильности количества газообразных компонентов, поступающих в дистилляционную колонну, достижение улучшения эффективности разделения, повышение производительности установки. В патенте [13] предложен способ регулирования процесса термического крекинга высоковязкого сырья. Способ включает нагрев сырья в трубчатой печи, выдержку продуктов крекинга в реакционной камере и разделение продуктов крекинга на газ, бензин и крекинг-остаток. При этом определяют массовое содержание сероводорода в газе крекинга, вязкость сырья и текущее значение вязкости крекинг-остатка, рассчитывают величину коэффициента снижения вязкости из соотношения КСВ=2,15С-3,6, где С - содержание сероводорода, мас.%. Из отношения вязкости нефтяного сырья к КСВ определяют минимальную расчетную вязкость крекинг-остатка, с учетом разницы расчетного и текущего значений вязкости крекинг-остатка осуществляют корректировку режима процесса путем повышения температуры сырьевого потока на выходе из реакционной камеры или снижения его расхода на входе в нее. Изобретение позволяет обеспечить оптимальный подбор условий крекинга путем экспрессного определения оптимальных величин коэффициентов снижения вязкости (КСВ) и соответственно минимальных значений вязкости получаемых крекинг-остатков. В изобретении [14] предложен способ термодинамического крекинга тяжелых нефтепродуктов заключается в том, что сырье вводят в стояк переменного диаметра, крекинг нефтепродуктов с образованием газов крекинга проводят в стояке и в циклонном реакторе под действием вращающегося и турбулентного потока флюидизированного теплоносителя-катализатора в виде мелкозернистых минеральных частиц, которые движутся из регенератора, работающего при температуре от 450°С до 600°С, по двум линиям, выходящим ниже уровня флюидизированного слоя, и частицы транспортируют под действием дымовых газов, образующихся в регенераторе, через стояк в циклонный реактор, в котором происходит отделение газообразных продуктов от теплоносителя-катализатора, который возвращают в регенератор. Также описана установка крекинга. Технический результат - повышение качества тяжелых нефтепродуктов. 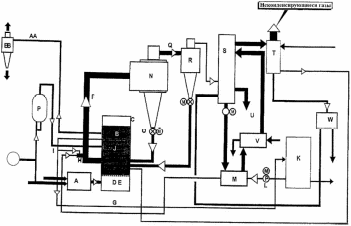 Рисунок 3 – Установка низкотемпературного крекинга Процесс начинается со сжигания газа или нефти в отдельной камере сгорания A и нагревания теплоносителя-катализатора B в регенераторе C. Газ, который состоит из газообразных углеводородов, водяного пара, CO и CO2, вводится в ресивер D и расширяется, проходя через перфорированную флюидизирующую пластину E, под действием чего катализатор переходит в флюидизированное состояние и нагревается горячими дымовыми газами. Этот катализатор может пневматически транспортироваться через стояк F, погруженный в флюидизированный слой. Вблизи выхода стояка, подогретый нефтепродукт с помощью насоса G закачивается в распыляющую форсунку Н, причем водяной пар вводится по линии I в форсунку. Этот пар образуется в теплообменнике J, расположенном в регенераторе. Избыток пара используется для подогрева нефтяного сырья в приемном резервуаре К приблизительно до 100°С. Нефтяное сырье подается насосом L в теплообменник M, где оно нагревается потоком флюидизирующих газов, выходящих из регенератора C. Сырье, которое распыляется в микроскопические капли, нагревается с помощью частиц катализатора, в результате этого температура понижается до значения выше точки росы наиболее тяжелых фракций сырья. В связи с низким парциальным давлением нефтепродуктов в выхлопных газах, этот процесс может быть осуществлен при температуре до 450°С. Газы крекинга нефтепродуктов вместе с выхлопными газами поступают в циклон установки крекинга N, в котором входное сечение меньше, чем сечение стояка, в результате чего увеличивается скорость газового потока. На входе в циклон поток газов отклоняется приблизительно на 45 градусов, что снижает скорость газов и обеспечивает действие большого усилия сдвига, дающего вклад в крекинг наиболее тяжелых фракций. В циклоне N основная часть частиц катализатора падает вниз в секцию питающей линии О) и возвращается обратно в регенератор. Когда в катализаторе накапливается кокс, подача газа в камеру сгорания А постепенно снижается, в результате чего окисляется кокс катализатора. Подпитка потерь катализатора выполняется из бункера для хранения Р, откуда катализатор подается или червячным транспортером, или пневматически. Отработанный катализатор пневматически удаляется из регенератора по линии АА и выделяется в циклоне ВВ. Таким образом, газы, покидающие "реакторный" циклон N по линии Q, могут содержать углеводородные газы, водяной пар, CO, CO2 и NOx, и они проходят через второй циклон R, где отделяется остаточный катализатор. Затем газы транспортируются в систему конденсации, состоящую из конденсаторов S и T, или традиционной дистилляционной колонны. В изображенной системе конденсации, в конденсаторе S конденсируются углеводородные газы при температуре около 100°С, и образовавшийся нефтепродукт выводится по линии U в приемник. Этот конденсатор может быть с отбойными перегородками, типа скруббера или кожухотрубным конденсатором. При использовании скруббера или конденсатора с отбойными перегородками, извлеченный нефтепродукт используется в качестве конденсирующей среды, под действием которой нефтепродукт со дна конденсатора прокачивается через холодильник нефтепродуктов V, который может охлаждаться воздухом или водой, наверх конденсатора, где он может смешиваться с газами из реактора, конденсироваться, и жидкость стекает на дно конденсатора. Благодаря действию центробежных сил на частицы катализатора в "реакторном" циклоне N, достигается гораздо лучшее его отделение от углеводородов, чем в других известных установках. Таким образом в результате анализа патентной литературы установлено, что основная изобретательская деятельность в области процессов термического крекинга направлена на модификацию сырья, подбор оптимальных параметров ведения процессов, а также оформление технологии проведения крекинга в зависимости от сырья и параметров его переработки. ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ТЕРМИЧЕСКОГО КРЕКИНГА ДИСТИЛЛЯТНОГО СЫРЬЯ Химия процесса В основе процессов термолиза нефтяного сырья лежат реакции крекинга (распада) и поликонденсации (синтеза), протекающие через ряд промежуточных стадий по радикально-цепному механизму. В результате термолиза алканов происходит образование более термостойких низкомолекулярных продуктов (алканов и алкенов). В гомологическом ряду алканов наибольшей термической стабильностью обладает метан, термическая деструкция которого термодинамически возможна при температуре выше 560°С. Высокая термостабильность метана объясняется тем, что в его молекуле отсутствуют связи С-С, энергия разрыва которых меньше, чем для связей С-Н. При высокотемпературном пиролизе метана, кроме водорода (и пироуглерода), образуются этилен, этан, ацетилен и арены. Синтез этих продуктов можно выразить следующей схемой:  Ароматические углеводороды образуются в результате вторичных реакций синтеза из ацетилена и этилена. Этан менее устойчив, по сравнению с метаном. Его деструкция начинается уже при 500℃. В результате пиролиза этана пиролизе этана образуются преимущественно этилен и водород, а также метан и жидкие продукты, богатые аренами и алкенами. Еще менее устойчивы пропан и бутан. Деструкция пропана начинается при температуре 460℃, а разложение бутанов (н-бутана и изобутана) – около 435℃. Основные направления пиролиза пропана:  Другие продукты пиролиза пропана бутадиен, ацетилен, ароматика и др.) являются, несомненно, продуктами вторичного происхождения. Начиная с бутана, при термолизе алканов преобладающим становится распад по связи С-С. Относительная скорость их термолиза возрастает с увеличением молекулярной массы, что обусловливается уменьшением энергии разрыва С-С-связей по мере приближения к середине цепи и увеличения степени разветвленности молекул. В процессе пиролиза н-бутана преобладают следующие 2 реакции его распада:  Причем чем выше температура пиролиза бутана, тем больше отодвигается место его распада по С-С-связи к краю молекулы. На это указывает непрерывное возрастание содержания метана в газообразных продуктах реакции вплоть до 900°С. Аналогичные реакции распада характерны для термолиза более высокомолекулярных алканов. При температурах 400-500℃ происходит симметричный разрыв молекулы, в результате которого образуются олефин и парафин с приблизительно одинаковой молекулярной массой. При более высоких температурах в продуктах их термолиза обнаруживаются низшие алканы и высокомолекулярные алкены и арены, вероятно, как результат вторичных реакций [3]. Алкены обладают высокой реакционной способностью в реакциях присоединения благодаря наличию кратной связи, однако в то же время повышенной, по сравнению с алканами, термостойкостью в отношении реакций распада. Наиболее устойчивым алкеном является этилен. Он всегда содержится в продуктах термолиза нефтяного сырья как первичный и вторичный продукт их превращений. По термической стабильности он занимает промежуточное положение между метаном и этаном. Термический распад этилена заметно начинается при температуре 660 °С. При 400 - 600°С в основном протекает его полимеризация: 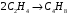 В тех же условиях в продуктах пиролиза этилена содержатся высокомолекулярные олефины - продукт сополимеризации бутиленов с этиленом. При температурах 600°С и выше в продуктах термолиза этилена появляются бутадиен и водород в результате дегидрирования бутена-1. В процессе термолиза высших олефинов при умеренных температурах основной реакцией является полимеризация. Повышение температуры способствует протеканию реакции разрыва С–С связи. С малой скоростью происходит также изомеризация алкенов с образованием более стабильных симметричных олефинов. Увеличение молекулярной массы алкенов приводит к повышению вклада реакции разрыва С–С связей. Для высокомолекулярных алкенов наличие двойной связи практически не влияет на термостойкость алкенов, и по устойчивости они становятся близкими алканам с тем же количеством углеродных атомов. Нафтены обладают большей термостабильностью по сравнению с соответствующими алканами. Наиболее устойчивыми в ряду нафтенов являются циклопентан и циклогексан. Реакции термолиза незамещенных циклоалканов протекают по нецепному механизму посредством разрыва одной из С-С-связей и образования бирадикала, который далее распадается на стабильные молекулы:  Дегидрирование незамещенных цикланов по цепному механизму не происходит, так как по сравнению с ним распад с образованием бирадикала протекает со значительно большей (на несколько порядков) скоростью [3]. Алкилнафтены при термолизе ведут себя, как алканы: преимущественно распадаются боковые цепи по радикально-цепному механизму. Бициклические нафтены при 600 °С и выше подвергаются деци-клизации, деалкилированию и дегидрированию:  Термостойкость аренов зависит от наличия боковых цепей в их молекуле. Арены, имеющие С-С-связь, сопряженную с кольцом, распадаются легче алканов преимущественно по β-правилу. Основным направлением их превращения является крекинг алкильных цепей и деалкилирование по радикально-цепному механизму с участием алкильных радикалов. Незамещенные (голоядерные) и метилзамещенные арены значительно более термоустойчивы, чем алканы. При термолизе они преимущественно подвергаются дегидроконденсации. Бензол конденсируется по цепному механизму по следующей схеме: 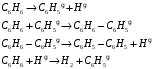 Аналогично происходит дегидроконденсация нафталина: 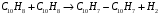 В результате конденсации бензола и нафталина образуются дифенил, динафтил, а также более высококонденсированные арены. Ароматические углеводороды накапливаются в жидких продуктах термолиза тем в больших количествах, чем выше температура процесса. При пиролизе они являются главной составной частью так называемой смолы пиролиза. Цепные реакции, протекающие при термолизе углеводородов всегда взаимозаменяемы. Инициирование в радикально-цепных процессах термолиза является самой энергоемкой и, следовательно, лимитирующей стадией. Дальнейшие превращения радикалов происходят значительно меньшими энергиями активации. Термическое разложение смеси углеводородов по сравнению с индивидуальными углеводородами, во многих случаях протекает с большей скоростью вследствие увеличения скорости инициирования активными радикалами, которые не всегда могут образоваться при распаде отдельных классов углеводородов. Отдельные углеводороды, например, нафтены, распадающиеся в чистом виде по не цепному пути из-за малой скорости инициирования, в смесях могут превращаться по цепному механизму. В качестве инициаторов цепных реакций могут участвовать и отдельные продукты, образующиеся при термолизе углеводородных смесей. Таким образом можно сформулировать основные выводы о термическом распаде различных классов углеводородов: Алканы подвергаются реакциям распада на предельные и непредельные углеводороды. Молекулярная масса полученных углеводородов постоянно снижается за счет последовательного крекинга. Алкены полимеризуются и вступают в реакцию деструктивной полимеризации. В меньшей степени выражена реакция деполимеризации. Возможна также реакция циклизации. Цикланы и арены претерпевают реакции деалкилирования алкильных цепей, образуя алканы, алкены и цикланы с короткой боковой цепью. Шестичленные цикланы дегидрируются в арены, а последние подвергаются поликонденсации, образуя высокомолекулярные жидкие продукты. Следовательно, при термолизе нефтяного сырья протекает множество консекутивных реакций, в результате которых образуется многокомпонентная реакционная смесь. Ввиду этого проследить ход превращений индивидуального компонента смеси невозможно. Однако, зная средний состав сырья, можно приблизительно прогнозировать групповой (не индивидуальный) состав конечных продуктов термолиза [3]. Термодинамический анализ основной реакции Термодинамический анализ процесса крекинга произведем на примере модельных реакций:  (1) (1) (2) (2)Для нахождения величин 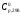 , , 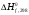 , , 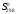 для тетракозана, изо-октана и изо-гексадекана; 2-пропил-9,10-дигидроантроцена, стирола и 1-пропил-4-этибензола воспользуемся методами групповых вкладов Домальского-Ружечка и Домальского-Херинга [15]. для тетракозана, изо-октана и изо-гексадекана; 2-пропил-9,10-дигидроантроцена, стирола и 1-пропил-4-этибензола воспользуемся методами групповых вкладов Домальского-Ружечка и Домальского-Херинга [15]. Для расчета теплоемкости по методу Ружичка-Домальского используем формулу: 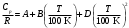 (3) (3)где 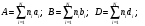 R- газовая постоянная; T – температура; ni - количество групповых вкладов; ai, bi, di - вклады отдельных групп (таблица 1-6). R- газовая постоянная; T – температура; ni - количество групповых вкладов; ai, bi, di - вклады отдельных групп (таблица 1-6).Таблица 2 – Вклады соответствующих групп для тетракозана (А).
| ||||||||||||||||||||||||
