Вопросы к экзамену по микробиологии. Медицинская микробиология. Предмет, задачи, методы, связь с другими науками
 Скачать 1.02 Mb. Скачать 1.02 Mb.
|
|
Для инактивации микроорганизмов при приготовлении диагностикумов чаще всего используются химические вещест ва, особенно формалин, являющийся лучшим консервантом. Убитые нагреванием микробы хуже сохраняют антигенные свойства и применяются редко. Бактериальные диагностикумы могут содержать инактивированную микробную взвесь или отдельные антигенные компоненты бактерий: О, Н или Vi-антигены и используются в реакциях агглютинации. Эритроцитарные диагностикумы представляют собой эритроциты (обработанные танином или формалином) с ад сорбированными на них антигенами, извлеченными из бакте рий, и применяются в РПГА. Вирусные диагностикумы — препараты, содержащие инактированные вируссодержащие жидкости (культуральные, из куриных эмбрионов или организма животных, зараженных соответствующим вирусом), применяются в РСК, РТГА и РН. Аллергены — диагностические препараты, предназначенные для выявления специфической сенсибилизации организма. Это очищенные фильтраты бульонных куль тур, реже взвеси убитых микроорганизмов или АГ, выделенные из них. Кожные пробы. Инфекционные аллергены (в/к, н/к) вводят, как правило, внутрикожно или накожно, путем втирания в скарифицированные участки кожи. При внутрикожном способе в среднюю треть передней поверхно сти предплечья специальной тонкой иглой вводят 0,1 мл аллерге на. Через 28 — 48 ч оценивают результаты реакции ГЗТ, определяя на месте введения размеры папулы. Неинфекционные аллергены(прик-тест, н/к, в/к) (пыльца растений, бытовая пыль, пищевые продукты, лекарственные и химические препараты) вводят в кожу уколом (прик-тест), накожно путем скарификации и втирания или внутрикожной инъекцией разведенного раствора аллергена. Результаты учи тывают в течение 20 мин (ГНТ) по величине папулы (иногда до 20 мм в диаметре), наличию отека и зуда. Внутрикожные пробы ставят в случае отрицательного или сомнительного результата прик-теста. По сравнению с последним, дозу аллергена уменьшают в 100-5000 раз. Кожные пробы на наличие ГЗТ широко применяют для выяв ления инфицированности людей микобактериями туберкулеза (проба Манту), возбудителями бруцеллеза (проба Бюрне), лепры (реакция Митсуды), туляремии, сапа, актиномикоза, и др. Токсины, вещества бактериального происхождения, способные угнетать физиологические функции, что приводит к заболеванию или гибели животных и человека. В отличие от других органических и неорганических ядовитых веществ, токсины при попадании в организм вызывают образование антител. При некоторых инфекционных заболеваниях (дифтерия, скарлатина) для определения напряженности иммунитета и восприимчивости детей используются в/к пробы с применением соответствующих разведенных токсинов. Положительная реакция (местное воспаление кожи в области введения токсина) обусловливается ядовитым действием токсина на ткани кожи. Отрицательный результат реакции объясняется нейтрализацией введенного в кожу токсина соответствующим антитоксином, содержащимся в иммунном организме в достаточном для этого количестве. Получают из токсигенных штаммов микробов (дифтерийная палочка или скарлатинозный стрептококк) методом посева на жидкую питательную среду (мартеновский бульон) с последующей фильтрацией через бактериальные фильтры. Из полученных токсинов готовят диагностические токсины Шика (дифтерийный) и Дика (скарлатинный)., в среднюю часть внутренней поверхности предплечья. 64. Иммунные сыворотки. Современная классификация сывороток. Получение , очистка, применение. Требования, предъявляемые к сывороточным препаратам. 66. Антительные препараты – сыворотки, применяемые для диагностики инфекционных заболеваний. Способы получения. Применение. Сыворотки иммунные диагностические - иммунные с-ки, содержащие Ат против одного (моновалентные, моноспецифические) или нескольких (поливалентные, полиспецифические) Аг. Получают путем иммунизации животных (кроликов и др.) известными полноценными Аг. По достижении необходимого титра животных обескровливают, получают с-ку, в случае необходимости адсорбируют групповые Ат, определяют титр, стерилизуют, контролируют. Для идентификации микробов широкое распространение получили агглютинирующие сыворотки.. Наиболее широкое применение получили агглютинирующие сыворотки против возбудителей кишечных инфекций (сальмонеллезные, дизентерийные), используются агглютинирующие сыворотки для идентификации дифтерийных микробов, бруцелл, лептоспир и др. Применение агглютинирующих сывороток основано на способности многих микробов вступать в реакцию агглютинации с соответствующими им антителами. Явление агглютинации, т. е. склеивание бактерий, впервые было отмечено в 1889 г. A. Charrin и G. Roger при действии иммунной сыворотки на синегнойную палочку. Наблюдения их были подтверждены и расширены И. И. Мечниковым (1891), который показал в опытах на синегнойной палочке, пневмококке и вибрионе Мечникова, что явление склеивания закономерно имеет место при взаимодействии бактерий с соответствующими им иммунными сыворотками. Диагностические иммунные сыворотки применяют в различных иммунологических реакциях для установления вида, подвида или серотипа (серовара) возбудителя инфекционной болезни, определения различных антигенов в биологических материалах. В зависимости от характера иммунологических реакций различают агглютинирующие, преципитирующие, флюоресцирующие, гемолитические, меченные радиоактивными нуклидами, ферментами и другие диагностические сыворотки. В клинической практике широко применяют диагностические сыворотки для определения группы крови, проведения тканевого типирования, при аллогенных трансплантациях и переливаниях крови, для характеристики иммунологического статуса организма (определения классов иммуноглобулинов и др.). 67. Понятие об иммуномодуляторах. Принцип действия. Применение. Иммуномодуляторы – вещества, оказывающие влияние на функцию иммунной системы, изменяющие активность иммунной системы в сторону повешения (иммуностимуляторы) или понижения (иммунодепрессанты) её активности. К экзогенным иммуномодуляторам отно сится большая группа веществ различной хи мической природы и происхождения, оказы вающих неспецифическое активирующее или супрессивное действие на иммунную систему, но являющихся чужеродными для организма. Антибиотики, левамизол, полисахариды, ЛПС, адъюванты. Эндогенные иммуномодуляторы представляют собой достаточно большую группу олигопептидов, синтезируемых самим организмом, его иммунокомпетентными клетка ми, и способных активировать иммунную сис тему путем усиления функции иммунокомпетентных клеток. К ним относятся регуляторные пептиды: интерлейкины, интерфероны, гормоны тимуса. Применение иммуномодуляторов: при первичных и вторичных иммунодефицитах различного происхождения, при онкологических болезнях, при транспланта ции органов и тканей, при лечении иммуно патологических и аллергических болезней, в иммунопрофилактике и лечении инфек ционных болезней. Созданы препараты, обладающие иммуномодулирующим действием: интерферон, лейкоферон, виферон. 69. Химиотерапевтические препараты. Понятие о химиотерапевтическом индексе. Основные группы химиотерапевтических препаратов, механизм их антибактериального действия. Химиотерапия — специфическое антимикробное, антипаразитар ное лечение при помощи химических веществ. Эти вещества обла дают важнейшим свойством — избирательностью действия против болезнетворных микроорганизмов в условиях макроорганизма. Основоположником химиотерапии является П. Эрлих, который установил, что химические вещества, содержащие мышьяк, губительно действуют на спирохеты и трипаносомы, и получил в 1910 г. первый химиотерапевтический препарат — сальварсан (соединение мы шьяка, убивающее возбудителя, но безвредное для макроорга низма). См. учебник 70. Антибиотики. Классификация антибиотиков по источникам получения и спектру действия. Механизм действия антибиотиков. Антибиотики — химиотерапевтические вещества, продуцируемые микроорганизмами, животными клетками, растениями, а также их производные и синтетические продукты, которые обладают избирательной спо собностью угнетать и задерживать рост микроорганизмов, а также подавлять развитие злокачественных новообразований. Источники антибиотиков. Таким образом, основными источниками получения природных и полусинтетических антибиотиков стали: • Актиномицеты(особенно стрептомицеты) — ветвящиеся бактерии. Они синтезиру ют большинство природных антибиотиков (80 %). • Плесневые грибы— синтезируют природ ные бета-лактамы (грибы рода Cephalosporium и Penicillium) ифузидиевую кислоту. • Типичные бактерии— например, эубактерии, бациллы, псевдомонады — продуцируют бацитрацин, полимиксины и другие вещества, обладающие антибактериальным действием. Способы получения. Существует три основных способа получе ния антибиотиков: • биологическийсинтез (при родные антибиотики — натуральные продук ты ферментации, когда в оптимальных ус ловиях культивируют микробы-продуценты, которые выделяют антибиотики в процессе своей жизнедеятельности); • биосинтезс последующими химическими модификациями(так создают полусинтетичес кие антибиотики). Сначала путем биосинтеза получают природный антибиотик, а затем его первоначальную молекулу видоизменяют путем химических модификаций, например, присо единяют определенные радикалы, в результате чего улучшаются противомикробные и фармакологические характеристики препарата; • химическийсинтез (так получают синте тические аналоги природных антибиотиков, например левомицетин). Это вещества, которые имеют такую же структуру. В основу главной классификации антибиотиков положено их химическое строение. Наиболее важными классами синтетических антибиотиков яв ляются хинолоны и фторхинолоны (например, ципрофлоксацин), сульфаниламиды (сульфадиметоксин), имидазолы (метронидазол), нитрофураны (фурадонин, фурагин). По спектру действия антибиотики делят на пять групп в зави симости от того, на какие микроорганизмы они оказывают воз действие. Кроме того, существуют противоопухолевые антибио тики, продуцентами которых также являются актиномицеты. Каж дая из этих групп включает две подгруппы: антибиотики широ кого и узкого спектра действия. Антибактериальные антибиотики составляют самую многочисленную группу препаратов. Преобладают в ней антиби отики широкого спектра действия, оказывающие влияние на представителей всех трех отделов бактерий. К антибиотикам широкого спектра действия относятся аминогликозиды, тетрациклины и др. Антибиотики узкого спектра действия эффектив ны в отношении небольшого круга бактерий, например полимиксины действуют на грациликутные, ванкомицин влияет на грамположительные бактерии. В отдельные группы выделяют противотуберкулезные, противолепрозные, противосифилитические препараты. Противогрибковые антибиотики включают значитель но меньшее число препаратов. Широким спектром действия об ладает, например, амфотерицин В, эффективный при кандидозах, бластомикозах, аспергиллезах; в то же время нистатин, дей ствующий на грибы рода Candida, является антибиотиком узко го спектра действия. Антипротозойные и антивирусные антибиотики на считывают небольшое число препаратов. Противоопухолевые антибиотики представлены препара тами, обладающими цитотоксическим действием. Большинство из них применяют при многих видах опухолей, например митомицин С. Действие антибиотиков на микроорганизмы связано с их спо собностью подавлять те или иные биохимические реакции, про исходящие в микробной клетке. В зависимости от механизма дей ствия различают пять групп антибиотиков: 1. антибиотики, нарушающие синтез клеточной стенки. К этой группе относятся, например, β-лактамы. В связи с этим β-лактамные антибиотики являются наименее токсичными для макроорганизма; 2. антибиотики, нарушающие молекулярную организацию и синтез клеточных мембран. Примерами подоб ных препаратов являются полимиксины, полиены; 3. антибиотики, нарушающие синтез белка; это наиболее многочисленная группа препаратов. Представителями этой группы являются аминогликозиды, тетрациклины, макролиды, левомицетин, вызывающие нарушение синтеза белка на разных уровнях; 4. антибиотики — ингибиторы синтеза нуклеиновых кислот. Например, хинолоны нарушают синтез ДНК, рифампицин — синтез РНК; 5. антибиотики, подавляющие синтез пуринов и аминокислот. К этой группе относятся, например, сульфаниламиды. 71. Методы определения чувствительности к антибиотикам Методы определения чувствительности бактерий к антибиотикам делятся на 2 группы: диффузионные и методы разведения. Определение чувствительности бактерий к антибиотикам: диффузионные методы с использованием дисков с антибиотиками с помощью Е-тестов методы разведения разведение в жидкой питательной среде (бульоне) разведение в агаре При определении чувствительности диско-диффузионным методом на поверхность агара в чашке Петри наносят бактериальную суспензию определенной плотности (обычно эквивалентную стандарту мутности 0,5 по McFarland) и затем помещают диски, содержащие определенное количество антибиотика. Диффузия антибиотика в агар приводит к формированию зоны подавления роста микроорганизмов вокруг дисков. После инкубации чашек в термостате при температуре 35о-37оС в течение ночи учитывают результат путем измерения диаметра зоны вокруг диска в миллиметрах (рис. 1). 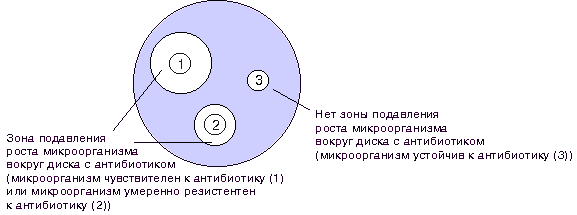 Рисунок 1. Определение чувствительности микроорганизмов диско-диффузионным методом. Определение чувствительности микроорганизма с помощью Е-теста проводится аналогично тестированию диско-диффузионным методом. Отличие состоит в том, что вместо диска с антибиотиком используют полоску Е-теста, содержащую градиент концентраций антибиотика от максимальной к минимальной (рис. 2). В месте пересечения эллипсовидной зоны подавления роста с полоской Е-теста получают значение минимальной подавляющей концентрации (МПК). 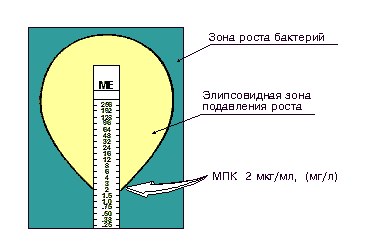 Рисунок 2. Определение чувствительности микроорганизмов с помощью Е-тестов. Несомненным достоинством диффузионных методов является простота тестирования и доступность выполнения в любой бактериологической лаборатории. Однако с учетом высокой стоимости Е-тестов для рутинной работы обычно используют диско-диффузионный метод. Методы разведения основаны на использовании двойных последовательных разведений концентраций антибиотика от максимальной к минимальной (например от 128 мкг/мл, 64 мкг/мл, и т.д. до 0,5 мкг/мл, 0,25 мкг/мл и 0,125 мкг/мл). При этом антибиотик в различных концентрациях вносят в жидкую питательную среду (бульон) или в агар. Затем бактериальную суспензию определенной плотности, соответствующую стандарту мутности 0,5 по MсFarland, помещают в бульон с антибиотиком или на поверхность агара в чашке. После инкубации в течение ночи при температуре 35о-37оС проводят учет полученных результатов. Наличие роста микроорганизма в бульоне (помутнение бульона) или на поверхности агара свидетельствует о том, что данная концентрация антибиотика недостаточна, чтобы подавить его жизнеспособность. По мере увеличения концентрации антибиотика рост микроорганизма ухудшается. Первую наименьшую концентрацию антибиотика (из серии последовательных разведений), где визуально не определяется бактериальный рост принято считать минимальной подавляющей концентрацией (МПК). Измеряется МПК в мг/л или мкг/мл (рис. 3).
 Рисунок 3. Определение значения МПК методом разведения в жидкой питательной среде. 71. Принципы рациональной антибиотикотерапии. Профилактика развития осложнений состоит, прежде всего, в соблюдении принципов рациональной антибиотикотерапии (антимик робной химиотерапии): • Микробиологический принцип. До назна чения препарата следует установить возбу дителя инфекции и определить его индиви дуальную чувствительность к антимикроб ным химиотерапевтическим препаратам. По результатам антибиотикограммы больному назначают препарат узкого спектра дейс твия, обладающий наиболее выраженной активностью в отношении конкретного воз будителя, в дозе, в 2—3 раза превышающей минимальную ингибирующую концентра цию. Если возбудитель пока неизвестен, то обычно назначают препараты более широ кого спектра, активные в отношении всех возможных микробов, наиболее часто вы зывающих данную патологию. Коррекцию лечения проводят с учетом результатов бактериологического исследования и опреде ления индивидуальной чувствительности конкретного возбудителя (обычно через 2-3 дня). Начинать лечение инфекции нужно как можно раньше (во-первых, в начале за болевания микробов в организме меньше, во-вторых, препараты активнее действуют на растущих и размножающихся микробов). • Фармакологический принцип. Учитывают особенности препарата — его фармакокинетику и фармакодинамику, распределение в организме, кратность введения, возможность сочетания препаратов и т. п. Дозы препаратов должны быть достаточными для того, чтобы обеспечить в биологических жидкостях и тка нях микробостатические или микробоцидные концентрации. Необходимо представлять оп тимальную продолжительность лечения, так как клиническое улучшение не является основанием для отмены препарата, потому что в организме могут сохраняться возбудители и может быть рецидив болезни. Учитывают также оптимальные пути введения препарата, так как многие антибиотики плохо всасываются из ЖКТ или не проникают через гематоэнцефалический барьер. • Клинический принцип. При назначении пре парата учитывают, насколько безопасным он бу дет для данного пациента, что зависит от ин дивидуальных особенностей состояния больного (тяжесть инфекции, иммунный статус, пол, на личие беременности, возраст, состояние функции печени и почек, сопутствующие заболевания и т.п.) При тяжелых, угрожающих жизни инфекциях особое значение имеет своевременная антибиотикотерапия. Таким пациентам назначают комбинации из двух-трех препаратов, чтобы обес печить максимально широкий спектр действия. При назначении комбинации из нескольких пре паратов следует знать, насколько эффективным против возбудителя и безопасным для пациента будет сочетание данных препаратов, т. е. чтобы не было антагонизма лекарственных средств в отно шении антибактериальной активности и не было суммирования их токсических эффектов. • Эпидемиологический принцип. Выбор пре парата, особенно для стационарного больно го, должен учитывать состояние резистент ности микробных штаммов, циркулирующих в данном отделении, стационаре и даже ре гионе. Следует помнить, что антибиотикорезистентность может не только приобретаться, но и теряться, при этом восстанавливается природная чувствительность микроорганизма к препарату. Не изменяется только природная устойчивость. • Фармацевтический принцип. Необходимо учитывать срок годности и соблюдать правила хранения препарата, так как при нарушении этих правил антибиотик может не только по терять свою активность, но и стать токсич ным за счет деградации. Немаловажна также и стоимость препарата. 71. Лекарственная устойчивость микроорганизмов и механизм ее возникновения. Понятие о госпитальных штаммах микроорганизмов. Пути преодоления лекарственной устойчивости. Антибиотикорезистентность — это устойчи вость микробов к антимикробным химиопрепаратам. Бактерии следует считать резистент ными, если они не обезвреживаются такими концентрациями препарата, которые реально создаются в макроорганизме. Резистентность может быть природной и приобретенной. |
