Хирургические методы лечения заболеваний пародонта (2006). Медицинское информационное агентство
 Скачать 1.94 Mb. Скачать 1.94 Mb.
|
|
Преимущества методики определяются возможностью максимально тщательной обработки альвеолярного отростка, внутрикостных карманов. Главным же недостатком является то, что утраченная кость либо вообще не восстанавливается, либо восстанавливается за счет того, что устранение воспаления нормализует функцию остеобластов. Поэтому обычно нарушаются контуры межзубных сосочков (так называемые «черные треугольники»), что для ряда пациентов оказывается неприемлемым, особенно — на фронтальных участках. Обнажения корней после заживления практически никогда не удается избежать, отсюда — проблема их повышенной чувствительности. Техника операции. После анестезии (рис. 26) по границам участка вмешательства скальпелем проводят два вертикальных разреза от края десны до переходной складки. Эти разрезы соединяют околобороздковыми горизонтальными разрезами со щечной и язычной сторон, отступив 1,0-1,5 мм от края десны (рис. 27). 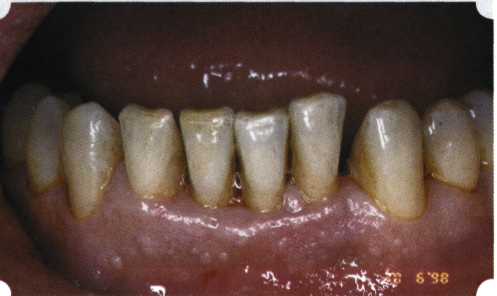 Рис. 26. Состояние в области 43-33 Вестибулярный и язычный лоскуты отслаивают и отводят в стороны (рис. 28). Удаляют остатки грануляций со стенки ПК (рис. 29), снимают отложения и сглаживают поверхность обнаженных корней (рис. 30). Проводят биомодификацию корней (рис. 31). 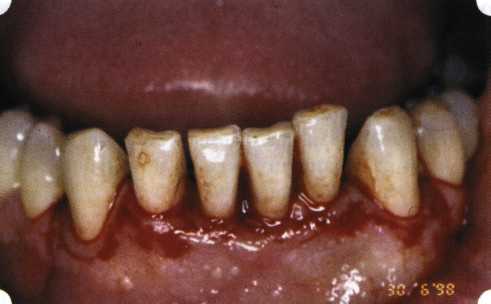 Рис. 27. Два вертикальных разреза соединены околобороздковым разрезом 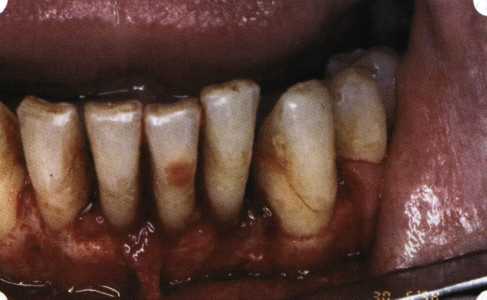 Рис. 28. Отслаивание первичного слизисто-надкостничного лоскута Чтобы максимально адаптировать лоскут, иногда необходимо моделировать рельеф внешней поверхности кости альвеолярного гребня, т. е. провести остеопластику. Этим достигается максимальная возможность обеспечения заживления первичным натяжением. 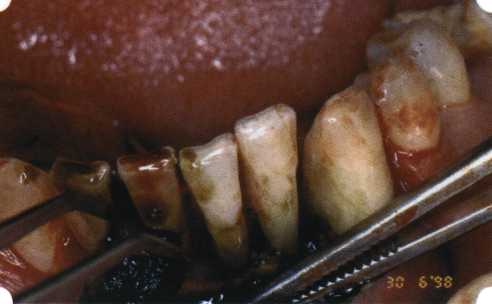 Рис. 31. Биомодификация (кондиционирование) корневых поверхностей 18%-й лимонной кислотой 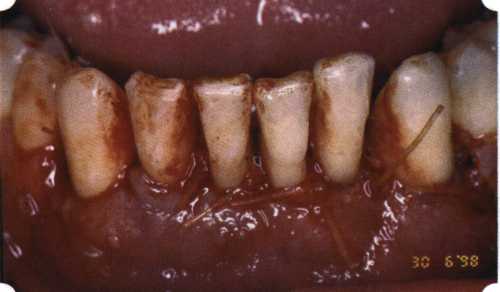 Рис. 32. Наложение узловых швов Модификации лоскутных операций многочисленны, и все они направлены на повышение эффекта за счет сведения до минимума недостатков, присущих известным вмешательствам. Самым типичным их недостатком является послеоперационная ретракция тканей (рис. 36, 37). Рис. 33. 30-е сутки после операции 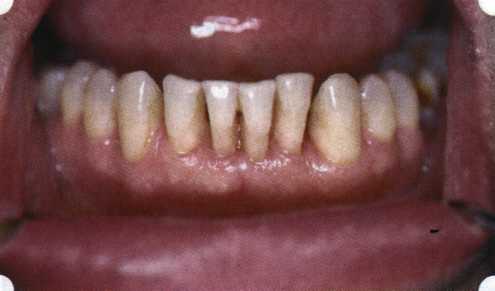 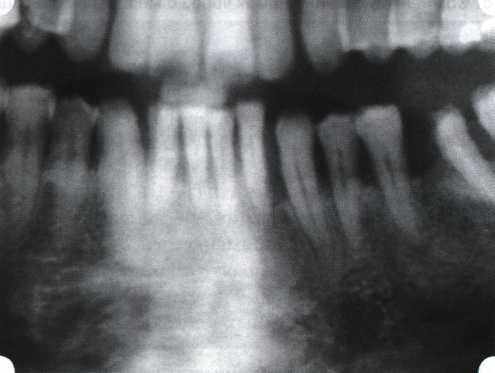 Рис. 34. Рентгеновский снимок до операции В связи с этим логично применение остеопластиче-ских подсадок в сочетании с техникой направленной регенерации тканей — для воздействия на механизмы тканевой репарации и регенерации. Рис. 35. Рентгеновский снимок через 6 мес. после операции 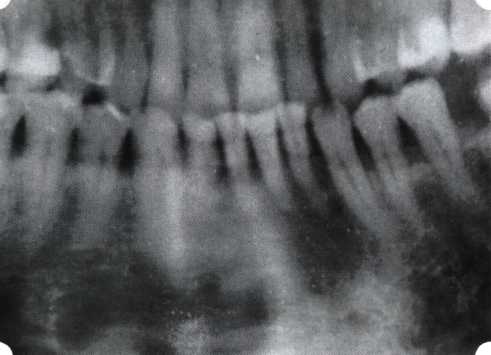 Среди множества остеопластических материалов предпочтительными, согласно имеющемуся у нас опыту, являются два класса остеопластиков, а именно: препараты синтетического гидроксиапатита (ГА), в том числе колла-генсодержащие, и натуральный ГА — депротеинизирован-ная кость. ГА — широко применяемый в хирургической практике материал. Известно, что он образует достаточно прочную химическую связь с костью (bone-bonding) за счет активизации остеогенных клеток, в частности остеобластов. Искусственный ГА практически безупречен, так как его негативные свойства минимальны. Комбинация ГА с коллагеном позволяет восполнить дефицит не только минерального вещества в костном дефекте, но и коллагена. Консистенция материала дает возможность использовать его дополнительно в качестве пролонгированного носителя антибактериальных препаратов, подложки для клеточных культур, применяемых с целью тканевого стро-  Рис. 36. В ходе лоскутной операции во фронтальном отделе верхней челюсти выявлен горизонтальный костный дефект  Рис. 37. Послеоперационная ретракция десны на 14-е сутки после вмешательства. Зубы зашинированы ительства. Еще одним плюсом этой группы материалов является их невысокая стоимость. В отделении пародонтологии ЦНИИС была изучена цитотоксичность 11 остеопластических препаратов отечественного производства по отношению к клеточной культуре человеческих фибробластов М-22. Изучались материалы фирм «Полистом» и «Интермедапатит»: Гапкол. Гапкол-Л. Гапкол-ЛМ. Колапол КП-2. Колапол КП-2Л. Гидроксиапол ГАП-85д. КоллапАн-Г. КоллапАн-Д. КоллапАн-К. КоллапАн-Л. КоллапАн-М. Эксперименты проводили на базе Института полиомиелита и вирусного энцефалита им. М. П. Чумакова РАМН под руководством проф. Л. Л. Мироновой. Суть эксперимента состояла в том, что каждый из испытуемых материалов помещали в стерильную емкость (рис. 38), затем туда вносили суспензию диплоидных клеток человека, Рис. 38. Изучение воздействия остеопластических материалов на культуру человеческих эмбриональных фибробластов М-22  а о действии испытуемых образцов материалов на фибробласты судили по динамике формирования монослоя фибробластов (рис. 39), количеству клеточных элементов в популяции растущей культуры, развитию дегенеративных изменений в клетках и возможности проведения последующих пассажей. Оказалось, что через рис 39. Вид монослоя фибро-4 сут тонкий монослои был бластов под микроскопом (х40) сформирован только с КоллапАн-Г и -М (рис. 40). В остальных пробирках образовалась лишь сеть фибробластов разной плотности, что свидетельствовало о цитоток-сичности изучаемых материалов в отношении культуры фибробластов. На этом основании и определена возможность применения КоллапАн-Г и -М в качестве носителя клеточной культуры, содержащей щелочной фактор роста фибробластов, стимулирующий остеоре-генерацию (рис. 41). При рассмотрении второго класса используемых нами остеопла-стических материалов, а именно натуральных ГА, безальтернативным материалом оказывается Bio-Oss spongiosa фирмы Ge- istlich, а также мембрана HPT Bio-Gide, наиболее Рис. 40. Пакет с КоллапАн-Г приспособленная для со-  Рис. 41. Поверхность материала под электронным микроскопом вместного применения с этим остеопластическим материалом (рис. 42-44).  Рис. 42. Различные расфасовки Bio-Oss spongiosa по размеру частиц и объему материала Рис. 43. Структура Bio-Oss spongiosa под микроскопом   Рис. 44. Резорбируемая мембрана HPT Bio-Gide Принято, что принцип работы тканевых трансплантатов основан на остеокондукции или остеоиндукции. Остеокондукция — это свойство материала служить каркасом для вновь образующейся костной ткани [Reddiet et al, 1987]. Остеоиндукция — это способность материала трансформировать недифференцированные мезенхимальные клетки в остеобласты [Reddi, 1981; Reddi et al, 1987]. Мы придерживаемся того мнения, что все же проявляющаяся остеоиндукция оказывается не первичной, а вторичной — не более чем результат успешного противовоспалительного лечения в совокупности с лоскутной операцией, в силу чего использованный материал полностью выполняет свою кондуктивную функцию и обеспечивает возможность реализации регенеративного потенциала многочисленных зон роста, исходящих из длительно сохраняющихся сгустков собственной крови. В частности, это относится и к такому материалу, как Bio-Oss. Результаты, полученные [Schwarts Z., Weesner Т., 2000] при исследовании белковых фракций, оставшихся после деминерализации материала, обнаружили наличие в материале таких факторов роста, как bTGF и ВМР-2. На этом основании авторы предложили рассматривать его как остеоиндуктор. Мы все же не склонны разделять это мнение: хотя бы потому, что факторы роста имеют многочисленные источники, они в обязательном порядке находятся в составе кровяного сгустка и при желании всегда могут быть там обнаружены. Препарат Bio-Oss является неорганической матрицей из бычьей кости, из которой удалены практически все органические компоненты. Его система взаимосвязанных макро- и микропор формирует структуру, напоминающую губчатое вещество кости. Это способствует реваску-ляризации материала: через 6 мес. в микропространствах определяются мелкие капилляры, мезенхимальные клетки. Остеобласты проникают в гаверсовы каналы и через 18 мес. заполняют их костью (рис. 45). Костеобразование начинается на его поверхности и приводит к включению материала в плотную костную ткань. После завершения формирования кости Bio-Oss подвергается медленной резорбции, которая может длиться от 20 [Wallace S. S., Fro-um S. J., 1996] до 44 мес. [Avera S. P., 1997]. Прежде чем перейти к реконструктивным вариантам хирургического лечения заболеваний пародонта, а именно 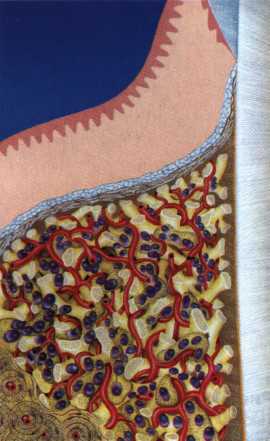  А Б Рис. 45. Преобразование Bio-Oss spongiosa в костную ткань реципиента: А — имплантация материала в костный дефект; Б — прорастание имплантированного материала кровеносными сосудами; В — замещение Bio-Oss spongiosa собственной костной тканью  В 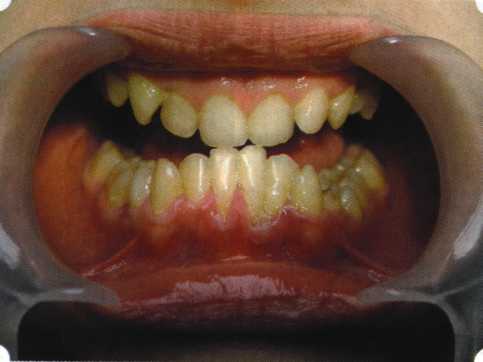 Рис. 46. Пациент с дефицитом жевательной нагрузки, скученностью зубов во фронтальном отделе обеих челюстей, множественными супраконтактами, недоразвитием вестибулярной костной пластинки (симптом «стиральной доски»), мелким преддверием полости рта 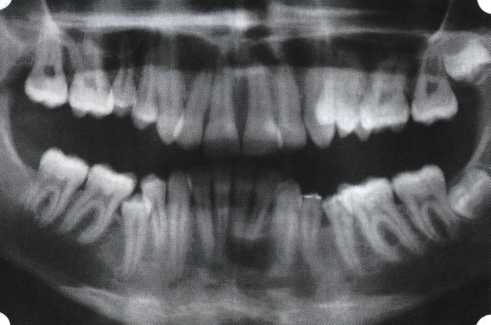 Рис. 47. Ортопантомограмма того же пациента. Отмечается тесное положение зубов, дистопированные и ретинированные 28 и 38 зубы 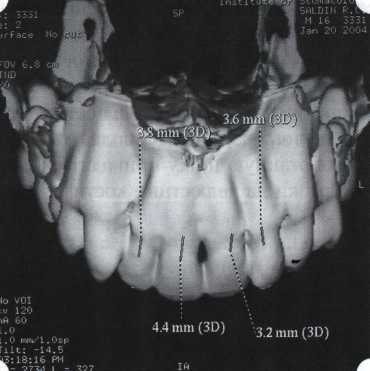 Рис. 48. Компьютерная томограмма верхней челюсти. При сохранении костного субстрата во фронтальном отделе отсутствует вестибулярная костная пластинка в жевательных отделах  Рис. 49. Компьютерная томограмма нижней челюсти. Отсутствует вестибулярная костная пластинка, визуализированы костные дефекты. HPT, хотелось бы обратить внимание на появившееся поколение пациентов с дефицитом жевательной нагрузки. Ни для кого не является секретом, что именно жевательная нагрузка в период сменного прикуса является фактором, стимулирующим ростковые зоны челюстей. Урбанизация, изменение пищевого рациона на более мягкую, технологически переработанную пищу приводят к значительному снижению нагрузки на челюстные кости, и следовательно, на уменьшение челюстных костей как в размерах, так и по соотношению таких составляющих, как компактная пластинка — губчатое вещество (в сторону уменьшения количества и качества компактной пластинки). Клинически такие пациенты имеют скученность зубов (в силу несоответствия размера челюстей и размера зубов). При недоразвитии вестибулярных замыкательных пластинок у них может отмечаться симптом «стиральной доски», когда корни зубов пальпируются через слизистую оболочку полости рта. При недоразвитии компактных пластинок с вестибулярных поверхностей челюстей зона прикрепленной кератинизированной десны, как правило, не выполняет своей функциональной роли. В таких случаях у одного и того же пациента налицо сразу несколько пародонто-патогенных этиологических факторов: скученность зубов, неудовлетворительная гигиена полости рта, множественные супраконтакты, мелкое преддверие полости рта, неадекватный костный субстрат челюстей (рис. 46-49). В 1989 г. на Международном конгрессе клинической па-родонтологии термином «направленная тканевая регенерация» было решено обозначать операцию, направленную на достижение регенерации с разобщением отдельных тканей. Одновременно было указано, что НРТ уже сама по себе является вполне обоснованной клинической методикой, эффективной в целях формирования нового соединительнотканного прикрепления при наличии не только внутрикостных дефектов, но, что самое главное, и дефектов с вовлечением фуркаций I и II класса. Основной принцип, на котором построена методика НРТ, — это использование клеточного фильтра (или мембраны), разобщающего различные клеточные популяции, которые заполняют костный пародонтальный дефект. Мембраны делятся на два основных класса по признаку резорбируемости — рассасывающиеся и нерассасываю-щиеся. Более подробное описание видов мембран будет представлено в отдельной главе. В представленном клиническом случае продемонстрировано устранение костного дефекта в области 26 зуба с помощью резорбируемой мембраны Bio-Gide (рис. 62-75).  Рис. 62. Клиническое состояние перед операцией  |
