Биологи. Мер по контролю за качеством выполнения лабораторного анализа на всех этапах его осуществления от периода подготовки пациентов к процедуре взятия крови до использования полученных результатов в клинике
 Скачать 157.03 Kb. Скачать 157.03 Kb.
|
4.3. Тромбиновое времяТромбиновое время (ТВ) – определение тромбинового времени является третьим по значимости базисным скрининговым тестом. Тест характеризует конечный этап процесса свертывания – превращение фибриногена в фибрин под действием тромбина, на него влияет концентрация фибриногена в плазме и наличие продуктов деградации фибрина. Референсные значения ТВ: 18-24 с УКОРОЧЕНИЕ ТВ:
УДЛИНЕНИЕ ТВ:
4.4. Концентрация фибриногена в плазмеКоличественное определение фибриногена по методу Клаусса является базисным тестом исследования гемостаза. Образование фибрина и его стабилизация представляют собой финальный этап формирования тромба, при котором растворимый фибриноген превращается в нерастворимый фибрин под действием тромбина и фактора XIII. Фибриноген – острофазный белок. Печень синтезирует 2–5 г фибриногена в день, время полувыведения фибриногена из крови составляет около 4 дней. Концентрация его может превышать 10 г/л при тяжелых бактериальных инфекциях, при травме и тромбозе. Повышение уровня фибриногена в острой фазе воспаления, как правило, имеет транзиторный характер. У курящих людей уровень фибриногена в плазме крови несколько выше, чем у некурящих. К значительному росту фибриногена приводят заболевания почек (пиелонефрит, гломерулонефрит, гемолитико-уремический синдром), коллагенозы (ревматоидный артрит, узелковый периартериит), пароксизмальная ночная гемоглобинурия, новообразования (рак легкого). При атеросклерозе наблюдается устойчивое увеличение уровня фибриногена, трудно корригируемое лекарственными препаратами. В результате риск сердечно-сосудистых заболеваний повышается с возрастанием исходного содержания фибриногена в интервале 3,0-4,5 г/л. Обнаружено, что повышение уровня фибриногена в плазме крови больных сердечно-сосудистыми заболеваниями предшествует развитию инфаркта миокарда и инсульта. Корреляция между уровнем фибриногена и развитием этих осложнений особенно четко прослеживается у пациентов молодого и среднего возраста. Определение уровня фибриногена – наиболее чувствительный тест для выявления бессимптомных стадий заболевания периферических артериальных сосудов. Референсные значения фибриногена: 2,75- 3,65 г/л СНИЖЕНИЕ КОНЦЕНТРАЦИИ ФИБРИНОГЕНА:
ПОВЫШЕНИЕ КОНЦЕНТРАЦИИ ФИБРИНОГЕНА:
3. Эритропоэз Образование эритроцитов, или эритропоэз, происходит в красном костном мозге. Эритроциты вместе с кроветворной тканью носят название «красного ростка крови», или эритрона. Для образования эритроцитов требуются железо и ряд витаминов. Железо организм получает из гемоглобина разрушающихся эритроцитов и с пищей. Трехвалентное железо пищи с помощью вещества, находящегося в слизистой кишечника, превращается в двухвалентное железо. С помощью белка трансферрина железо, всосавшись, транспортируется плазмой в костный мозг, где оно включается в молекулу гемоглобина. Избыток железа депонируется в печени в виде соединения с белком – ферритина или с белком и липоидом – гемосидерина. При недостатке железа развивается железодефицитная анемия. Для образования эритроцитов требуются витамин В12 (цианокобаламин) и фолиевая кислота. Витамин В12 поступает в организм с пищей и называется внешним фактором кроветворения. Для его всасывания необходимо вещество (гастромукопротеид), которое вырабатывается железами слизистой оболочки пилорического отдела желудка и носит название внутреннего фактора кроветворения Касла. При недостатке витамина В12 развивается В12-дефицитная анемия. Это может быть или при недостаточном его поступлении с пищей (печень, мясо, яйца, дрожжи, отруби), или при отсутствии внутреннего фактора (резекция нижней трети желудка). Считается, что витамин В12 способствует синтезу глобина. Витамин В12 и фолиевая кислота участвуют в синтезе ДНК в ядерных формах эритроцитов. Витамин В2 (рибофлавин) необходим для образования липидной стромы эритроцитов. Витамин В6 (пиридоксин) участвуете образовании гема. Витамин С стимулирует всасывание железа из кишечника, усиливает действие фолиевой кислоты. Витамин Е (а-токоферол) и витамин РР (пантотеновая кислота) укрепляют липидную оболочку эритроцитов, защищая их от гемолиза. Для нормального эритропоэза необходимы микроэлементы. Медь помогает всасыванию железа в кишечнике и способствует включению железа в структуру гема. Никель и кобальт участвуют в синтезе гемоглобина и гемсодержащих молекул, утилизирующих железо. В организме 75% цинка находится в эритроцитах в составе фермента карбоангидразы. Недостаток цинка вызывает лейкопению. Селен, взаимодействуя с витамином Е, защищает мембрану эритроцита от повреждения свободными радикалами. Физиологическими регуляторами эритропоэза являются эритропоэтины, образующиеся главным образом в почках, а также в печени, селезенке и в небольших количествах постоянно присутствующие в плазме крови здоровых людей. Эритропоэтины усиливают пролиферацию клеток-предшественников эритроидного ряда – КОЕ-Э (колониеобразующая единица эритроцитарная) и ускоряют синтез гемоглобина. Они стимулируют синтез информационной РНК, необходимой для образования энзимов, которые участвуют в формировании гема и глобина. Эритропоэтины увеличивают также кровоток в сосудах кроветворной ткани и увеличивают выход в кровь ретикулоцитов. Продукция эритропоэтинов стимулируется при гипоксии различного происхождения: пребывание человека в горах, кровопотеря, анемия, заболевания сердца и легких. Эритропоэз активируется мужскими половыми гормонами, что обусловливает большее содержание эритроцитов в крови у мужчин, чем у женщин. Стимуляторами эритропоэза являются соматотропный гормон, тироксин, катехоламины, интерлейкины. Торможение эритропоэза вызывают особые вещества – ингибиторы эритропоэза, образующиеся при увеличении массы циркулирующих эритроцитов, например у спустившихся с гор людей. Тормозят эритропоэз женские половые гормоны (эстрогены), кейлоны. Симпатическая нервная система активирует эритропоэз, парасимпатическая – тормозит. Нервные и эндокринные влияния на эритропоэз осуществляются, по-видимому, через эритропоэтины. Об интенсивности эритропоэза судят по числу ретикулоцитов – предшественников эритроцитов. В норме их количество составляет 1–2%. Созревшие эритроциты циркулируют в крови в течение 100–120 дней. Разрушение эритроцитов происходит в печени, селезенке, в костном мозге посредством клеток мононуклеарной фагоцитарной системы. Продукты распада эритроцитов также являются стимуляторами кроветворения. 4. Система групп крови ABO - это основная система групп крови, которая используется при переливании крови у людей. Ассоциированные анти-А и анти-В-антитела (иммуноглобулины), обычно относятся к типу IgM, которые, как правило, образуются в первые годы жизни в процессе сенситизации к веществам, которые находятся вокруг, в основном таких, как продукты питания, бактерии и вирусы. Система групп крови ABO также присутствует у некоторых животных, например, у обезьян (шимпанзе, бонобо и горилл). Локус_H_находится_на_19_хромосоме.'>АВО антигены Антиген H является важным предшественником антигенов системы групп крови АВО. Локус H находится на 19 хромосоме. Он состоит из 3 экзонов, которые охватывают более 5 Кб геномной ДНК и кодирует деятельность фермента фукозилтрансферазы, отвечающего за производство антигена Н на эритроцитах. Антиген Н - это углеводная последовательность в которой углеводы, в основном связаны с белком (незначительная их часть соединенная с функциональной группой церамидов). Антиген состоит из цепочки β-D-галактозы, β-DN-ацетилглюкозамина, β-D-галактозы и 2-связанных между собой молекул, α-L-фукозы, которые соединяются с молекулами белка или церамида. Локус ABO находится на 9 хромосоме. Он содержит 7 экзонов, которые охватывают более 18 Кб геномной ДНК. Экзон 7 - самый большой и содержит большую часть кодирующей последовательности. Локус АВО имеет три основные группы аллельных генов: A, B и О: -Алель А кодирует деятельность глюкозилтрансферазы, которая присоединяет α-N-ацетилгалактозамин к D-галактозе, содержащейся на конце Н антигена, образуя таким образом А антиген. - В аллель кодирует глюкозитрансферазу, которая присоеденяется к α-D-галактозе и связывается с D-галактозой антигена Н, таким образом образуя антиген В. - Относительно О аллели, стоит сказать, что в 6 экзоне есть определенные исключения (делеции), которые приводят к потере ферментативной активности. О аллель отличается от аллели А удалением только одного нуклеотида - гуанина на 261 позиции. Это приводит к смещению рамки считывания при трансляции, что в свою очередь приводит к образованию совершенно иного белка, в результате действия которого активность фермента снижается. То есть, при группе крови О, антиген Н остается неизменным. Большинство антигенов АВО находятся на концах длинных цепей полилактозамина, которые присоединены к белку полосы 3 (band 3 protein), который является белком анионообменной мембраны эритроцитов. Лишь незначительная часть эпитопов находится на нейтральных гликосфинголипидах. Серология Анти-А и анти-В антитела (которые еще называются изогемагглютинины), которых нет у новорожденных, появляются в первые годы жизни. Они являются изоантителами, то есть, образуются в организме человека и вступают в реакцию с антигенами того же вида (изоантигены). Анти-А и анти-В антитела класса М (IgM) обычно не поступают к плоду через плаценту, то есть не попадают в кровоток плода. В организме людей с О-группой могут образовываться антитела АВО класса G (IgG). Открытие АВО-системы групп крови принадлежит К. Ландштейнеру (1901). В рамках этой системы различают 4 фенотипа: А, В, АВ и 0, каждый из которых отличается по строению антигенов на поверхности эритроцитов и антител плазмы крови. Изучением характера наследования различных групп крови АВО-системы установлено, что они определяются разным сочетанием трех аллелей одного алеломорфної группы генов, которые обозначаются как JA, β и И' и расположены в девятой паре хромосом. Аллель JA определяет образование антигена А на поверхности эритроцитов и агглютинину β в плазме крови, аллель JB - образование антигена В на эритроцитах и агглютинину α в плазме и, в конце концов, за аллеля Jотсутствуют антигены А, В на поверхности эритроцитов и агглютининов α и β в плазме. Аллельные гены обозначаются различными буквами латинского алфавита (JA, f, J°), как исключение из правил генетики. Генетические исследования показали, что в этой системе существуют следующие соотношения между генотипоми его фенотипним проявлением: генотипы JAJA и JAJ0 дают одинаковый фенотип А с антигеном А и аглютиніном β; генотипы JBJB и JBJ° предопределяют одинаковый фенотип В с антигеном В и аглютиніном α; генотип JAJBопределяет фенотип АВ с антигенами А и В, но без агглютининов α и β; генотип J°J° предопределяет фенотип 0 без антигенов А и В, но с аглютининами α и β. 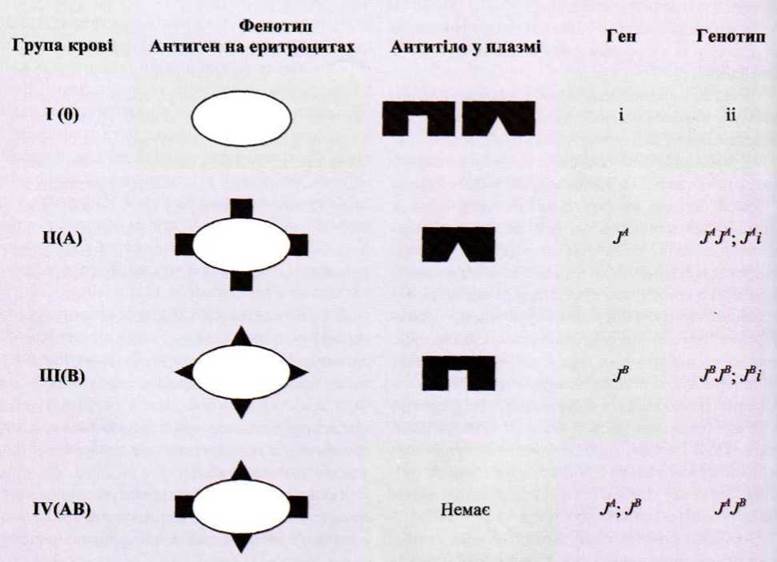 5. Паразитологическая диагностика малярии основана на обнаружении бесполых и половых форм возбудителя при микроскопическом исследовании крови, что возможно только в период его развития в эритроците. Для обнаружения плазмодиев и определения их вида используют препараты крови, приготовленные методом "тонкого мазка" и "толстой капли", окрашенные по Романовскому-Гимза. Оба метода, имеющие свои преимущества и недостатки, являются взаимодополняющими. Основной метод - "толстая капля". Благодаря распределению относительно большего объема крови на меньшей площади, за один и тот же промежуток времени просматривается количество крови в 30-40 раз большее, чем в "тонком мазке", что значительно повышает шанс обнаружения паразитов, особенно при низкой паразитемии. Начинать надо всегда с просмотра "толстой капли". Чувствительность метода "толстой капли" такова, что при просмотре 100-150 полей зрения можно обнаружить около 8 паразитов в 1 мкл крови. Концентрация исследуемой крови на ограниченной площади приводит к многослойному расположению эритроцитов. Для того чтобы паразиты были видимы, "толстую каплю" окрашивают нефиксированной; это приводит к гемолизу эритроцитов, и паразиты подвергаются деформации. Несмотря на определенную специфичность, такая деформация иногда может препятствовать идентификации вида паразита. Ограничиться просмотром "толстой капли" можно только, если вид паразита был первоначально установлен. "Толстая капля" относительно быстро позволяет выявить и других паразитов крови: трипаносом, микрофилярий, спирохет, бабезий и др. Отрицательный паразитологический результат изучения "толстой капли", но повышенное содержание остатков незрелых эритроцитов позволяет предположить перенесенную недавно малярию (при отсутствии соответствующих анамнестических данных), обнаружение повышенного содержания лейкоцитов, их видовой состав, а также повышенное содержание остатков незрелых эритроцитов, позволяют предположить иное заболевание, не связанное с малярией. В "тонком мазке", фиксированном до окраски, сохраняются морфологические особенности как пораженного эритроцита, так и присущие данному виду паразита. Большое значение для дифференциального диагноза имеет характер изменения пораженных эритроцитов. "Тонкий мазок" крови делают в дополнение к "толстой капле". В тех случаях, когда вид возбудителя в очаге установлен, для эпиднадзора за очагом можно ограничиться методом "толстой капли". |
