Методические разработки для практических занятий по биотехнологии лекарственных средств
 Скачать 1.17 Mb. Скачать 1.17 Mb.
|
|
Учебно-методические разработки для практических занятий по биотехнологии лекарственных средств./ Под ред. В.А. Быкова. - М.: ММА им. И.М.Сеченова, 1993. - 176 с. 2. Биотехнология: Учебное пособие для ВУЗов. В 8 кн./Под ред. Н.С. Егорова, В.Д. Самуилова. - М.: Высшая школа, 1987. 3. Блинов Н.П. Основы биотехнологии. Издательская фирма "Наука", СПБ, 1995.-600 с. 4. Краткий терминологический словарь микробиолога-биотехнолога. -М.: Наука, 1989. - 136 с. 5. Биотехнология лекарственных средств. Учебное пособие./Под ред. В.А. Быкова и М.В. Далина. — М.: Медбиоэкономика, 1991. - 303 с. 6. Основы биотехнологии: Учебное пособие для высших пед.учеб.заведений /Т.А.Егорова, С.М.Клунова, Е.А.Живухина. – М.: Издательский центр «Академия», 2003. – 208 с. Вариант 21 Задание 1. Приведите схему получения экзогенного человеческого интерферона. Опишите ее. экзогенный человеческий интерферон получают, используя технологию рекомбинантных ДНК. Процедура выделения кДНК ИФН-ов состоит в следующем: – из лейкоцитов человека выделяют мРНК, фракционируют ее по размерам, проводят обратную транскрипцию, встраивают в сайт модифицированной плазмиды; – полученным продуктом трансформируют E. coli; образовавшиеся клоны подразделяют на группы, которые идентифицируют; – каждую группу клонов гибридизируют с ИФН; – из образовавшихся гибридов, содержащих кДНК и РНК, выделяют мРНК, проводят ее трансляцию в системе синтеза белка; – определяют интерферонную противовирусную активность каждой смеси, полученной в результате трансляции. Группы, проявившие интерферонную активность, содержат клон с кДНК, гибридизировавшийся с ИФН — мРНК; повторно идентифицируют клон, содержащий полноразмерную ИФН — кДНК человека. Далее следуют: – осаждение (например, полиэтиленамином) с последующим центрифугированием, – высаливание интерферона из супернатанта аммония сульфатом, – диализ осадка интерферона, – растворение интерферона, пропускание раствора через колонку с иммуносорбентом (пришитыми моноклональными антителами). – элюция интерферона с последующей хроматографией на целлюлозном катионообменнике. После накопления в специальных ферментерах достаточно высокой концентрации клеток их удаляют из ферментера и разрушают (лизируют). В качестве основных методов лизиса используют: осмотический шок, замораживание-оттаивание, гомогенизирование, обработка детергентами. Затем с помощью последовательных процедур фильтрования, центрифугирования, ионообменной хроматографии и гель-хроматографии происходит предварительная очистка ИФН, дающая в итоге прозрачный бактериальный экстракт, в котором ИФН все еще составляет не более 1-2% от общего количества белка. Окончательную очистку препарата проводят на иммуносорбенте с моноклональными антителами к ИФН. Моноклональные антитела к ИФН » пришивают» к гранулам носителя и помещают в хроматографическую колонку (А). Затем наносят на колонку бактериальный экстракт, содержащий рекомбинантный интерферон. С антителами связывается лишь ИФН, другие же компоненты экстракта, в том числе все бактериальные токсины, свободно проходят через колонку и удаляются промывным раствором (В). Для извлечения из колонки адсорбировавшийся на антителах рекомбинантный ИФН через нее пропускают элюирующий буферный раствор, имеющий слабокислую реакцию. При этом связь между молекулами ИФН и антителами нарушается . ИФН переходит с поверхности частиц сорбента в буферный раствор и может быть собран в виде чистого вещества, не содержащего загрязняющих белков. Бактерии с генами интерферона человека продуцируют специфический белок в количестве 200–250 мкг/л бактериальной суспензии. Кроме E. coli удается получать человеческий интерферон с помощью В. subtilis, способную секретировать синтезируемые белки в окружающую среду (у E. coli они накапливаются в периплазматическом пространстве), а такте с помощью Saccharomyces cerevisiae, растущих на средах с более дешевыми субстратами, на них не действуют фаги, они крупнее бактерий и преинтерферонов. Применяют также культуры бактерий из родов Methylomonas, Pseudomonas, Salmonella. Все названные микроорганизмы конструктивно (не адаптивно) образуют интерфероны, не отличающиеся от природных. Стремительное расширение использования рекомбинантных ИФН и параллельное сокращение в последнее время применения природных препаратов связано, главным образом, с дефицитом сырья для производства последних (донорская кровь). Однако, на современном уровне рекомбинантные ИФН — это лишь воспроизведенные отдельные субтипы ИФН (продукты) одного гена, что сказывается на потенциале терапевтической активности. Идеальный препарат должен, подобно природному, иметь их физиологически сбалансированное сочетание. [4 стр. 560-562]. Задание 2. Опишите, как подобрать правильные дозировки антигенов при изготовлении ассоциированной вакцины? ссоциированные вакцины состоят из вакцин разного типа и вырабатывают иммунитет к нескольким заболеваниям. Они еще называются комплексными или поливалентными. Они могут включать однородные антигены (например, анатоксины) и антигены различной природы (например, корпускулярные и молекулярные антигены, убитых и живых микробов). Антигены в вакцинах содержатся в дозировках, не создающих взаимной конкуренции, чтобы иммунитет вырабатывался ко всем антигенам. Примеры ассоциированных вакцин:АКДС (ассоциированная коклюшно-дифтерийно-столбнячная вакцина) из столбнячного и дифтерийного анатоксина и коклюшной корпускулярной вакцины; живая ассоциированная полиомиелитная вакцина из штаммов вируса полиомиелита I, II,III типов; гриппозная вакцина из трех штаммов вируса гриппа; менингококковая вакцина из антигенов 4-х серотипов менингококка; живая комплексная вакцина против кори, паротита и краснухи. Задание 3. При культивировании растительных клеток биотехнолог обеспечил следующие условия: влажность 60-70%, механический способ перемешивания, кроме того он планирует перенести культуру в биореактор большего объема. Нет ли ошибок в его действиях? Ответ объясните. Задание 4. При производстве вакцин в качестве продуцента антигенного белка можно использовать микробы или культуры клеток млекопитающих. Чем будет обусловлен выбор? Задание 5. Опишите способы получения убихинона, их преимущества и недостатки. Подробно опишите биотехнологический способ. Промышленное получение убихинонов. При промышленном производстве Ко Q10 с последующим использованием его в терапевтических целях существует метод его экстракции из тканей животных, но в силу ограниченной доступности источников выделения и низкого содержания в них кофермента этот способ не является основным. Главным образом промышленное получение высших гомологов убихинонов базируется на биотехнологических методах: микробиологическом синтезе, обеспечивающем трансконфигурацию боковой цепи и экстракцию Ко Ql0 из культур растительных клеток. Многие представители микроорганизмов синтезируют убихиноны, причем тип главного Ко Ql0 у микроорганизма имеет таксономическое значение. Богатым источником убихинонов являются бактерии. В связи с этим перспективное направление получения Ко Q10 — использование биомасс бактерий, отходов уже действующих производств. Установлено, что биомасса уксуснокислых бактерий, используемых в промышленности для окисления D-сорбита в L-сорбозу, содержит Ко Ql0 без примеси его гомологов. При этом штамм G. oxydans ВНИВИ-6 продуцирует 5,6 мг/л, а штамм ВНИВИ2 — до 7 мг/л убихинона Q10. В настоящее время разработана технология, при которой одновременно осуществляется биосинтез Ко Q10 и окисление D-сорбита в L-сорбозу, причем при экстракции убихинона Ql0 из отсепарированной биомассы, являющейся отходом производства, выход конечного продукта может достигать 85%. На этом примере можно видеть одну из характерных особенностей биотехнологического получения витаминов и коферментов: возможность создания малоотходных производств. В настоящее время для выделения и количественного определения убихинонов предложен целый ряд методов. Их использование обычно определяется характером биообъекта, наличием сопутствующих веществ, однако любой из методов состоит из следующих основных этапов: экстракция, хроматографическое разделение полученного материала и количественное определение убихинонов. Способы экстракции убихинонов из биообъектов. Убихиноны легко растворимы в жирах и в большинстве органических растворителей и практически не растворимы в воде. Для их экстракции из биомассы обычно используют различные органические растворители. С целью наиболее полного выделения убихинонов биомассы предварительно дополнительно разрушают, дезинтегрируя с помощью ультразвука, или гидролизуют в щелочной среде. Чаще всего исходный материал предварительно гидролизуют спиртовым раствором щелочи, но иногда применяют и прямую экстракцию из нативных или лиофилизированных тканей. Каждый из методов имеет свои преимущества и недостатки. При омылении разлагается большинство сопутствующих веществ, поэтому убихиноны в дальнейшем легко выделяются хроматографическими методами, но при этом возможно разрушение связанного убихинона и в случае употребления этанольного раствора щелочи замещение метоксильных групп этоксильными. Для прямой экстракции обычно используют смеси этанол/эфир (3:1), хлороформ/метанол (3:1), ацетон. При этом из тканей выделяется большоеколичество липидов, которые затрудняют дальнейшую хроматографию и спектрофотометрию. Для проведения редокс-реакции убихиноны экстрагируют из гомогенатов неполярными углеводородами при низкой температуре в присутствии метанола. Хроматографические методы выделения убихинонов. От сопутствующих липидов убихиноны отделяют с помощью препаративной колоночной или ТСХ. Для разделения гомологов используют бумажную или тонкослойную хроматографию с обращенной фазой, а также колонки, заполненные порошком полиамида. Один из наиболее часто применяемых методов выделения убихинонов — ТСХ. Как известно, в ТСХ адсорбентом служит тонкий равномерный слой сухого мелкоизмельченного материала, нанесенного на соответствующую подложку . Подвижная фаза движется по поверхности пластинки под действием капиллярных сил. Хроматографический процесс зависит от используемого адсорбента и систем растворителей. После окончания процесса исследуемое вещество элюируют соответствующим растворителем. Количественные методы определения убихинонов. Существует ряд методов количественного определения убихинонов. Для этих целей используют реакции с борогидридами и этилцианацетатом. Реакция с этилцианацетатом является достаточно специфичной, и ее обычно применяют при работе с многокомпонентной смесью. Описаны также газохроматографические и ферментативные методы определения убихинонов. Наиболее распространенный и простой способ количественной оценки убихинонов — спектрофотометрический метод. Характерный максимум поглощения для убихинонов находится в УФ-области (275 нм). При мягком восстановлении убихинон превращается в убихинол, и максимум поглощения смещается до 290 нм, что дает возможность измерять количество вещества, используя различия спектров окисленной и восстановленной форм. Оборудование и техническое оснащение: колба (500 мл) с притертой пробкой, микропипетка, культура штамма Gluconobacter oxydans, ацетон, смесь хлоформ/этанол, система хлороформ/этиловый эфир, пластины «Силуфол», спектрофометр, качалка, хроматографическая камера. Известны способы получения убихинона-10 при помощи дрожжей из р. р. Сandida, Rhodotorula, Torulopsis, Sporidiobolus, предусматривающие культивирование дрожжей в периодических условиях на глюкозосодержащей среде с дрожжевым и кукурузным экстрактами и минеральными солями в аэробных условиях. Выращивание культур Agrobacterium sрp. на средах, содержащих по 4 % мелассы, сахарозы, кукурузного экстракта, а также минеральные соли, при строгом соблюдении режимов аэрации и перемешивания и регулировании скорости роста бактерий позволяет получать до 200 мг убихинона-10 с 1 л культуральной жидкости при содержании его в клетках до 5,1 мг/г сухой биомассы. Убихинон-10 можно также получать при культивировании дрожжей Trichosporon на отходах переработки древесины. Клетки содержат 0,84 мг кофермента в 1 г сухой биомассы. При способе получения убихинона-10 путем культивирования дрожжей Cryptococcus curvatus изменение состава среды приводит к значительному росту выхода целевого продукта и удешевлению производства. Использование в составе среды дешевого сырья – крупнотоннажного отхода производства – молочной сыворотки, которая служит источником углерода, витаминов, микроэлементов, обеспечивает накопление большого количества биомассы. Молочная сыворотка добавляется в среду в количестве 40 – 56 % по объему. Добавление ее в меньшем или большем количестве приводит к снижению выхода убихинона-10 с 1 л культуральной жидкости за счет снижения выхода биомассы в первом случае и снижения удельного содержания убихинона-10 во втором. Добавление глюкозы в среду в пределах 1,2 – 2,6 % является необходимым условием повышения содержания убихинона-10 в клетках (до 0,2 – 0,5 мг/г СБ), в противном случае на среде только с молочной сывороткой содержание убихинона-10 в них очень низкое, 0,05 мг/г сухой биомассы и менее. Дополнительное введение сернокислого или хлористого аммония 0,05 – 0,3 % необходимо для обеспечения определенного уровня значений рН в пределах 2,7 – 3,2, при котором наблюдается повышение содержания убихинона-10 в биомассе, если концентрация глюкозы в среде находится в вышеуказанных пределах. Введение меньших количеств солей аммония не приводит к должному эффекту, а введение больших количеств солей аммония – нецелесообразно. Снижение рН среды за счет добавления неорганических кислот не приводит к увеличению количества убихинона-10. Добавление этанола 3 – 5 % по объему за 10 – 25 ч до окончания ферментации необходимо для ингибирования роста культуры и повышения удельного содержания убихинона-10 в биомассе. Добавление этанола в меньших количествах является неэффективным, так как этанол быстро окисляется. Добавление его в больших количествах нецелесообразно. Способ получения заключается в следующем. Культуру дрожжей Cryptococcus curvatus выращивают на среде следующего состава, в процентах : молочная сыворотка 40 – 56; сульфат аммония или хлористый аммоний 0,1-0,5; однозамещенный фосфат калия 0,2 – 0,5; сульфат магния 0,05 – 0,1; сульфат железа 0,001; сульфат цинка 0,0001; дрожжевой экстракт 0,1-0,2; рН перед стерилизацией 4,7 – 5,4; вода водопроводная до 6 литров. Ферментацию проводят в ферментёре объемом 10 л с 6 л среды при подаче воздуха 1:2 (V :V), оборотах мешалки 900 – 1000 об/мин, температуре 28 °С. Во время ферментации в культуральную жидкость вносят глюкозу для поддержания концентрации ее в среде на уровне 1,2 – 2,6 %, сернокислый или хлористый аммоний 0,05 – 0,3 %. За 10 – 25 ч до окончания ферментации добавляют этанол 3 – 5 % по объему. Процесс ферментации ведется в течение 65 – 72 ч. В конце ферментации клетки отделяют на центрифуге при 5000 тыс. об/мин. Выход биомассы составляет 60 – 116 г/л с влажностью 70 – 82 %. Определение количества убихинона-10 в биомассе дрожжей проводят по модифицированной методике, описанной для определения кофермента Q10 в биомассе уксуснокислых бактерий. Для выделения фракции убихинонов используют ТСХ на пластинках Силуфол UV-254 в системе гексан:эфир (3:1). Содержание убихинона-10 в биомассе дрожжей составляет 0,2 – 0,5 мг/г сухой биомассы. Общее количество убихинона-10 с 1 л культуральной жидкости составляет 4,7 – 9,67 мг/л. Кабина, Н.А. К12 Основы биотехнологии. Рекомендации для подготовки к занятиям: учебно-методическое пособие / Н.А. Кабина, Е.И. Юшкова. – Орёл: ОГУ имени И.С. Тургенева, 2020. – 132 с. ISBN 978-5-9929-0859-6 В производстве убихинонов применяются биотехнологические методы, в основе которых лежит экстракция KoQ из биологического материала. В промышленном производстве убихинонов в качестве субстрата используются как растительные ткани - каллус риса или опухолевые ткани Carthamus tinctorius, так и микроорганизмы с высоким содержанием убихинонов, например дрожжи Cryptococcus curvatus и грибы Candida maltosa.В настоящее время используется биотехнология получения убихинона-9 из микробных липидов, являющихся побочным продуктом крупного производства белково-витаминного концентрата при выращивании грибов Candida maltosa.Установлено, что биомасса уксуснокислых бактерий, которые используются в производстве аскорбиновой кислоты на этапе окисления d-сорбита в L-сорбозу, содержит значительное количество KoQ,n без примеси его гомологов. Причем, с одной стороны, эта биомасса является отходом производства аскорбиновой кислоты, с другой стороны, штаммы Gluconobacter oxydans в биомассе характеризуются наибольшей окислительной активностью по сорбиту. Это позволило внедрить совместную технологию получения L-сорбозы и экстракции убихинона-10 из отсепарированной биомассы с последующей очисткой и с выходом целевого продукта до 85 %.  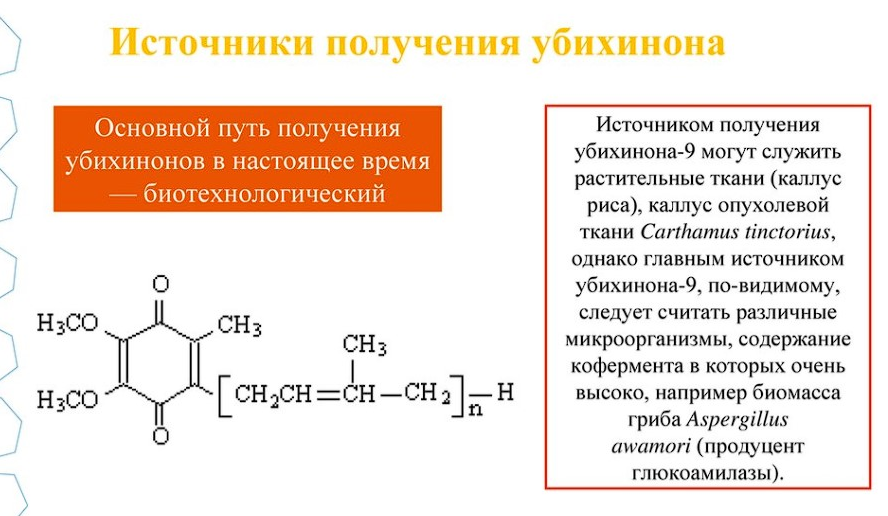  Задание 6. Осуществлена гибридизация синтетического олигонуклеотида (праймера) со специфическим участком одной из цепей анализируемого участка ДНК. Раствор с праймером распределяют по четырём пробиркам, в каждой из которых находятся четыре дезоксинуклеотида и один из четырех дидезоксинуклеотидов. Опишите как называется этот метод? Укажите его цель зачем через некоторое время в пробирки добавляют формамид? дальнейшие этапы исследования и их цель современный вариант описанного метода. В чем его преимущество? описанные методы являются основными в какой науке? Опишите ее задачи приведите пример использования достижений этой науки в фармацевтической биотехнологии Дидезоксинуклеотидный метод, или метод «обрыва цепи», был разработан Ф. Сенгером в 1977 году и в настоящее время широко используется для определения нуклеотидной последовательности ДНК. При секвенировании по Сенгеру происходит гибридизация синтетического олигонуклеотида длиной 17—20 звеньев со специфическим участком одной из цепей секвенируемого участка. Этот олигонуклеотид является праймером, поставляющим 3'-гидроксильную группу для инициации синтеза цепи, комплементарной матрице.Раствор с праймером распределяют по четырём пробиркам, в каждой из которых находятся четыре дезоксинуклеотида, dATP, dCTP, dGTP и dTTP (один из них — меченный радиоактивным изотопом) и один из четырёх 2',3'-дидезоксинуклеотидов (ddATP, ddTTP, ddGTP или ddCTP). Дидезоксинуклеотид включается по всем позициям в смеси растущих цепей, и после его присоединения рост цепи сразу останавливается.В результате этого в каждой из четырёх пробирок при участии ДНК-полимеразы образуется уникальный набор олигонуклеотидов разной длины, включающих праймерную последовательность. Далее в пробирки добавляют формамид для расхождения цепей и проводят электрофорез в полиакриламидном геле на четырёх дорожках. Проводят радиоавтографию, которая позволяет «прочесть» нуклеотидную последовательность секвенируемого сегмента ДНК. В 1990-х метод Сенгера претерпел важные усовершенствования. Радиоактивное мечение заменили флуоресцентным. То есть к каждому из нуклеотидов-терминаторов присоединили флуоресцентную метку своего цвета. Это позволило совместить четыре реакции синтеза в одной пробирке, а также автоматизировать считывание электрофореза: продукты реакции детектировали фотодатчики на выходе из геля. Короткий фрагмент ДНК называемый праймером, инициирует синтез ДНК в определённой точке цепи ДНК-матрицы. Фермент - ДНК-полимераза синтезирует цепь ДНК полностью комплементарную последовательности ДНК матрицы. При этом видоизменённые разновидности нуклеотидов, которые присутствуют в реакционной смеси в значительно меньших количествах, чем обычные нуклеотиды, обрывают синтез, когда один из них оказывается на конце растущей ДНК-цепи. В результате получается смесь, содержащая полный набор ново- синтезированных фрагментов ДНК, каждый из которых начинается в одном и том же месте, но заканчивается во всех возможных положениях вдоль цепи ДНК-матрицы. Современные автоматизированные секвенаторы разделяют эти фрагменты, пропуская всю смесь через тончайшие капилляры, наполненные полимером. Чем короче фрагмент, тем быстрее он движется в геле по капилляру под действием электрического поля. Фрагменты ДНК - по сути, ионы, движущиеся в электрическом поле от «минуса» к «плюсу». Процесс, называемый капиллярным электрофорезом, настолько эффективен, что фрагмент, только что вышедший из капилляра, оказывается ровно на один нуклеотид длиннее, чем предшествующий ему. Во время электрофореза луч лазера в определенном месте геля возбуждает флуоресценцию красителей, и детектор определяет, какой нуклеотид в настоящий момент мигрирует через гель. Таким образом регистрируя последовательность появления нуклеотидов, прибор складывает «буквы» (нуклеотиды) в «текст» (последовательность ДНК). В настоящее время определение точной нуклеотидной последовательности любого сегмента ДНК умеренной длины - вполне разрешимая задача. Уже определена последовательность нескольких сотен генов про- и эукариот. Зная последовательность гена и генетический код, легко определить аминокислотную последовательность кодируемого им белка. Определение последовательности ДНК привело также к тому, что были обнаружены области, которые не кодируют белки, но принимают участие в регуляции экспрессии генов и репликации ДНК. В 1996 году был секвенирован геном дрожжей, в 1998 г. - геном арабидопсиса, в 2000 году - геном человека. Области применения секвенаторов: секвенирование геномов de novo, SNP-типирование - онкология, секвенирование микроорганизмов, анализ родства. Задание 7. Ген, кодирующий 14-звенный человеческий пептидный гормон, объединили с геном, кодирующим бета-галактозидазу кишечной палочки. Полученный гибрид ввели в бактериальные клетки. Первые успешные результаты по экспрессии химически синтезированной последовательности нуклеотидов ДНК, кодирующей 14-звенный пептидный гормон соматостатин (антагонист соматотропина), получены в 1977 г. в США компанией «Генетек». Для предотвращения процесса разрушения гормона в бактериальных клетках под воздействием пептидазы авторы применили подход, который потом был успешно использован для получения других пептидных гормонов. Был сконструирован гибридный ген, часть которого была взята из гена фермента β-галактозидазы кишечной палочки, а остаток представлял собой фрагмент, кодирующий собственно соматостатин (фрагмент синтезировали химически). Введенный в бактериальные клетки гибридный ген направлял синтез белка-химеры, состоящего более чем на 90 % из аминокислотной последовательности β- галактозидазы. Остальная часть представляла собой соматостатин. На стыке участка двух исходных генов находился кодон аминокислоты метионина. Последнее позволило обработать гибридный белок бромцианом, разрывающим пептидную связь, образованную метионином; среди продуктов расщепления был обнаружен соматостатин. Данный подход был использован для получения многих пептидных гормонов (А- и В-цепей инсулина, нейропептида лейэнкефалина, брадикинина, ангиотензина и др.). Генноинженерными методами за короткий срок были созданы микро- организмы-суперпродуценты, позволяющие получать с высокими выходами ряд белков вирусов и животных. Созданы штаммы, у которых до 131 20 % клеточного белка составляют генноинженерные продукты, например, коровий антиген вируса гепатита В, главный капсидный антиген вируса ящура, реннин теленка, поверхностный антиген вируса гепатита В и др. Получение рекомбинантного инсулина Получение какого гормона описано в условии? Опишите его значение для человека ? Получение рекомбинантного соматотропина . Для лечения карликовости, В 1980 г. были получены доказательства того, что генноинженерный соматотропин обладает биологической активностью нативного гормона. Клинические испытания препарата также прошли успешно. В 1982 г. гормон был получен также на основе сконструированной кишечной палочки в Институте Пастера в Париже. Стоимость гормона к 1990 г. снизилась до 5 долларов/ед. Какие ферменты необходимы для осуществления этапов, описанных в условии? Подробно опишите дальнейшие действия по получению целевого продукта опишите преимущества получения человеческих белков таким способом Целесообразно ли было сразу ввести человеческий ген в бактериальные клетки, минуя стадию создания гибридного гена? Ответ объясните Генноинженерный препарат имеет несомненные преимущества: доступен в больших количествах, гомогенен, не содержит вирусов. |
