Методические указания для самостоятельной работы студентов всех специальностей и проведения практических занятий по химии
 Скачать 0.9 Mb. Скачать 0.9 Mb.
|
|
Министерство образования Республики Беларусь Министерство образования Российской Федерации Государственное учреждение высшего профессионального образования БЕЛОРУССКО - РОССИЙСКИЙ УНИВЕРСИТЕТ Кафедра «Технология металлов» СТРОЕНИЕ ВЕЩЕСТВА Методические указания для самостоятельной работы студентов всех специальностей и проведения практических занятий по химии  Могилёв 2003 Составитель Николаева Н. Л. Строение вещества. Методические указания для самостоятельной работы студентов всех специальностей и проведения практических занятий по химии. – Могилёв: Белорусско-Российский университет, 2003. – 38 с. В методических указаниях раскрыто содержание тем «Строение атома», «Периодическая система элементов» и «Химическая связь». Представлены основные понятия, законы и принципы, даны примеры написания электронных формул элементов и определения их валентности, приведены контрольные вопросы и упражнения. Одобрено кафедрой «Технология металлов» «1» июля 2003 г., протокол № 10 Рецензент Пацей В.Ф. Редактор Яроцкая Е. Л. Рекомендовано к опубликованию комиссией методического совета Белорусско – Российского университета Ответственный за выпуск Ловшенко Г. Ф. СТРОЕНИЕ ВЕЩЕСТВА ГУВПО Белорусско – Российский университет, 2003 Подписано в печать . Формат 60х84 1/16. Бумага офсетная. Печать трафаретная. Усл. печ. л. . Уч.-изд. л. . Тираж экз. Заказ № ________ _________________________________________________________________________________________________________________ Издатель и полиграфическое исполнение: Государственное учреждение высшего профессионального образования «Белорусско-Российский университет» Лицензия ЛВ № 243 от 11.03.2003 г., лицензия ЛП № 165 от 08.01.2003 г. 212005, г.Могилев, пр.Мира, 43 1 Строение атома 1.1 Современные представления о строении атомаАтом – наименьшая (неделимая химическим путем) частица элемента, сохраняющая все его химические свойства, определенные зарядом ядра. В составе атома есть ядро и электроны, которые вращаются вокруг ядра так быстро, что становятся неразличимыми – образуют электронную оболочку атома или электронное облако с определенной плотностью отрицательного заряда. Электроны принято обозначать как e−. Они очень легкие (масса электрона составляет всего лишь 1/1836 часть массы протона), но зато имеют отрицательный электрический заряд −1. Ядро, в котором сосредоточена почти вся масса атома, состоит в основном из частиц двух видов – нейтронов и протонов. Нейтроны обозначают как n0, а протоны как: p+ . По массе нейтроны и протоны почти одинаковы: 1,675·10-24 г и 1,673·10-24 г. Плотность вещества в ядре фантастически велика – порядка 1013-1014 г/см3. Спичечный коробок, наполненный веществом такой плотности, весил бы 2,5 миллиарда тонн! Считать массу таких маленьких частиц в граммах очень неудобно, поэтому ее выражают в углеродных единицах, каждая из которых равна 1,673·10-24 г (за единицу а. е. м. принята 1/12 массы изотопа углерод-12). Для каждой частицы получают относительную атомную массу, равную частному от деления массы атома на массу углеродной единицы. Относительные атомные массы протона и нейтрона равны 1, а вот заряд у протонов положительный и равен +1, в то время как у нейтронов заряда нет. Атом – электронейтральная частица, то есть число протонов равно числу электронов. И все атомы, у которых одинаковое число протонов, будут считаться атомами одного и того же химического элемента: химические свойства у них тоже будут одинаковы. Значит, каждый химический элемент состоит из атомов с одним и тем же зарядом ядра, или с одним и тем же атомным номером. Атомный номер (порядковый номер) Z равен числу протоновв атомном ядре и числу электронов в электронной оболочке атома. Массовое число A (относительная атомная масса) равно числу протонов Z и числу нейтронов N в атомном ядре; A = Z + N. Оказывается, нейтроны, утяжеляя ядро атома, придают ему больше прочности. В ядре атомов одного и того же элемента может содержаться разное число нейтронов. Нуклиды – атомы с определенным числом протонов и нейтронов; изотопы – атомы с одинаковым Z, но разными N (11Н-протий, 21Н-дейтерий, 31Н-тритий); изобары – атомы с одинаковым A, но разными Z (4018Ar, 4019К, 4020Са); изотоны – атомы с одинаковым N, но разными A (22888Ra- радий, 23090Th-торий). Верхний индекс – атомная масса, нижний – число протонов. Из всего вышеизложенного можно сделать следующие выводы. 1 Изменение количества протонов ведёт к появлению нового химического элемента: При получении одного протона атом кислорода превращается в изотоп фтора, а при изъятии одного протона из атома кислорода получится ядро изотопа азота: 2 Изменение количества нейтронов ведёт к появлению нового изотопа. Если взять атом кислорода с зарядом ядра +8, относительной массой ядра, равной 16, и добавить в ядро еще 2 нейтрона, то мы получим не новый элемент, а всего лишь новый изотоп кислорода – кислород-18: 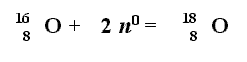 Атомные массы элементов, найденных в природе в виде единственного изотопа (например, натрия), в точности равны атомной массе этого изотопа. Иначе обстоит дело с элементами, которые существуют на Земле в виде нескольких изотопов (например, хлор, кислород). Атомный вес элемента равен среднему значению из атомных весов всех его природных изотопов с учетом их распространенности. Например, элемент хлор встречается в виде двух изотопов: хлор-35 и хлор-37. Их содержание составляет 75,53 % и 24,47 %. Если общее содержание двух изотопов в сумме принять за единицу, то одного из них – примерно 0,75 и другого – примерно 0,25. Тогда атомный вес природной смеси двух изотопов хлора округленно равен: 34,97·0,75 + 36,96·0,25 = 35,5 а.е.м. Так как изотопы отличаются друг от друга только числом нейтронов в ядре, а они практически не влияют на химические свойства элементов, то все изотопы одного и того же элемента химически неотличимы. 3 Изменение количества электронов ведёт к появлению новых ионов – катионов и анионов. Например: Na0 –1 e− = Na+ Cl0 +1 e− = Cl- Химический элемент остаётся тот же. |
