Методические указания для самостоятельной работы студентов всех специальностей и проведения практических занятий по химии
 Скачать 0.9 Mb. Скачать 0.9 Mb.
|
1.4 Электронные семейства элементовВ зависимости от того, на какой подуровень попадает последний электрон, все элементы делятся на четыре семейства: s - элементы—I-II группа главная подгруппа, а также водород и гелий; p - элементы—III-VIII группа главная подгруппа, кроме водорода и гелия; d - элементы— все побочные подгруппы I- VIII групп; f - элементы— актиноиды и лантаноиды. 1.5 Атомная валентная зона. Возможные валентные состояния Атомная валентная зона (АВЗ) – это часть электронной оболочки, которая может перестраиваться по ходу образования химической связи. АВЗ включает, как правило, внешний s– подуровень (ns) и тот подуровень, который заполняется у данного элемента (таблица 3). Таблица 3 - АВЗ
Оставшаяся часть электронной оболочки в совокупности с ядром называется атомным остовом или химическим ядром. Пример. Определите возможные валентные состояния и укажите семейство для элементов с порядковыми номерами 11, 20, 8, 34, 22, 43, 28. Запишем электронные формулы этих элементов, подчеркнём их АВЗ и для неё построим энергетическую диаграмму: 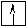 11Na 1s22s22p63s1 На внешнем энергетическом уровне у натрия находится только один электрон, поэтому он может проявлять только одну валентность, равную единице (В=1). 2 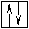 0Ca 1s22s22p63s23p64s2 На внешнем энергетическом уровне у кальция находится два спаренных электрона. А поскольку с точки зрения спин–валентной теории участвовать в образовании связи могут только свободные электроны, то в стационарном состоянии валентность кальция будет равна нулю (В=0). 0Ca 1s22s22p63s23p64s2 На внешнем энергетическом уровне у кальция находится два спаренных электрона. А поскольку с точки зрения спин–валентной теории участвовать в образовании связи могут только свободные электроны, то в стационарном состоянии валентность кальция будет равна нулю (В=0). П 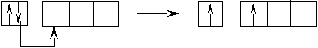 ри получении незначительного количества энергии электроны могут переходить с одного энергетического подуровня на другой, но только в пределах своего уровня. Энергия, затрачиваемая на распаривание электронов, незначительна и окупается энергией, выделяющейся при образовании связи. ри получении незначительного количества энергии электроны могут переходить с одного энергетического подуровня на другой, но только в пределах своего уровня. Энергия, затрачиваемая на распаривание электронов, незначительна и окупается энергией, выделяющейся при образовании связи. В таком состоянии валентность кальция равна двум (В*=2). 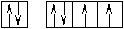 8O 1s22s22p4 Поскольку здесь нет свободного d– подуровня на втором энергетическом уровне, то электроны распаривать некуда и кислород может быть только двухвалентен. 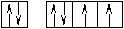 34Se 1s22s22p63s23p63d104s24p4 В=2. Но, не смотря на то, что и селен, и кислород стоят в одной группе, имеют сходное строение электронной оболочки и должны проявлять одинаковую валентность, оказывается, что у селена имеется свободный d– подуровень на четвёртом уровне, куда могут распариваться валентные электроны. 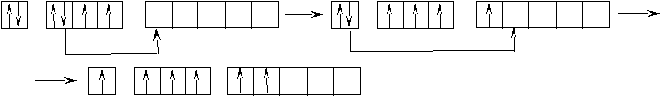 В этом случае В*=4; 6.  2  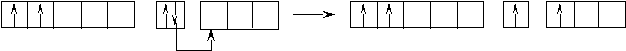 2Ti 1s22s22p63s23p63d24s2. На первый взгляд, в атоме титана имеется два неспаренных электрона на предвнешнем d– подуровне, которые могли бы вступить в образование связи. Но, на самом деле, они экранируются внешними спаренными s– электронами, поэтому в стационарном состоянии валентность титана равна нулю. В возбуждённом состоянии внешние s– электроны четвертого уровня распариваются (один из них переходит на р– подуровень того же уровня). Поскольку сразу два электрона получили некоторый избыток энергии, то они оба вступают в химическое взаимодействие, то есть В*=2. 2Ti 1s22s22p63s23p63d24s2. На первый взгляд, в атоме титана имеется два неспаренных электрона на предвнешнем d– подуровне, которые могли бы вступить в образование связи. Но, на самом деле, они экранируются внешними спаренными s– электронами, поэтому в стационарном состоянии валентность титана равна нулю. В возбуждённом состоянии внешние s– электроны четвертого уровня распариваются (один из них переходит на р– подуровень того же уровня). Поскольку сразу два электрона получили некоторый избыток энергии, то они оба вступают в химическое взаимодействие, то есть В*=2.Что касается d– электронов на третьем энергетическом уровне, то они расположены ближе к ядру и поэтому обладают меньшим запасом энергии. Вследствие этого они менее активны и в образование связи могут вступать по одному. То есть В*=3; 4. Но, поскольку не все теоретически определённые валентности для элементов d– семейства обнаруживаются экспериментально, для них целесообразно указывать интервал валентностей. Например, В*=2-4. 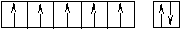 43Tc 1s22s22p63s23p63d104s24p64d55s2 В стационарном (невозбуждённом) состояние В = 0. В возбуждённом состоянии В* = 2-7. 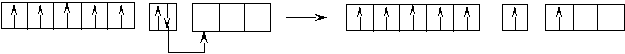 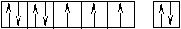 28Ni 1s22s22p63s23p63d84s2 В=0. Следует учитывать, что хотя у никеля присутствуют и спаренные электроны на 3d– подуровне, и вакантные места на 4р– подуровне, мы не можем переместить эти электроны с 3d– подуровня на 4р– подуровень, поскольку это различные энергетические уровни. 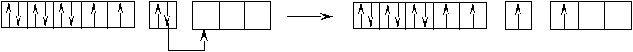 В возбуждённом состоянии В*=2-5. Первые два элемента (Na и Са) относятся к s– семейству, поскольку у них последним застраивается s- подуровень, вторые два элемента (O и Se) относятся к p– семейству, поскольку у них последним застраивается p– подуровень, последние три элемента (Ti, Tc и Ni) относятся к d– семейству, поскольку у них последним застраивается d– подуровень. 1.6 Проскок (провал) электронов Проскок электрона - отступления от общей для большинства элементов последовательности заполнения электронных оболочек (1s, 2s, 2p, 3s, 3p, 4s, 3d и так далее), связанные с тем, что эти "нарушения правил" обеспечивают атомам некоторых элементов меньшую энергию по сравнению с заполнением электронных оболочек "по правилам". Объясняется это тем, что энергетически более выгодно, когда в атоме имеется наполовину или полностью заполненный подуровень (р3; р6; d5; d10; f7; f14). Поэтому в атомах элементов, у которых строение электронной оболочки близко к вышеуказанному, может наблюдаться преждевременное заполнение d- подуровня за счёт проскока (или провала) электрона с внешнего s- подуровня на нижележащий (предвнешний) d- подуровень (закономерные проскоки). Таблица 4 – АВЗ элементов, характеризующихся провалом электрона
Теперь для этих элементов определим возможные валентные состояния. Построим энергетическую диаграмму АВЗ для меди. 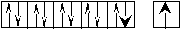 На этой диаграмме изображение s– электронов имеет чуть больший размер, чем d– электронов. В таком состоянии медь одновалентна, так как присутствует только один неспаренный электрон. А на практике оказывается, что медь проявляет валентность, равную двум. Следовательно, возможно, вопреки правилу, перевести один проскочивший электрон с предвнешнего 3d– подуровня на внешний 4р– подуровень. В этом случае В*=2. 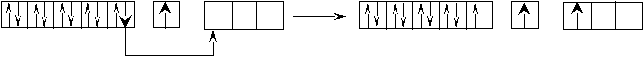 Поскольку остаётся ещё один неспаренный электрон на предвнешнем d– подуровне, то медь может быть, хотя и реже (так как этот электрон менее активен), трехвалентна. Остальные 3d– электроны перевести на р– подуровень нельзя, поскольку это другой энергетический уровень. Для золота характерна та же картина: В = 1; 2*; 3*. Отличие заключается в том, что этот элемент стоит в шестом периоде и, следовательно, имеет больший радиус. Поскольку электроны ядром удерживаются слабее, то их оторвать проще. Поэтому золото чаще всего трёхвалентно, так как отдаёт сразу все электроны. Серебро же, хотя и имеет сходную структуру АВЗ, проявляет единственную валентность, равную единице. Объясняется это строением электронной оболочки палладия- элемента, который стоит перед серебром. Дело в том, что палладий - единственный элемент в таблице, у которого происходит провал не одного электрона, а сразу двух. То есть, электронная формула имеет вид 4d10 5s0, вместо 4d8 5s2. Поэтому номер периода не соответствует количеству уровней, так как нет электронов – нет уровня. Серебро идёт сразу за палладием и у него происходит стабилизация 4d– подуровня (электрон оттуда вернуться уже не может), а следующий электрон попадает уже на 5s– подуровень. Ч 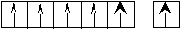 то касается хрома и молибдена, то они имеют абсолютно одинаковое строение АВЗ и проявляют одинаковую валентность. Энергетическая диаграмма: то касается хрома и молибдена, то они имеют абсолютно одинаковое строение АВЗ и проявляют одинаковую валентность. Энергетическая диаграмма:В данном случае s– электроны выделены более чётко, так как являются более активными. Поэтому при вступлении в связь хром и молибден отдают, как правило, не один, а сразу два электрона. Значит В*=2-6. Можно привести достаточно большое количество незакономерных проскоков. Например, Ru : 4d75s1 (вместо 4d65s2), Pt: 5d96s1 (вместо 5d86s2) и так далее. Валентность рутения определяется по такому же принципу как и у хрома, а валентность платины – по такому же принципу как и у меди. Периодическая_система_элементов__2.1_Периодический_закон'>2 Периодическая система элементов 2.1 Периодический закон Поскольку химические свойства обусловлены строением электронных оболочек атома, то периодическая система Менделеева – это классификация элементов по электронным структурам их атомов. Но при образовании химической связи электроны могут перераспределяться между атомами, а заряд ядра остается неизменным. Поэтому современная формулировка периодического закона гласит: «Свойства элементов, а так же свойства и форма образуемых ими соединений находятся в периодической зависимости (правильно повторяются) от зарядов ядер их атомов». 2.2 Современная структура Периодической таблицы Менделеева Периодическая таблица элементов является графическим выражением периодического закона. Она состоит из периодов и групп. Период – горизонтальный ряд, элементы которого имеют одинаковое число электронных слоев. Номер периода совпадает со значением главного квантового числа nвнешнего уровня (слоя), который постепенно заполняется электронами от начала к концу периода. Таких периодов в периодической системе семь. Второй и последующие периоды начинаются щелочным элементом (ns1) и заканчивается благородным газом (ns2np6). По вертикали периодическая система подразделяется на восемь групп. Группы делятся на главные – А, состоящие из s- и p-элементов, и побочные – B-подгруппы, содержащие d-элементы, которые называют переходными элементами или переходными металлами. Подгруппа III B, кроме d-элементов, содержит по четырнадцать f-элементов, у которых заполняется 4f- и 5f-подуровень: лантаноиды и актиноиды. Элементы, стоящие друг под другом в группе и имеющие сходное строение электронных оболочек и химические свойства, называются электронными или химическими аналогами. Например,
Элементы главных подгрупп содержат на внешнем электронном слое одинаковое число валентных электронов, которое равно номеру группы. Поэтому номер группы часто совпадает с высшей валентностью элементов. Например, он совпадает с валентностью s-элементов и с наибольшей возможной валентностью p-элементов (кроме O, F, элементов подгруппы меди и восьмой группы).В этом заключается физический смысл номера группы. В главных подгруппах валентные электроны расположены на s- и p-орбиталях внешнего энергетического уровня, в побочных – на s-орбиталях внешнего и d- или f-орбиталях предвнешнего слоя. Поэтому элементы главных и побочных групп сильно отличаются по свойствам. В группах собраны элементы с похожими химическими свойствами, а в периодах химические свойства постепенно изменяются. В настоящее время используются в основном две формы Периодической таблицы: длиннопериодная и короткопериодная. По координатам элемента в Периодической системе можно не только совершенно точно узнать строение его электронной оболочки, но и предсказать его химические свойства. | |||||||||||||||||||||||||||||||||||||||||||||||
