Методические указания для самостоятельной работы студентов всех специальностей и проведения практических занятий по химии
 Скачать 0.9 Mb. Скачать 0.9 Mb.
|
|
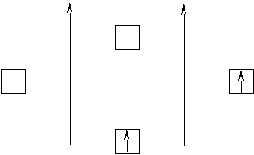
Поскольку в первую очередь заполняются орбитали с меньшей энергией, то электроны пойдут на связывающую орбиталь. А так как по принципу Паули их там может поместиться только два, то электронов для разрыхляющей орбитали уже не остаётся. Кратность связи в этом случае будет равна n = (2-0)/2 = 1, то есть связь осуществляется одной парой электронов. Что касается молекулярного иона Н2+, то он образуется из атома Н и протона Н+, у которого нет валентного электрона (рисунок 6). Кратность связи в этом случае будет равна n = (1-0)/2 = 1/2, то есть связь осуществляется одним электроном. Такое явление МВС объяснить не может. Аналогичную структуру будет иметь и молекулярный ион Н2–, который образуется из атома Н и атомарного иона Н–, который имеет один лишний валентный электрон (два электрона идут на связывающую орбиталь, а один– на разрыхляющую). Кратность связи в этом случае будет равна n = (2-1)/2 = 1/2, то есть связь так же осуществляется одним электроном. Из всего вышесказанного следует, что более прочной будет молекула Н2 по сравнению с молекулярными ионами, поскольку она характеризуется большей кратностью связи; а сами молекулярные ионы Н2+ и Н2– по прочности абсолютно одинаковы.
С помощью ММО можно объяснить отсутствие молекул благородных газов. Рассмотрим это на примере молекулы He2, которая должна была бы образовываться из двух атомов Не с АВЗ 1s2 (рисунок 7).
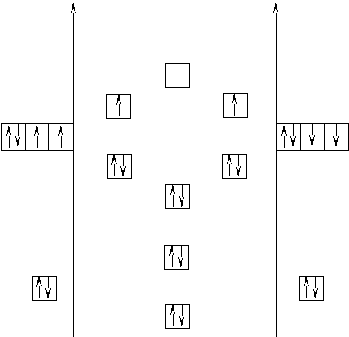
В этом случае кратность связи будет равна n = (2-2)/2 = 0, то есть связь не осуществляется, поскольку нет общей электронной пары и нет выигрыша в энергии. А при таких условиях молекула не образуется. За водородом и гелием идут элементы, имеющие более сложное строение электронной оболочки, следовательно, молекулы, образуемые этими веществами, будут иметь соответствующее строение. Рассмотрим это на примере молекулы О2 (рисунок 8). Она образуется из двух атомов кислорода с АВЗ 2s22р4. Поскольку s– орбитали обладают меньше энергией, чем р– , то на энергетической диаграмме они будут располагаться ниже. Обратите ещё раз внимание на то, что валентные электроны различных атомов имеют антипараллельные спины. Поскольку каждый из атомов предоставляет по одной s- орбитали и по три р– орбитали, то общее количество молекулярных орбиталей будет равно восьми. Из двух атомных s– орбиталей образуются две молекулярные: σs– связывающая и σs– разрыхляющая (так как перекрывание электронных облаков происходит по линии, соединяющей центры атомов). Из шести р– орбиталей образуется три связывающие и три разрыхляющие орбитали. В силу того, что одна пара электронных облаков перекрывается по линии, соединяющей центры атомов, между ними образуются σр– связывающая и σр– разрыхляющая молекулярные орбитали. Между оставшимися двумя парами р– орбиталей будет наблюдаться боковое перекрывание, поэтому образуются две р- связывающие орбитали, одинаковые по энергии, и две р– разрыхляющие, так же одинаковые по энергии. На энергетической диаграмме σр– связывающая орбиталь расположена ниже р– связывающих, так как при образовании σ– связи выделяется больше энергии, следовательно сама связь будет обладать меньшим запасом энергии. Заполнение диаграммы электронами (12 электронов у обоих атомов) происходит по мере увеличения энергии молекулярных орбиталей (снизу вверх). На разрыхляющих орбиталях два электрона находятся в разных ячейках, так как в этом случае суммарный спин системы будет максимальным. Кратность связи в этом случае будет равна n= (8-4)/2 = 2, то есть связь так же осуществляется двумя парами электронов.
Строение молекулярного иона О2+ или О22+ будет отличаться отсутствием одного или двух электронов соответственно на разрыхляющих орбиталях. Кратность связи при этом будет повышаться (n= (8-3) / 2 = 2,5 и n= (8-2) / 2 = 3) и прочность ионов по сравнению с прочностью молекулы О2 будет увеличиваться. То есть удаление электрона со связывающейорбитали уменьшает энергию связи в молекулярном ионе, а удаление электрона с разрыхляющей орбитали приводит к увеличению энергии связи в молекулярном ионе в сравнении с молекулой. ММО позволяет объяснить существование электронодефицитных соединения (B2H6, NO) и соединений благородных газов; магнетизм и окраску вещества; устойчивость молекулярных ионов и атомов в сравнении с молекулами. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 E
E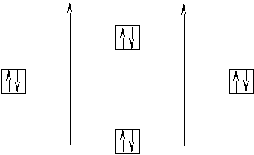 Е
Е