химия. Методические указания и контрольные задания для студентов заочников инженернотехнических (нехимических)
 Скачать 2.15 Mb. Скачать 2.15 Mb.
|
|
Пример 1. Почему в жесткой воде мыло плохо пенится? Напишите соответствующие уравнения реакций. Решение. Природная вода, содержащая в растворе значительное количество ионов Ca2+ и Mg2+ в виде солей, называется жесткой. В жесткой воде мыло плохо пенится, т. к. ионы кальция и магния образуют с ним нерастворимые соединения. Главная составная часть мыла – это натриевые соли высокомолекулярных органических кислот – стеариновой (C17H35COOH) и олеиновой (C15H31COOH). При соприкосновении мыла с жесткой водой происходит реакция: 2C17H35COONa + Ca2+ = Ca(C17H35COO)2 + 2Na+. Моющее действие мыла снижено в жесткой воде. Пример 2. Как можно устранить карбонатную (временную) и некарбонатную (постоянную) жесткость воды? Решение. Различают карбонатную жесткость воды, обусловленную присутствием в воде гидрокарбонатов кальция и магния, и некарбонатную, вызванную присутствием в воде сульфатов и хлоридов кальция и магния. Карбонатную жесткость можно устранить кипячением воды, при этом ионы кальция и магния образуют нерастворимые осадки карбоната кальция и гидроксида магния: Ca(HCO3)2 Mg(HCO3)2 Временную жесткость можно устранить добавлением к воде гашеной извести и других реагентов, при этом протекает реакция: Ca(HCO3)2 + Ca(OH)2 = 2CaCO3¯ + 2H2O. Для устранения карбонатной жесткости вводят вещества (соду Na2CO3, фосфат натрия), способные связывать ионы кальция и магния в нерастворимые соли: CaCl2 + Na2CO3 = CaCO3¯ + 2NaCl, 3MgSO4 + 2Na3PO4 = Mg3(PO4)2 + 3Na2SO4. Ионы кальция и магния можно удалить из жесткой воды посредством катионирования. Катиониты – это высокомолекулярные соединения кремния, алюминия и других веществ, нерастворимые в воде и способные обменивать свои катионы на Ca2+ и Mg2+. При пропускании жесткой воды через катионит происходит реакция Ca2+ + Na2R = 2Na+ + CaR, где R – сложный кислотный остаток. Ионы Ca2+ и Mg2+ осаждаются на катионите, что приводит к умягчению воды. Пример 3. Определите временную жесткость воды, зная, что на реакцию с гидрокарбонатом, содержащимся в 200 мл этой воды, потребовалось 10 мл 0,05 н. раствора HCl. Решение. Временная жесткость воды рассчитывается по формуле Жвр. = 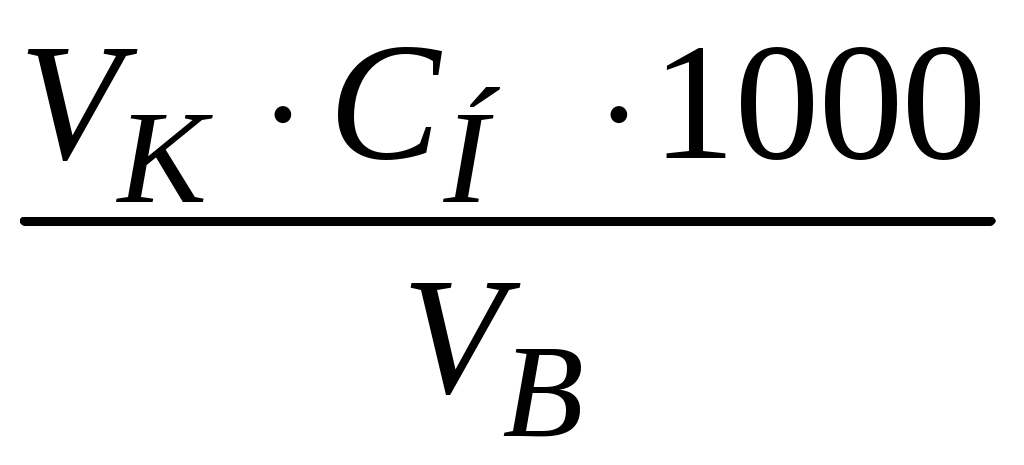 , ,здесь Жвр. – временная жесткость воды, ммоль экв/л; VK – объем кислоты, пошедший на титрование, мл; VВ – объем воды, мл; CH – нормальная концентрация раствора кислоты, экв/л. Жвр. = Пример 4. Сколько карбоната натрия нужно добавить к 20 литрам воды, чтобы устранить общую жесткость воды, равную 2,0 ммоль экв/л? Решение. Для решения задачи воспользуемся формулой определения жесткости воды: Ж = 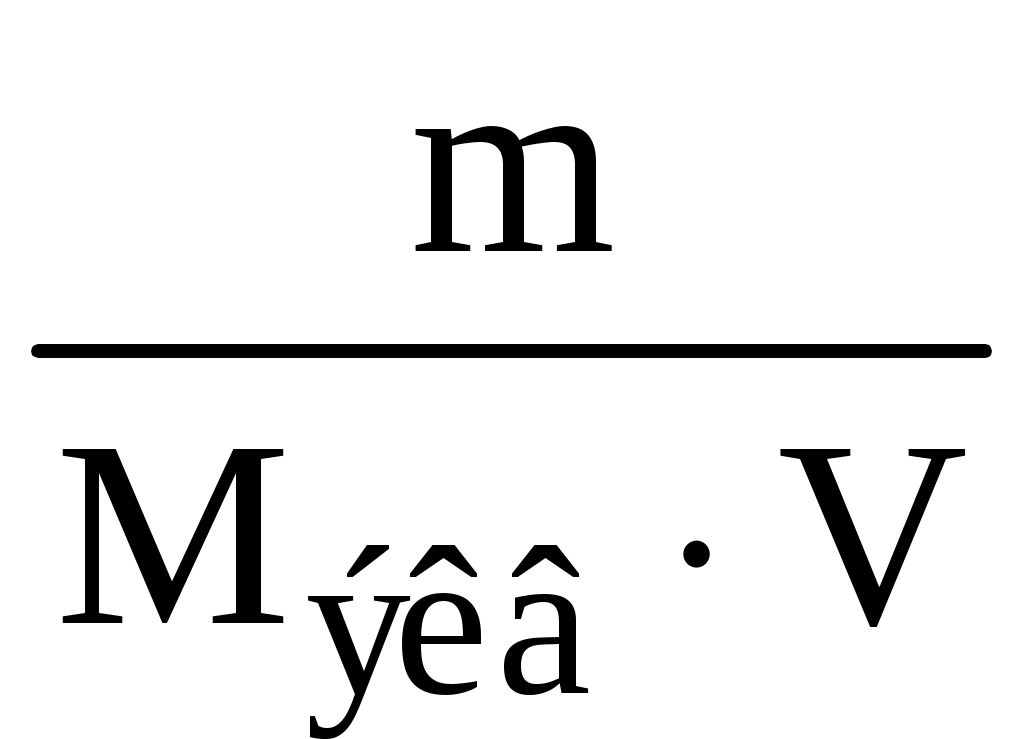 , ,где m – масса вещества, обусловливающего жесткость воды или добавляе-мого для ее устранения, г; Мэкв – молярная масса эквивалента вещества, г/моль; V – объем воды, л. Рассчитаем молярную массу эквивалента карбоната натрия путем деления молекулярной массы его на валентность натрия и число атомов натрия: Мэкв (Na2CO3) = M(Na2CO3) / n = 106 / 2 = 53 г/моль, Ж = M(Na2CO3) / Мэкв (Na2CO3) V Þ M(Na2CO3) = Ж Мэкв (Na2CO3) V; M(Na2CO3) = 2,0 53 20 = 2120 мг = 2,12 г. Пример 5. К 200 литрам жесткой воды добавили 25,9 кг гидроксида кальция. На сколько миллимоль-эквивалентов понизилась карбонатная жесткость? Решение. Жесткость воды измеряется количеством миллимоль-эквивалентов (ммоль экв) ионов кальция и магния. Молярная масса эквивалента гидроксида кальция равна половине молекулярной массы: 72 : 2 = 37 г/моль. Воспользуемся формулой для определения жесткости воды и рассчитаем, на сколько она понизилась при добавлении гидроксида кальция: Ж = 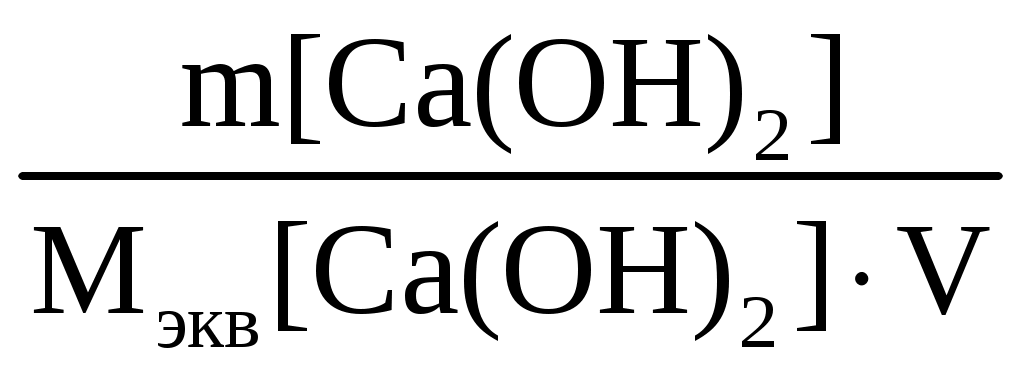 = = 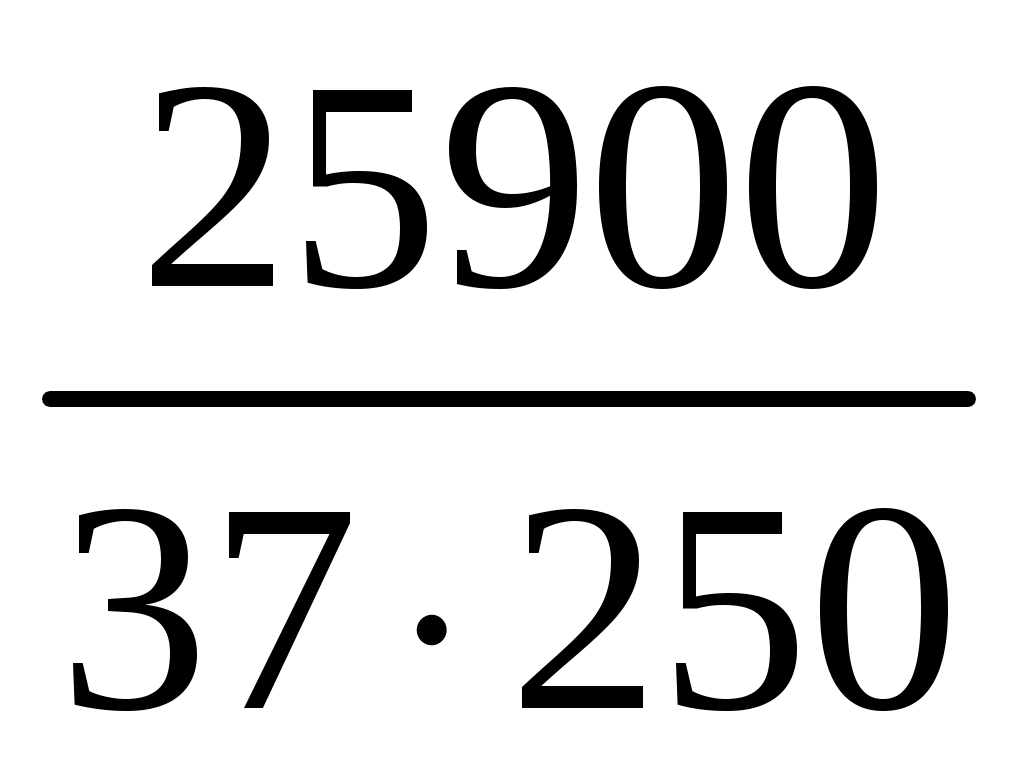 = 2,8 ммоль экв/л. = 2,8 ммоль экв/л.Жесткость воды понизилась на 2,8 ммоль экв/л. Задания 341. Сколько граммов Na3PO4 надо прибавить к 500 л воды, чтобы устранить ее карбонатную жесткость, равную 5 ммоль экв/л? 342. Какие соли обусловливают жесткость природной воды? Какую жесткость называют карбонатной, некарбонатной? Как можно устранить карбонатную, некарбонатную жесткость? Напишите уравнения соответствующих реакций. 343. Вычислите карбонатную жесткость воды, зная, что для реакции с гидрокарбонатом кальция, содержащимся в 200 см3 воды, требуется 15 см3 0,08 н. раствора HCl. 344. В 1 л воды содержится 36,47 мг ионов магния и 50,1 мг ионов кальция. Чему равна жесткость этой воды? 345. Сколько граммов карбоната натрия надо прибавить к 400 л воды, чтобы устранить жесткость, равную 3 ммоль экв/л? 346. Вода, содержащая только сульфат магния, имеет жесткость 7 ммоль экв/л. Сколько граммов сульфата магния содержится в 300 л этой воды? 347. Вычислите жесткость воды, зная, что в 600 л ее содержится 65,7 г гидрокарбоната магния и 61,2 г сульфата кальция. 348. В 220 л воды содержится 11 г сульфата магния. Чему равна жесткость этой воды? 349. Жесткость воды, в которой растворен только гидрокарбонат кальция, равна 4 ммоль экв/л. Сколько 0,1 н. раствора HCl потребуется для реакции с гидрокарбонатом кальция, содержащимся в 75 см3 этой воды? 350. В 1 м3 воды содержится 140 г сульфата магния. Вычислите жесткость этой веды. 351. Вода, содержащая только гидрокарбонат магния, имеет жесткость 3,5 ммоль экв/л. Сколько граммов гидрокарбоната магния содержится в 200 л этой воды? 352. К 1 м3 жесткой йоды прибавили 132,5 г карбоната натрия. На сколько ммоль экв/л понизилась жесткость? 353. Чему равна жесткость воды, если для ее устранения к 50 л воды потребовалось прибавить 21,2 г карбоната натрия? 354. Сколько граммов, CaSO4 содержится в 200 л воды, если жесткость, обусловливаемая этой солью, равна 8 ммоль экв/л? 355. Вода, содержащая только гидрокарбонат кальция, имеет жесткость 9 ммоль экв/л. Сколько граммов гидрокарбоната кальция содержится в 500 л этой воды? 356. Какие ионы надо удалить из природной воды, чтобы сделать ее мягкой? Введением каких ионов можно умягчить воду? Составьте уравнения соответствующих реакций. 357. Сколько граммов карбоната натрия надо прибавить к 0,1 м3 воды, чтобы устранить жесткость, равную 4 ммоль экв/л? 358. К 100 л жесткой воды прибавили 12,95 г гидроксида кальция. На сколько ммоль экв/л понизилась карбонатная жесткость? 359. Чему равна карбонатная жесткость воды, если в 1 л ее содержится 0,292 г гидрокарбоната магния и 0,2025 г гидрокарбоната кальция? 360. Сколько граммов гидроксида кальция надо прибавить к 275 л воды, чтобы устранить ее карбонатную жесткость, равную 5,5 ммоль экв/л? р-элементы (...ns2np1–6) Пример 1. Дайте общую характеристику p-элементов, основываясь на их положении в таблице Д. И. Менделеева. Решение. На внешнем энергетическом уровне у p-элементов находится по 2 s-электрона и от 1 до 6 p-электронов. Количество p-электронов возрастает по периодам слева направо. С увеличением порядкового номера (заряда ядра атомов), уменьшается радиус и металлические (основные) свойства, нарастают неметаллические (кислотные). По группам сверху вниз у p-элементов увеличивается радиус атомов за счет увеличения числа энергетических уровней, постепенное ослабление неметаллических и нарастание металлических свойств. Условная граница между элементами с ярко выраженными металлическими и неметаллическими свойствами находится на диагонали, проведенной из верхнего левого угла в нижний правый угол таблицы Д. И. Менделеева. Металлические p-элементы обладают способностью к отдаче валентных электронов и проявляют положительные степени окисления, являясь восстановителями во многих химических реакциях. Неметаллические p-элементы имеют тенденцию к присоединению электронов до завершения внешнего валентного энергетического уровня, проявляют отрицательные степени окисления и в химических реакциях являются окислителями. Пример 2. Почему хлор способен к реакциям самоокислениясамовосстановления (диспропорционирования)? На основании электронных уравнений напишите реакцию растворения хлора в едком натре. Решение. Степень окисления хлора в молекуле равна нулю, т. е. имеет промежуточное значение между (–1) и (+1, +3, +5, +7) в соединениях. Поэтому один атом хлора в молекуле присоединяет к себе электрон от другого атома, другой отдает. В результате один атом хлора окисляется (степень окисления повышается), а другой восстанавливается (степень окисления понижается). Распишем электронные уравнения и на их основе уравнения реакций. Электронные уравнения: Cl Cl Уравнения реакции растворения хлора в щелочи: 2NaOH + Cl2 = NaClO + NaCl + H2O. Пример 3. На основании электронных уравнений составьте уравнение реакции взаимодействия серы с азотной кислотой, учитывая, что сера окисляется максимально, а азот восстанавливается минимально. Решение. Определим, какие вещества могут образовываться в результате реакции. Сера в своих соединениях проявляет следующие степени окисления: (–2, +2, +4, +6). Максимальная степень окисления (+6), она реализуется в следующих соединениях: серной кислоте, триоксиде серы и сульфатах. В кислой среде образуется серная кислота. Для азота характерны степени окисления (–3, +1, +2, +3, +4, +5). В азотной кислоте степень окисления равна (+5), а так как азот восстанавливается минимально, то он принимает один электрон и приобретает степень окисления (+4). Устойчивым соединением азота с такой степенью окисления является NO2. Электронные уравнения: 6 | S0 – 6 1 | Уравнение реакции взаимодействия серы с азотной кислотой S + 6HNO3 = H2SO4 + 6NO2 + 2H2O. Пример 4. Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений: C Al4C3 CH4 CO2 H2CO3. При каких превращениях происходят окислительно-восстановительные реакции? Решение. Уравнения реакций: 1. 3C + 4Al = Al4C3. 2. Al4C3 + 12H2O = 4Al(OH)3 + 3CH4. 3. CH4 + 2O2 = CO2 +2H2O. 4. CO2 + H2O = H2CO3. Определим степени окисления углерода в соединениях: C – (0), Al4C3 – (–4), CH4 – (–4), CO2 – (+4), H2CO3 – (+4). Степень окисления углерода изменяется в реакциях 1 и 3, следовательно, они являются окислительно-восстановительными. Пример 5. К раствору, содержащему нитраты алюминия и висмута, добавили избыток раствора едкого калия. Напишите молекулярные и ионные уравнения реакций. Какое вещество находится в осадке? Решение. Степень окисления алюминия и висмута в нитратах равна (+3). При действии едкого калия протекают реакции: Al(NO3)3 + 3KOH = Al(OH)3 + 3KNO3, Al3+ + 3NO Al3+ + 3OH– = Al(OH)3, Bi(NO3)3 + 3KOH = Bi(OH)3 + 3KNO3, Bi3+ + 3NO Bi3+ + 3OH– = Bi(OH)3. В результате реакций образуются нерастворимые гидроксиды алюминия и висмута. Гидроксид алюминия обладает амфотерными свойствами и при избытке раствора гидроксида калия растворяется в нем с образованием хорошо растворимого тетрагидроксоалюмината калия: Al(OH)3 + KOH = K[Al(OH)4]. Гидроксид висмута амфотерными свойствами не обладает и при добавлении избытка щелочи остается в осадке. Пример 6. В каком газообразном соединении мышьяк проявляет свою низшую степень окисления? Напишите уравнения реакций: 1. Получение этого соединения при взаимодействии мышьяка с водородом в момент выделения. 2. Взаимодействии этого соединения с кислородом. Решение. Низшая степень окисления мышьяка (–3). Гидрид мышьяка или арсин – AsH3, представляет собой газ, в котором мышьяк проявляет свою низшую степень окисления. 1. Реакция образования AsH3 при взаимодействии As2O3 с водородом: As2O3 + 6Zn + 6H2SO4 = 2AsH3 + 6ZnSO4 +3H2O. 2. Реакция взаимодействия AsH3 с кислородом: 2AsH3 + 3O2 = As2O3 + 3H2O. Пример 7. Какие реакции нужно провести, имея бор и воду, чтобы получить борную кислоту? Решение. Непосредственным взаимодействием бора с водой борную кислоту получить нельзя, так как вода не растворяет бор. Поэтому борная кислота получается по следующим стадиям: 1. Электролиз воды: 2H2O = 2H2 + O2. 2. Сжигание бора в кислороде при 700 С: 4B + 3O2 = 2B2O3. 3. Растворение оксида бора в воде с образованием борной кислоты: B2O3 + 3H2O = 2H3BO3. Пример 8. Напишите формулы и назовите оксиды азота, укажите степени окисления азота в каждом из них. Какой из этих оксидов более сильный окислитель? На основании электронных уравнений закончите уравнение реакции, учитывая, что азот приобретает минимальную степень окисления: KNO2 + Al + KOH + H2O = KAlO2 + … Решение. Формула Наименование оксида Степени окисления N2O оксид азота(I) +1 NO оксид азота(II) +2 N2O3 оксид азота(III) +3 NO2 оксид азота(IV) +4 N2O5 оксид азота(V) +5 Наиболее сильным окислителем является оксид азота (V), так как в этом соединении азот имеет максимальную степень окисления. Определим, какие вещества образуются в результате реакции, приведенной в условии задачи. Минимальная степень окисления азота равна (–3). Она реализуется в аммиаке и ионе аммония NH4+. Среда щелочная, следовательно, образуется аммиак: KNO3 + KOH + Al + H2O = KAlO2 + NH3. Составим электронные уравнения: 8 | Al0 – 3 3 | С учетом коэффициентов, уравнение реакции будет иметь вид: 8Al + 3KNO3 + 5KOH + 2H2O = 8KAlO2 + 3NH3. |
