химия. Методические указания и контрольные задания для студентов заочников инженернотехнических (нехимических)
 Скачать 2.15 Mb. Скачать 2.15 Mb.
|
|
Раздел химии, в котором изложено количественное изучение тепловых эффектов реакций, называется термохимией. Было установлено, что если при образовании соединения выделяется какое-то количество теплоты, то при разложении этого соединения в тех же условиях то же количество теплоты поглощается. Таким образом, в любом процессе соблюдается закон сохранения энергии: Q = U + A. Это равенство показывает, что если к системе подвести теплоту Q, то она расходуется на изменение ее внутренней энергии U = U2 U1 и на совершение работы A. Если давление постоянно, то Qp = U + PV. Сумму U + PV обозначили H и назвали энтальпией (теплосодержанием) системы. Стандартной энтальпией образования H0 называется изменение энтальпии в реакции образования 1 моля химического соединения из простых веществ при стандартных условиях (298 К, 101325 Па). Энтальпия образования простых веществ приравнивается к нулю. Запишем термохимическое уравнение реакции образования хлорида меди: Cu(К) + Cl2(Г) = CuCl2(К) H0 ? Мольная масса хлорида меди 134,44 г/моль. При образовании 8,10 г этой соли выделилось 13,39 кДж тепла. Чтобы найти стандартную энтальпию, рассчитаем количество теплоты, выделяющееся при образовании 134,44 г (1 моля) хлорида меди: H0 = 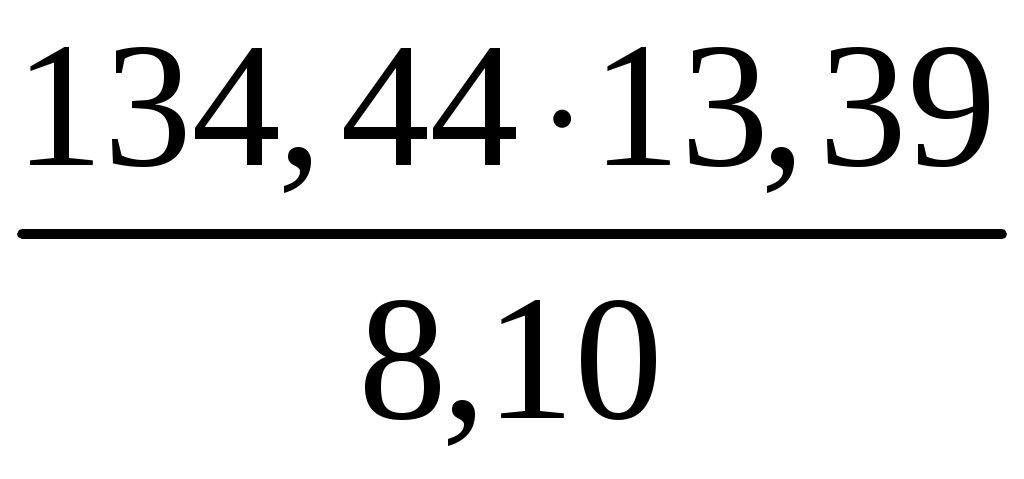 = 222,24 кДж. = 222,24 кДж.Пример 2. Вычислите теплоту образования оксида железа, исходя из уравнения 8Al + 3Fe3O4 = 4Al2O3 + 9Fe, H0 = 3326 кДж. Энтальпия образования оксида алюминия равна 1669 кДж/моль. Решение. В основе термохимических расчетов лежит закон Гесса: «Тепловой эффект реакции зависит только от конечного и начального состояния веществ и не зависит от промежуточных стадий процесса». Часто в термохимических расчетах используется следствие из закона Гесса: «Тепловой эффект реакции равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом коэффициентов реакции»: H0х.р. = Распишем тепловой эффект реакции восстановления железа, используя следствие из закона Гесса: H0х.р. = (9 · H0(Fe) + 4 · H0(Al2O3) (8 · H0(Al) + 3 · H0(Fe3O4). Поскольку энтальпии образования простых веществ равны нулю, а теп-ловой эффект реакции и энтальпия образования оксида алюминия даны в условии задачи, то можно рассчитать энтальпию образования оксида железа. 3326 = [9 · 0 + 4 · (1669)] (2 · 0 + 3H0(Fe3O4), H0(Fe3O4) = Пример 3. Вычислите энтальпию перехода графита в алмаз, если известно, что энтальпия образования CO2 из графита равна 393,5 кДж/моль, а из алмаза 395,4 кДж/моль. Решение. Разность энтальпий реакций, идущих от различных начальных фазовых состояний к одинаковому конечному состоянию продукта, есть энтальпия фазового перехода. Энтальпию перехода графита в алмаз измерить непосредственно невозможно, но ее можно рассчитать по разности энтальпий сгорания графита и алмаза. Распишем эти термохимические уравнения: 1. С(графит) + O2 (Г) = CO2(Г), H1 = 393,3 кДж, 2. С(алмаз) + O2(Г) = CO2(Г), H2 = 395,4 кДж, H0превращ. = H0сгорания С(гр.) Hсгорания С(алмаза) = H1 H2 = = [(393,3) (395,4)] = 2,1 кДж. Задания 81. Вычислите тепловой эффект реакции восстановления 1 моль Fe2О3 металлическим алюминием. Ответ: –847,7 ,кДж. 82. Газообразный этиловый спирт С2H5ОН можно получить при взаимодействии этилена С2H4 (г) и водяных паров. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Ответ: –45,76 кДж. 83. Вычислите тепловой эффект реакции восстановления оксида железа(II) водородом, исходя из следующих термохимических уравнений: FeO (к) + СО (г) = Fe (к) + СО2 (г); H = –13,18 кДж СО (г)+ 1/2O2 (г) = СО2, (г); H = –283,0 кДж Н2 (г) + 1/2О2 (г) = Н20 (г); H = –241,83 кДж Ответ: +27,99 кДж. 84. При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод CS2 (г). Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Ответ: +65,43 кДж. 85. Напишите термохимическое уравнение реакции между СО (г) и водородом, в результате которой образуются СН4 (г) и H2O (г). Сколько теплоты выделится при этой реакция? Ответ: 206,16 кДж. 86. При взаимодействии газообразных метана и сероводорода образуются сероуглерод CS2 (г) и водород. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Ответ: +230,43 кДж. 87. Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлорида водорода Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака в пересчете на нормальные условия? Ответ: 78,97 кДж. 88. Вычислите энтальпию образования метана, исходя из следующих термохимических уравнений: H2 (г) + 1/2О2 (г) = Н2О (ж) H = –285,84 кДж С (к) + О2, (г) = СО2, (г); H =.–393,51 кДж СН4 (г) + 2О2, (г) = 2Н2О (ж) + СО (г); H = –890,81 кДж Ответ: –74,88 кДж. 89. Вычислите энтальпию образования гидроксида кальция, исходя из следующих термохимических уравнений: Са (к) + 1/2О2, (г) = СаО (к); H = –635,60 кДж Н2, (г) +1/2О2 (г) = Н2О (ж); H = –285,84 Дж СаО (к) + Н2О (ж) = Са(ОН)2 (к); H = –65,06 кДж Ответ; –986,50 кДж. 90. Тепловой эффект реакции сгорания жидкого бензола с образованием паров воды и диоксида углерода равен –3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите энтальпию образования С6Н6(ж). Ответ: +49,03 кДж. 91. При взаимодействии трех молей оксида азота N2O с аммиаком образуются азот и пары воды. Тепловой эффект реакции равен –877,76 кДж. Напишите термохимическое уравнение этой реакции и вычислите энтальпию образования N2O (г). Ответ: +81,55 кДж. 92. При сгорании газообразного аммиака образуются пары воды и оксид азота NO (г). Напишите термохимическое уравнение этой реакции, вычислив, ее тепловой эффект в расчете на 1 моль NH3 (г). Ответ: –226,18 кДж. 93. Реакция горения метилового спирта выражается термохимическим, уравнением: СН3ОН (ж) + 3/2О2 (г) = СО2, (г} + 2Н2О (ж); H = ? Вычислите тепловой аффект этой реакции, если известно, что мольная теплота парообразования СН3ОН (ж) равна +37,4 кДж. Ответ: –726,62 кДж. 94. Напишите термохимическое уравнение реакции горения 1 моль этилового спирта, в результате которой образуются пары воды и оксид углерода(IV). Вычислите энтальпию образования C2H5OH (ж), если известно, что при сгорании 11,5 г его выделилось 308,71 кДж теплоты. Ответ: –277,67 кДж. 95. Реакция горения бензола выражается термохимическим уравнением: С6Н6 (ж) + 71/2О2, (г) = 6CО2 (г) + ЗН2О (г); H = ? Вычислите тепловой эффект этой реакции, если известно, что мольная энтальпия парообразования бензола равна +33,9 кДж. Ответ: –3135,58 кДж. 96. Вычислите тепловой эффект и напишите термохимическое уравнение реакции горения I моль этана С2Н6 (г), в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании 1 м3 этана в пересчете на нормальные условия? Ответ: 63742,86 кДж. 97. Реакция горения аммиака выражается термохимическим уравнением: 4NH3, (г) + ЗО2, (г) = 2N2, (г) + 6Н2О (ж); H = –1530,28 кДж Вычислите энтальпию образования NH3 (г). Ответ: –46,19 кДж. 98. Энтальпия растворения безводного хлорида стронция SrCl2 –47,70 кДж, а энтальпия растворения кристаллогидрата SrCl26H2O +30,96 кДж. Вычислите энтальпию гидратации SrCl2. Ответ: –78,66 кДж. 99. Энтальпии растворения сульфата меди CuSO4 и медного купороса CuSO45H2O соответственно равны –66,11 кДж и +11,72 кДж. Вычислите энтальпию гидратации: CuSO4. Ответ: –77,83 кДж. 100. При получении молярной массы эквивалента гидроксида кальция из СaO (к) и H2O (ж) выделяется 32,53 кДж теплоты. Напишите термохимическое уравнение этой реакции и вычислите энтальпию образования оксида кальция. Ответ: –635,6 кДж. Химическое сродство Пример 1. Вычислите изменение энтропии в реакции горения этана: C2H4(Г) + 3O2(Г) = 2CO2(Г) + 2H2O(Г). Решение. Термодинамическая функция энтропия (S) характеризует возможные состояния вещества и их непрерывные изменения. Частицы вещества атомы, молекулы, ионы и. т. д. совершают непрерывные колебательные и другие виды движения, переходя в каждый момент времени из одного микросостояния в другое. Чем больше таких изменений, тем больше беспорядок в системе, количественной характеристикой которого и служит энтропия. Так, газообразное состояние более неупорядочено по сравнению с жидким, поэтому переход жидкости в газ (испарениe, кипение) сопровождается увеличением энтропии. Энтропия возрастает также в реакциях, идущих с увеличением объема, усложнением состава молекул, повышением температуры. Чтобы можно было сравнивать энтропии различных веществ, пользуются стандартной энтропией S0. Величины стандартных энтропий приведены в термодинамических таблицах [14]. Энтропия, как и энтальпия, является функцией состояния, т. е. подчиняется закону Гесса и следствию из него: S0х.р. = По условию задачи нужно вычислить S0 реакции горения этана. Для этого из таблицы [1] выпишем энтропии образования веществ и подставим их в уравнение: Вещество C2H4 (Г) O2 (Г) CO2 (Г) H2O(Г), S0, Дж/мольК 219,45 205,03 213,65 188,72, S0х.р. = [2S0(H2O) + 2S0(CO2)] [S0(C2H4) + 3S0(O2)] = = (2 188,72 + 2 213,65) (219,45 + 3 205,03) = 29,80 ДжK. Пример 2. Возможна ли в стандартных условиях реакция 4HCl + O2 = 2H2O + 2Cl2? Решение. Для процессов, протекающих в природе самопроизвольно, характерно стремление к минимуму энергии, т. е. понижение энтальпии и стремление перейти в наиболее вероятное состояние с максимально допустимой в данных условиях степенью беспорядка, т. е. повышение энтропии. Для реакций, протекающих при постоянном давлении и температуре, введена термодинамическая функция G энергия Гиббса (изобарно-изотермический потенциал), определяющая влияние энтальпии и энтропии на ход реакции. Энергия Гиббса является функцией состояния и расчет ее ведут по формулам: G0х.р. = H0х.р. T S0х.р., (1) G0х.р. = По знаку и величине энергии Гиббса можно судить о направлении реакции. Если G0 < 0, возможно самопроизвольное протекание реакции в прямом направлении; если G0 = 0, то в системе наступает состояние равновесия. Чтобы ответить на вопрос, поставленный в условии задачи, необходимо рассчитать энергию Гиббса реакции горения хлороводорода. Выпишем из справочных таблиц [1] необходимые данные: Вещество HCl (Г) O2 (Г) CI2 (Г) H2O (Г), H0, кДж/моль 92,31 0 0 241,83, S0, Дж/мольК 186,68 205,03 222,95 188,72, H0х.р. = 2H0(H2O) + 2H0(Cl2) 4H0(HCl) + H0(O2 ) = = (2 (241,83) + 2 0] [4 (92,31) + 0] = 112 кДж, S0х.р. = [2S0(H2O) + 2S0(Cl2)] 4S0(HCl) + 3S0(O2)] = = (2 188,72 + 2 222,95) (4 186,68 + 205,03) = 130 ДжK = = 0,13 кДжК, G0х.р. = H0х.р TS0х.р., G0х.р. = (112) 298 (0,13) = 73,36 кДж. Энергия Гиббса химической реакции меньше нуля, следовательно, в стандартных условиях эта реакция возможна. Пример 3. При какой температуре наступит равновесие в системе BaO(кр.) + 0,5 O2(Г) BaO2(кр.), если H0х.р. = 81,51 кДж, а S0х.р. = 0,11 кДжК? Решение. В состоянии равновесия энергия Гиббса равна нулю, G = H TS, если G = 0, то H = TS. Из этого равенства можно рассчитать температуру, при которой наступит равновесие в системе: Тр = 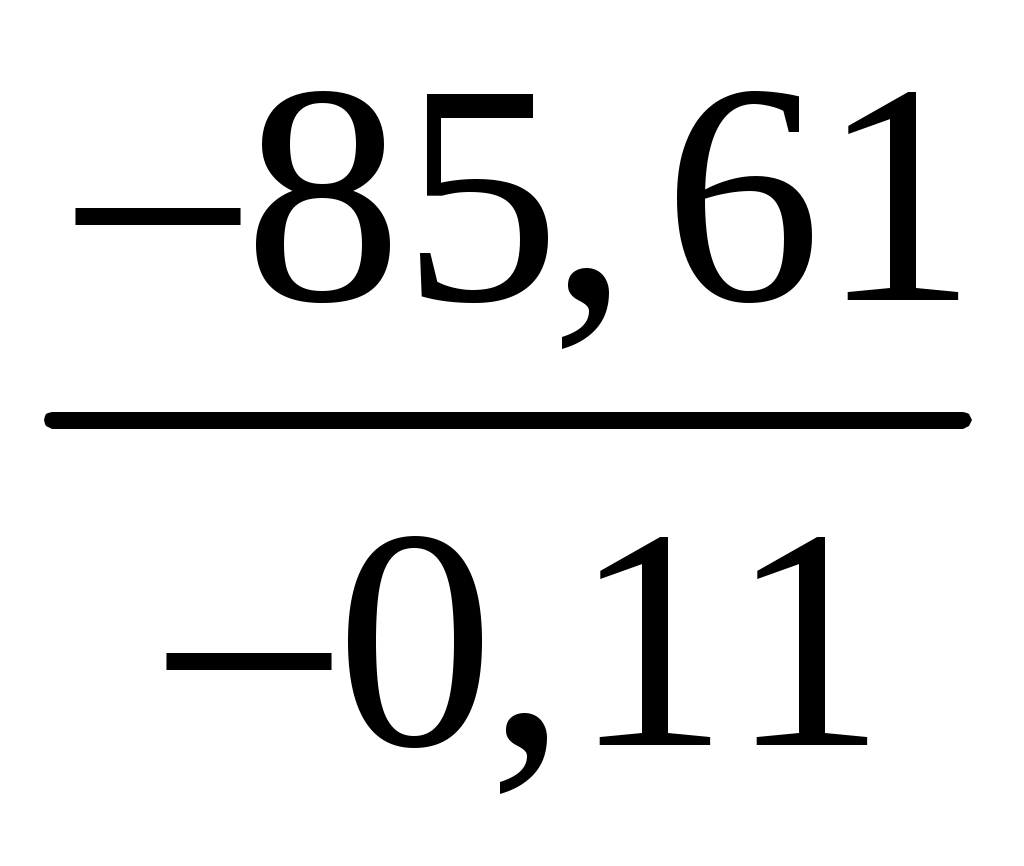 = 731,9 К или 458,9 С. = 731,9 К или 458,9 С.Задания 101. Энтальпии образования Н0298 оксида(II) и оксида(IV) азота соответственно равны +90,37 кДж и +33,85 кДж. Определите S0298 и G0298 для реакций получения NO и NO2 из простых веществ. Можно ли получить эти оксиды при стандартных условиях? Какой из оксидов образуется при высокой температуре? Почему? Ответ: +11,94 Дж/(моль К); –60,315 Дж/(моль К); +86,81 кДж; +51,82 кДж. 102. При какой температуре наступит равновесие системы 4HCI (г)+О2 (г) 2Н2О (г) + 2С12 (г); H = –114,42 кДж? Хлор или кислород в этой системе является более сильным окислителем и при каких температурах? Ответ: 891 К. 103. Восстановление Fe3О4 оксидом углерода идет по уравнению Fe3O4 (к) + СО (г) 3FеO (к) + СО2 (г). Вычислите G0298 и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно S0298 в этом процессе? Ответ: +24,19 кДж; +31,34 ДжК. 104. Реакция горения ацетилена идет по уравнению С2Н2 (г) + 5/2О2 (г) = 2СО2 (г) + Н2О (ж) Вычислите G0298 и S0298. Объясните уменьшение энтропии в результате этой реакции. Ответ: –1235,15 кДж; –216,15 ДжК. 105. Уменьшается или увеличивается энтропия при переходах: а) воды в пар; б) графита в алмаз? Почему? Вычислите S0298 для каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях. Ответ: а) 118,78 Дж/(моль К); б) –3,25 Дж/(моль К). 106. Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция Н2 (г) + СО2 (г) = СО (г) + Н2О (ж); H = –2,85 кДж Зная тепловой эффект реакции и абсолютные стандартные энтропии соответствующих веществ, определите G0298 этой реакции. Ответ: +19,91 кДж. 107. Прямая или обратная реакция будет протекать при стандартных условиях в системе 2NO (г) + O2 (г) 2NO2 (г) Ответ мотивируйте, вычислив G0298 прямой реакции. Ответ:–69,70 кДж. 108. Исходя из значений стандартных энтальпий образования и абсолютных стандартных энтропий соответствующих веществ, вычислите G0298 реакции, протекающей по уравнению NH3 (г) + HCl (г) = NH4CI (к) Может ли эта реакция при стандартных условиях идти самопроизвольно? Ответ: –92,08 кДж. 109. При какой температуре наступит равновесие системы CO (г) + 2Н2 (r) СH3OH (ж); Н = –128,05 кДж Ответ: 385,5 К. 110. Эндотермическая реакция взаимодействия метана с диоксидом углерода протекает по уравнению СH4 (г) + СO2 (г) = 2СО (г) + 2Н2 (г); H = + 247,37 кДж При какой температуре начнется эта реакция? Ответ: 961,9 К. 111. Определите G0298 реакции, протекающей по уравнению 4NH3 (г) +5O2 (r) = 4NO (г) + 6Н2О (г) Вычисления сделайте на основании стандартных энтальпий образования и абсолютных стандартных энтропий соответствующих веществ. Возможна ли эта реакция при стандартных условиях? Ответ: –957,77 кДж. 112. На основании стандартных энтальпий образования и абсолютных стандартных энтропий соответствующих веществ вычислите G0298 реакции, протекающей по уравнению СО2 (г) + 4Н 2 (г) = СН4 (г) + 2H2O (ж) Возможна ли эта реакция при стандартных условиях? Ответ: –130,89 кДж. 113. Вычислите изменение энтропии в результате реакции образования аммиака из азота и водорода. При расчете можно исходить из S0298 соответствующих газов, так как S с изменением температуры изменяется незначительно. Чем можно объяснить отрицательные значения S? Ответ: –198,26 кДж/(моль К). 114. Какие из карбонатов: ВеСО3, CaCO3 или ВаСО3 можно получить по реакции взаимодействия соответствующих оксидов с CO2? Какая реакция идет наиболее энергично? Вывод сделайте, вычислив G0298 реакций. Ответ: +31,24 кДж; –130,17 кДж; –216,02 кДж. 115. На основании стандартных энтальпий образования и абсолютных стандартных энтропий соответствующих веществ вычислите G0298 реакции, протекающей по уравнению СО (г) + ЗН2 (г) = СН4 (г) + Н2О (г) Возможна ли эта реакция при стандартных условиях? Ответ: –142,16 кДж. 116. Образование сероводорода из простых веществ протекает по уравнению Н2 (г) + S (ромб.) = H2S (г); H = –20.15 кДж Исходя из значений S0298 соответствующих веществ, определите S0298 и G0298 для этой реакции. Ответ: +43,15 ДжК); –33,01 кДж. 117. На основании стандартных энтальпий образования и абсолютных стандартных энтропий соответствующих веществ вычислите G0298 реакции, протекающей по уравнению С2Н4 (г) + 3О2 (г) = 2СО2 (г) + 2Н2О (ж) Возможна ли эта реакция при стандартных условиях? Ответ: –1331,21 кДж. 118. Определите, при какой температуре начнется реакция восстановления Fe3O4, протекающая по уравнению Fe3О4 (к) + СО (г) = 3FeO (к) + СО2 (г); H = +34,55 кДж Ответ: 1102,4 К. 119. Вычислите, при какой температуре начнется диссоциация пентахлорида фосфора, протекающая по уравнению PCI5 (г) = PCI3 (г) + Cl2 (г): H = +92,59 кДж Ответ: 509 К. 120. Вычислите изменение энтропии для реакций, протекающих по уравнениям: 2СН4 (г) = C2H2 + ЗН2 (г) N2 (г) + ЗН2 (г) = 2NH3 (г) С(графит) + О2 (г) = СО2 (г) Почему в этих реакциях S0298 >0; <0; 0? Ответ: 220,21 ДжК; –198,26 ДжК; 2,93 ДжК. Химическая кинетика и равновесие Пример 1. Как изменится скорость реакции образования аммиака N2 + 3H2 2NH3, если увеличить давление в системе в два раза и увеличить объем газовой смеси в три раза? Решение. Для того чтобы началась химическая реакция, необходимо выполнение условия G < 0. Это условие необходимо, но недостаточно. Оно указывает на то, что нет энергетического запрета на протекание реакции, однако скорость ее может быть настолько мала, что реакция практически не идет. |
