химия. Методические указания и контрольные задания для студентов заочников инженернотехнических (нехимических)
 Скачать 2.15 Mb. Скачать 2.15 Mb.
|
|
Пример 1. Составьте формулы комплексных ионов для, Cu2+, Au3+, Ag+, в которых их координационные числа равны четырем, а лигандами являются следующие нейтральные молекулы и ионы: NH3, Cl–, S2O Решение. Комплексные соединения состоят из центрального атома в той или иной степени окисления (чаще это бывают переходные металлы), называемого комплексообразователем. Вокруг него координируются ионы противоположного знака или нейтральные молекулы, называемые лигандами, число которых определяется координационным числом комплексообразователя. Комплексообразователь и лиганды образуют внутреннюю координационную сферу, которая при записи заключается в квадратные скобки. Все, что находится за скобками, – это внешняя координационная сфера. Заряды внутренней и внешней координационных сфер равны по величине и противоположны по знаку, т. е. в комплексном соединении, как и в любой молекуле, сумма степеней окисления равна нулю. В условии задачи даны ионы комплексообразователи Cu2+, Au3+, Ag+, а их координационные числа равны 4, т. е. они присоединяют четыре лиганда. Комплексные ионы будут иметь вид: [Cu(NH3)4]2+; [Ag(NH3)4]+; [CuCl4]2–; [AgCl4]3–; [Cu(S2O3)4]6–; [Ag(S2O3)4]7–; [Au(NH3)4]3+; [Au(S2O3)4]5–; [AuCl4]–. Пример 2. Составьте формулы всех возможных комплексных соединений, используя в качестве комплексообразователя Co3+ (координационное число его равно шести), в качестве лигандов – NH3, NO Решение. Поскольку координационное число иона кобальта равно 6, во внутренней координационной сфере должно быть 6 лигандов. Заряды внутренней и внешней координационных сфер в сумме равны нулю. Учитывая эти правила, можно составить следующие комплексные ионы и соответствующие им комплексные соединения: 1. [Co(NH3)6]3+, [Co(NH3)6](NO2)3. 2. [Co(NH3)5(NO2)]2+, [Co(NH3)5(NO2)](NO2)2. 3. [Co(NH3)4(NO2)2]+, [Co(NH3)4(NO2)2](NO2). 4. [Co(NH3)3(NO2)3]0, [Co(NH3)3(NO2)3]. 5. [Co(NH3)2(NO2)4]–, K[Co(NH3)2(NO2)4]. 6. [Co(NH3)(NO2)5]2–, K2[Co(NH3)(NO2)5]. 7. [Co(NO2)6]3–, K3[Co(NO2)6]. Пример 3. Распишите, как диссоциируют в растворе следующие комплексные соединения, напишите выражения для констант нестойкости их комплексных ионов: [Zn(NH3)4]Cl2; K2[PtCl6]; K4[Mo(CN)8]; Ba[Pt(NO3)4Cl2]; [Co(NH3)3(H2O)3]Cl3; [Cr(H2O)3Cl3]. Решение. Диссоциация комплексных соединений определяется характером связи в них. Между внутренней и внешней сферами связь ионного типа, поэтому по первой ступени идет полностью диссоциация с образованием комплексного иона и ионов внешней координационной сферы. Во внутренней сфере связь между комплексообразователем и лигандами ковалентная (образована по донорно-акцепторному механизму), прочная, поэтому диссоциация по второй ступени идет незначительно и также ступенчато. Диссоциация комплексного иона, как и любого слабого электролита, процесс обратимый и характеризуется константой равновесия, называемой в данном случае константой нестойкости комплексного иона (КН). Учитывая вышесказанное, напишем уравнения диссоциации и константы нестойкости комплексных ионов: 1. [Zn(NH3)4]Cl2 [Zn(NH3)4]2+ + 2Cl–. 2. [Zn(NH3)4]2+ Zn2+ + 4NH3, КН = 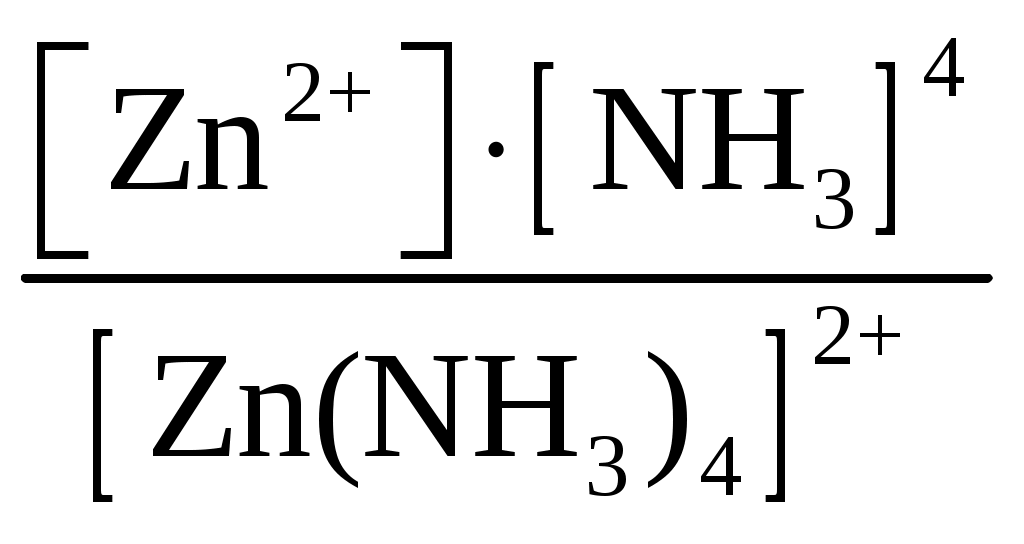 . .1. K2[PtCl6] 2K+ + [PtCl6]2–. 2. [PtCl6]2– Pt4+ + 6Cl–, КН = 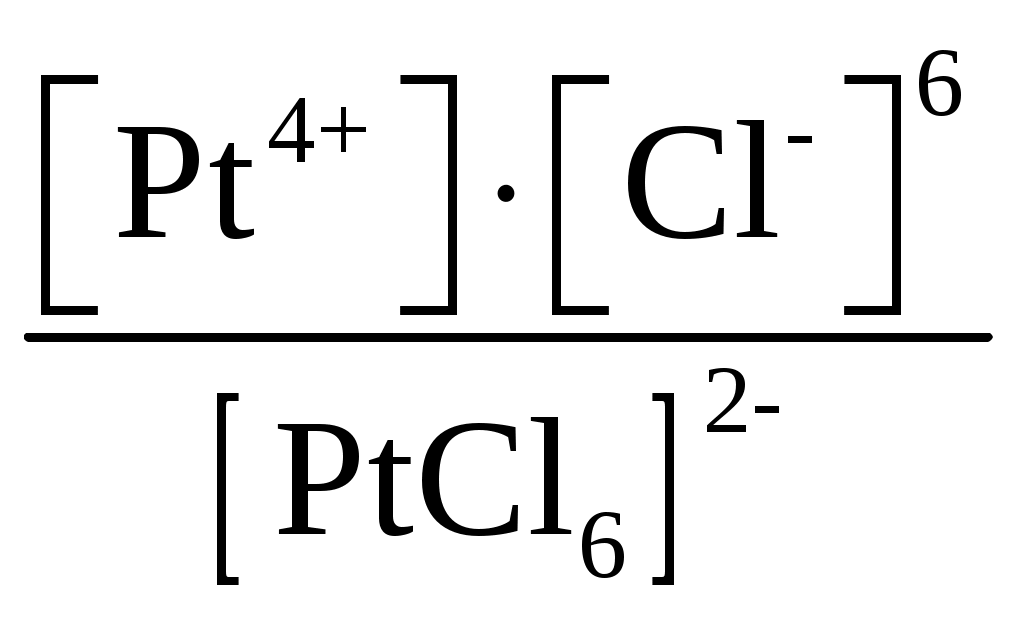 . .1. K4[Mo(CN)8] 4K+ + [Mo(CN)8]4–. 2. [Mo(CN)8]4– Mo4+ + 8CN–, КН = 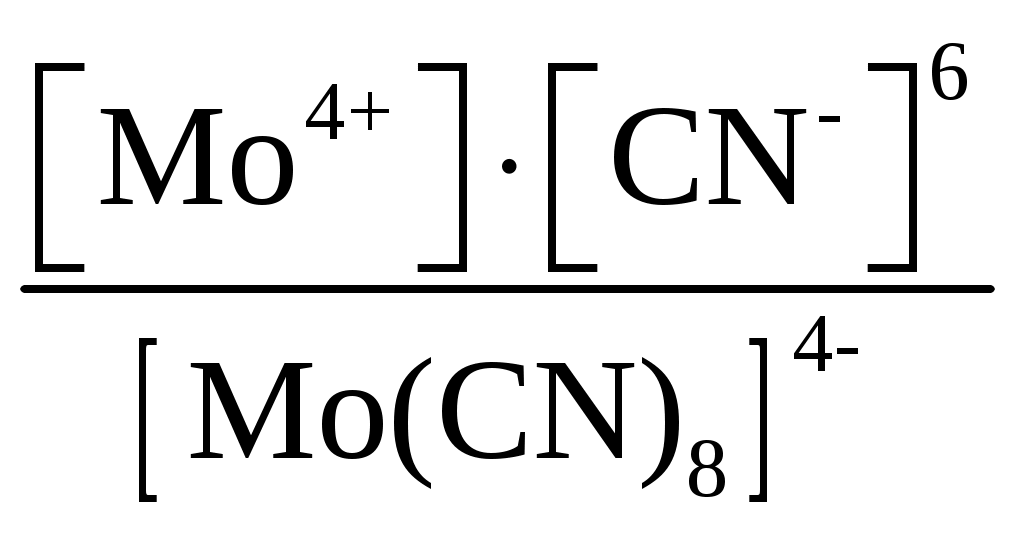 . .1. Ba[Pt(NO3)4Cl2] Ba2+ + [Pt(NO3)4Cl2]2–. 2. [Pt(NO3)4Cl2]2– Pt4+ + 4NO3– + 2Cl–, КН = 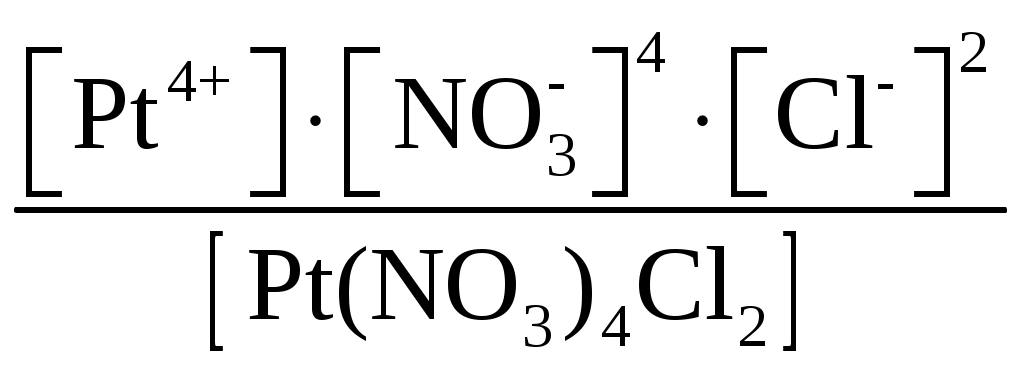 . .1. [Co(NH3)3(H2O)3]Cl3 [Co(NH3)3(H2O)3]3+ + 3Cl–. 2. [Co(NH3)3(H2O)3]3+ Co3+ + 3NH3 + 3H2O, КН = 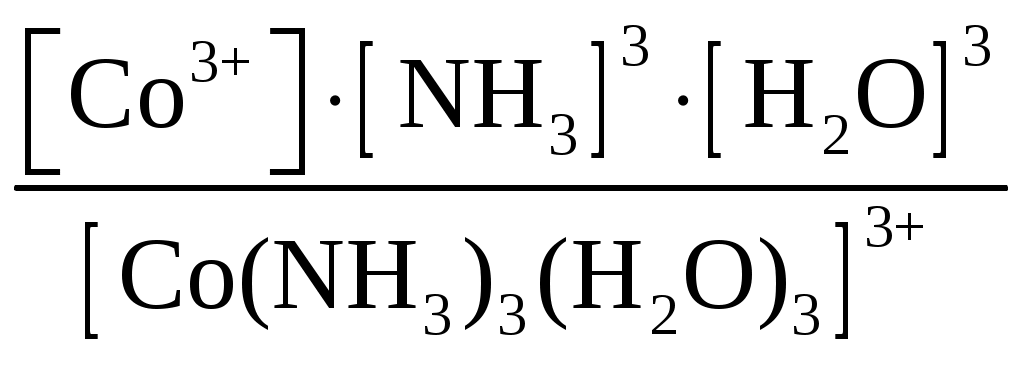 . .1. [Cr(H2O)3Cl3] Cr3+ + 3H2O + 3Cl–, КН = 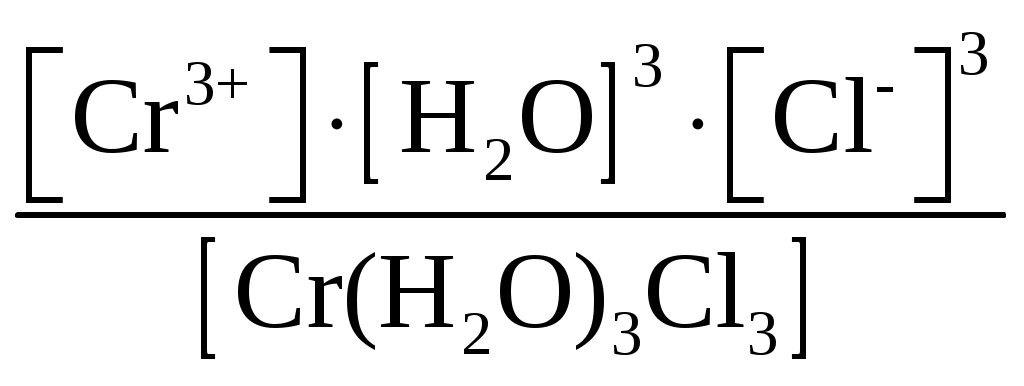 . .Последнее комплексное соединение относится к типу комплексных неэлектролитов, практически очень трудно разрушить его внутреннюю сферу. Пример 4. Константы нестойкости комплексных ионов: [Ag(CN)2]–, [Au(CN)2]–, [Cu(CN)2]–, имеют значения соответственно: 1 10–21, 5 10–39, 1 10–16. Какой из этих ионов самый прочный? Напишите выражения для констант нестойкости комплексных ионов. Решение. Мерой устойчивости комплексного иона служит его константа нестойкости Кн; чем больше ее значение, тем ниже устойчивость комплексного иона. Напишем константы нестойкости: КН = 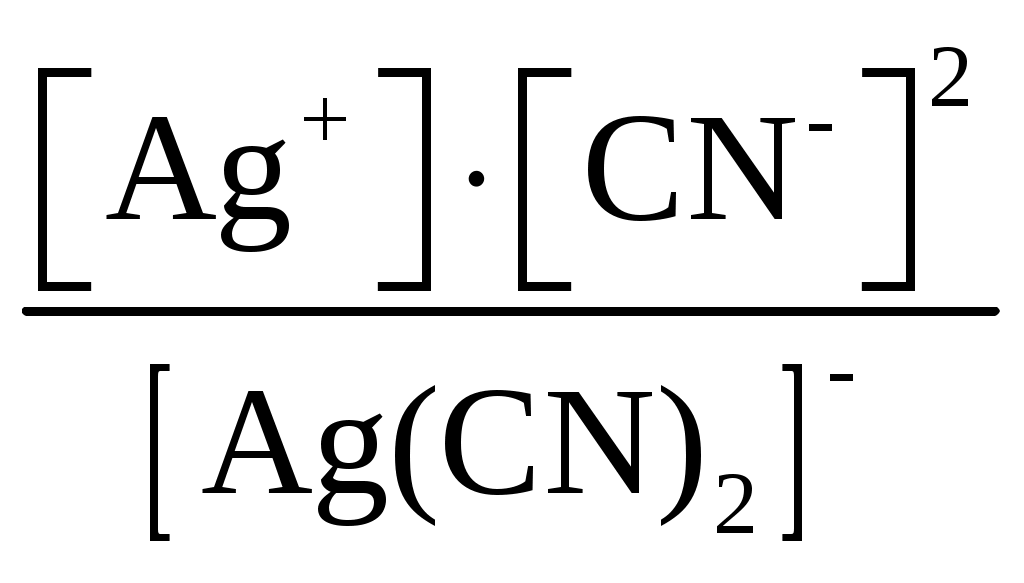 ; КН = ; КН = 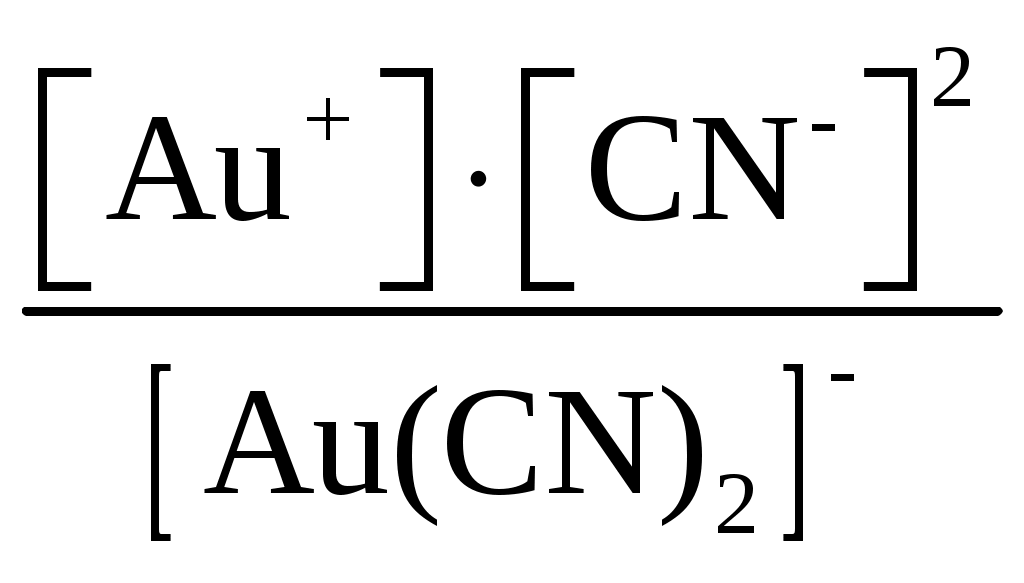 ; КН = ; КН = 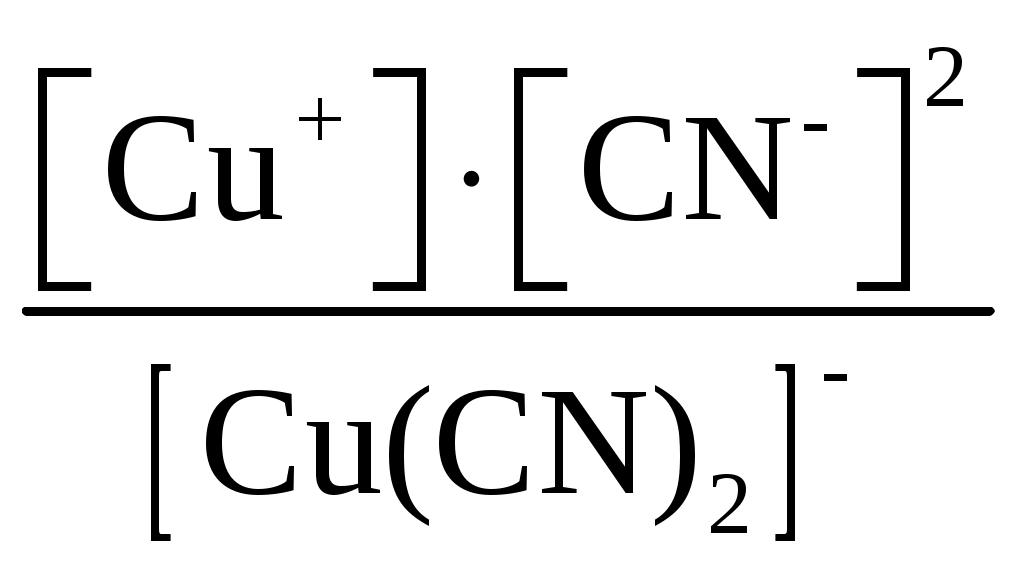 Самый прочный комплексный ион из приведенных [Au(CN)2]–, так как величина его константы нестойкости имеет наименьшее значение. Задания 301. Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях [Cu(NH3)4]SO4, K2[PtCI6], K[Ag(CN)2]. Напишите уравнения диссоциации этих соединений в водных растворах. 302. Составьте координационные формулы следующих комплексных соединений платины: PtCl46NH3, PtCI44NH3, PtCl4 2NH3. Координационное число платины(IV) равно шести. Напишите уравнения диссоциации этих соединений в водных растворах. Какое из них является комплексным неэлектролитом? 303. Составьте координационные формулы следующих комплексных соединений кобальта: СоСl36NН3, СоСl35NН3, CoCl3 4NH3. Координационное число кобальта(+3) равно шести. Напишите уравнения диссоциации этих соединений в водных растворах. 304. Определите, чему равны заряд комплексного иона, степень окисления и координационное число сурьмы в соединениях Rb[SbBr6], K[SbCl6], Na[Sb(SO4)2]. Как диссоциируют эти соединения в водных растворах? 305. Составьте координационные формулы следующих комплексных соединений серебра: AgCI2NH3, AgCNKCN, AgNO2NaNO2. Координационное число серебра(I) равно двум. Напишите уравнения диссоциации этих соединений в водных растворах. 306. Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях K4[Fe(CN)6], K4[TiCl8], K2[HgJ4]. Как диссоциируют эти соединения в водных растворах? 307. Из сочетания частиц Со3+, NH3, NO 308. Определите, чему равен заряд следующих комплексных ионов: [Cr(H2O)4CI2], [HgBr4], [Fe(CN)6], если комплексообразователями являются Cr3+, Hg2+, Fe3+, Напишите формулы соединений, содержащих эти комплексные ионы. 309. Определите, чему равен заряд комплексных ионов [Cr(NH3)5NO3], [Pd(NH3)Cl3], [Ni(CN)4], если комплексообразователями являются Cr3+, Pd2+, Ni4+. Напишите формулы комплексных соединений, содержащих эти ионы. 310. Из сочетания частиц Cr3+, H2O, С1– и К+ можно составить семь координационных формул комплексных соединений хрома, одна из которых [Cr(H2O)6]Cl3. Составьте формулы других шести соединений и напишите уравнения их диссоциации в водных растворах. 311. Составьте координационные формулы следующих комплексных соединении кобальта: 3NaNO2Co(NO2)3, CoCl33NH32H2O, 2KNO2NH3Co(NO2)3. Координационное число кобальта(III) равно шести. Напишите уравнения диссоциации этих соединений в водных растворах 312. Напишите выражения для констант нестойкости комплексных ионов [Ag(NH3)2]+, [Fe(CN)6]4-, [PtCl6]2–. Чему равны степень окисления и координационное число комплексообразователей в этих ионах? 313. Константы нестойкости комплексных ионов [Co(CN)4]2–, [Hg(CN)4]2–, [Cd(CN)4]2–соответственно равны 8I0–20, 410–41, 1,410–17. В каком растворе, содержащем эти ионы (при равной молярной концентрации), ионов CN– больше? Напишите выражения для констант нестойкости указанных комплексных ионов. 314. Напишите выражения для констант нестойкости следующих комплексных ионов: [Ag(CN)2]–, [Ag(NH3)2]+, [Ag(SCN)2]–. Зная, что они соответственно равны 1,010–21, 6,810–8, 2,010–11, укажите, в каком растворе, содержащем эти ионы (при равной молярной концентрации), больше ионов Ag+. 315. При прибавлении раствора KCN к раствору [Zn(NH3)4]SO4 образуется растворимое комплексное соединение K2[Zn(CN)4]. Напишите молекулярное и ионно-молекулярное уравнения реакции. Константа нестойкости какого иона: [Zn(NH3)4]2+ или [Zn(CN)4]2– больше? Почему? 316. Напишите уравнения диссоциации солей K3[Fe(CN)6] и NH4Fe(SO4)2 в водном растворе. К каждой из них прилили раствор щелочи. В каком случае выпадает осадок гидроксида железа? Напишите молекулярное и ионное уравнения реакции. Какие комплексные соединения называются двойными солями? 317. Составьте координационные формулы следующих комплексных соединений платины (II), координационное число которой равно четырем: PtCl23NH3, PtCl2NH3KCl, PtCl22NH3. Напишите уравнения диссоциации этих соединений в водных растворах. Какое из них является комплексным неэлектролитом? 318. Хлорид серебра растворяется в растворах аммиака и тиосульфата натрия. Дайте этому объяснение и напишите молекулярные и ионно-молекулярные уравнения соответствующих реакций. 319. Какие комплексные соединения называются двойными солями? Напишете уравнения диссоциации солей K4[Fe(CN)6] и (NH4)2Fe(SO4)2 в водном растворе. В каком случае выпадает осадок гидроксида железа, если к каждой из них прилить раствор щелочи? Напишите молекулярное и ионно-молекулярное уравнения реакции. 320. Константы нестойкости комплексных ионов [Co(NH3)6]3+, [Fe(CN)6]4–, [Fe(CN)6]3– соответственно равны 6,210–36; 1,010–37; 1,010–44. Какой из этих ионов является более прочным? Напишите выражения для констант нестойкости указанных комплексных ионов и формулы соединений, содержащих эти ноны. s-элементы Пример 1. Почему водород в периодической системе обычно помещают либо в первой группе и в то же время в скобках в седьмой, либо в седьмой группе и в то же время в скобках в первой. Приведите примеры реакций, доказывающих двойственную химическую природу водорода. Решение. Особенность строения электронной оболочки атома водорода (как и гелия), а именно отсутствие промежуточного электронного слоя (его валентный электрон находится непосредственно в сфере действия атомного ядра), не позволяет однозначно решить, в какой группе периодической системы он должен находиться. Если исходить из числа валентных электронов его атома, то водород должен находиться в первой группе. Однако, в отличие от щелочных металлов, водород вследствие высокого значения энергии ионизации не способен образовывать ионных соединений, в которых он был бы катионом. Его соединения, даже с наиболее активными неметаллами, например, фтором, представляют вещества с полярной ковалентной связью. Если же исходить из того, что для завершения внешнего энергетического слоя атому водорода не хватает одного электрона, его следует поместить в седьмую группу. Атом водорода, как и атомы галогенов, характеризуется высоким значением энергии ионизации. Таким образом, отдавая один электрон, водород проявляет сходство со щелочными металлами первой группы, а присоединяя электрон – с галогенами седьмой группы. Поэтому водород в периодической системе помещают либо в первой группе и в скобках в седьмой, либо в седьмой группе и в скобках в первой. Вместе с тем водород – элемент особый и его размещение в той или иной группе таблицы в значительной мере условно. Из вышесказанного следует, что в химических процессах водород может выступать в качестве восстановителя при взаимодействии с окислителями, например, хлором: Водород может проявлять и окислительные свойства при взаимодействии с сильными восстановителями, например, щелочными металлами: 2Me + 2 Степень окисления водорода в образующихся гидридах металлов – (1), химическая связь в них ионного типа, в галогеноводородах химическая связь – ковалентная полярная. |
