химия. Методические указания и контрольные задания для студентов заочников инженернотехнических (нехимических)
 Скачать 2.15 Mb. Скачать 2.15 Mb.
|
|
Пример 2. К растворам NaCl, HNO3, CuSO4, KNO3 прибавили раствор гидроксида натрия. В каком случае произошла реакция? Напишите молекулярные и ионные уравнения этих реакций. Решение. Чтобы определить, произошла или нет реакция, распишем молекулярные и ионные уравнения: 1. NaCl + NaOH = NaOH + NaCl, Na+ + Cl + Na+ + OH = Na+ + OH + Na+ + Cl. В левой и правой частях уравнения одни и те же ионы, нет никакого изменения, реакция не идет. 2. HNO3 + NaOH = NaNO3 + H2O, H+ + NO H+ + OH = H2O. Реакция протекает с образованием слабого электролита воды. 3. CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4, Cu2+ + SO Cu2+ + 2OH– = Cu(OH)2 Реакция протекает с образованием осадка гидроксида меди. 4. KNO3 +NaOH = KOH + NaNO3, K+ + NO Реакция не идет, левая и правая части уравнения идентичны. Задания 181. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) NaHCO3 и NаOH; б) K2SiО3 и НСl; в) BaCl2 и Na2SO4. 182. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) K2S и НСl; б) FеSO4 и (NH4)2S; в) Сг(ОН)3 и КОН. 183. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Mg2+ + СО б) Н+ + ОН– = Н2О 184. Какое из веществ: AI(OH)3, H2SO4, Ba(OH)2 будет взаимодействовать с гидроксидом калия? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями. 185. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) КНСОз и H2SO4 б) Zn(OH).2 и NaOH; в) CaCI2 и AgNO3,. 186. Составьте молекулярные и инонно-молекулярные уравнения взаимодействия в растворах между: a) CuSO4 и H2S , BaCO3 и HNO3, в) FeCI3 и КОH. 187. Составьте во три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Сu2+ + S2– = CuS б) SiО 188. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия а растворах между; a) Sn(OH)2 и НС1; б) BeSO4 и КОН; в) NH4Cl и Ba(OH)2. 189. Какое из веществ KHCO3, CH3COOH, NiSQ4, Na2S будет взаимодействовать с раствором серной кислоты? Выразите эти реакции молекулярными и ионно-молекулярными уравнениям. 190. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) Hg(NO3)2 и NaJ; б) Pb(NO3)2 и KJ в) CdSO4 и Na2S. 191. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) СаСO3 + 2Н+ = Ca2+ + H2O + CO2 б) А1(ОН)3 + ОH– =А1O в) РЬ2+ + 2J– =РbJ2. 192. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Ве(ОН)2 и NaOH; б) Сu(ОН)2 и HNO3; в) ZnOHNO3 и HNO3. 193. Составите, молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) Na3PO4 и CaCl2; б) К2СО3 и BaCI2; в) Zn(OH)2 и КОН. 194. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Fe (ОН)3 + 3Н+ = Fe3+ + 3Н2О в) Cd2+ + 2OH– = Cd(OH)2 в) H+ + NO 195. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) CdS и HCI; б) Cr(OH)3 и NaOH; в) Ва(ОН)2 и CoCI2. 196. Составьте молекулярные уравнения реакции, которые выражаются ионно-молекулярными уравнениями: а) Zn2+ + H2S = ZnS + 2H+ я) HCO в) Ag+ + Cl– = AgCI 197. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) H2SO4 и Ва(ОН)2; б) FeCl3 и NH4OH; в) CH3COONa и HCI. 198. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) FeCl3 и КОН; б) NiSO4 и (NH4)2S; в) MgCO3 и HNO3. 199. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Be (ОН)2 + 2 ОН– = BeO б) СН3СОО– + Н+ = СН3СООН в) Ba2+ + SO 200. Какое из веществ: NaCl, NiSO4, Ве(ОН)2, KHCO3 будет взаимодействовать с раствором гидроксида натрия. Выразите эти реакции молекулярными и ионно-молекулярными уравнениями. Гидролиз солей Пример 1. Какое значение pH (больше или меньше 7) имеют растворы следующих солей: Na2SO4, Na2S, NaCl, CuSO4? Ответ мотивируйте, составив молекулярные и ионные уравнения гидролиза соответствующих солей. Решение. Гидролиз солей это реакция обменного разложения между водой и ионами соли, ведущая к образованию слабого электролита, нарушающая диссоциацию воды и, как правило, изменяющая pH раствора. Поэтому гидролизу не подвергаются соли, образованные сильным основанием и сильной кислотой, так как они не могут дать слабых электролитов. Если гидролизу подвергаются многозарядные ионы, гидролиз всегда протекает ступенчато с преобладанием первой стадии и образованием основных и кислых солей. Гидролиз можно усилить, если раствор подогреть или сильно разбавить. Из солей, приведенных в условии задачи, NaCl и Na2SO4 образованы сильными основаниями и сильными кислотами, поэтому они гидролизу не подвергаются, pH растворов этих солей будет примерно равен 7. Соль Na2S образована сильным основанием NaOH и слабой кислотой H2S . Гидролиз пойдет по слабому звену аниону ступенчато: Na2S 2Na+ + S2, S2 + HOH HS + OH, Na2S + H2O NaHS + NaOH. Выше записано краткое ионное уравнение гидролиза. Чтобы написать на его основе молекулярное уравнение, необходимо к ионам краткого ионного уравнения дописать до компенсации зарядов противоионы от исходной соли, в данном случае ионы Na+. Соль CuSO4 образована слабым основанием Cu(OH)2 и сильной кислотой H2SO4. Гидролиз пойдет по слабому звену катиону Cu2+: CuSO4 Cu2+ + SO Краткое ионное уравнение гидролиза: Cu2+ + HOH (CuOH)+ + H+. Молекулярное уравнение гидролиза: 2CuSO4 + 2H2O (CuOH)2SO4 + H2SO4. Пример 2. Составьте молекулярные и ионные уравнения гидролиза, происходящего при сливании растворов Cr2(SO4)3 и H2S, зная, что образующийся сульфид хрома не существует в водной среде и полностью гидролизуется. Решение. При сливании растворов солей происходит следующая обменная реакция: Cr2(SO4)3 + 3K2S Cr2S3 + 3K2SO4. Соль K2SO4 образована сильным основанием KOH и сильной кислотой H2SO4 и гидролизу не подвергается. Соль Cr2S3 образована слабым основанием Cr(OH)3 и слабой кислотой H2S, поэтому гидролиз пойдет по катиону и по аниону до конца. Краткое ионное уравнение гидролиза соли Cr2S3: 2Cr3+ + 3S2- + 6HOH 2Cr(OH)3 + 3H2S. Молекулярное уравнение реакции с учетом гидролиза соли: Cr2(SO4)3 + 3K2S + 6H2O 3K2SO4 + 2Cr(OH)3 + 3H2S. Задания 201. Составьте ионно-молекулярное и молекулярное уравнения совместного гидролиза, происходящего при смешивании растворов K2S и AlCl3. Каждая из взятых солей гидролизуется необратимо до конца. 202. Какое значение рН (>7, 7 ,<7) имеют растворы солей МnСl2, Na2CO3, Ni(NO3)2? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. 203. Какие из солей Al2(SО4)3, K2S, Pb(NO3)2, КС1 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. 204. При смешивании растворов FeCl3 и Na2CO3, каждая из взятых солей гидролизуется необратимо до конца. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями. 205. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей CH3COOK, ZnSO4, AI(NO3)3. Какое значение рН (>7, 7, <7) имеют растворы этих солей? 206. Какое значение рН (>7, 7, <7) имеют растворы солей Li2S, А1Сl3, NiSO4? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. 207. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей РЬ(NO3)2, Na2CO3, CoCl2. Какое значение рН (>7, 7, <7) имеют растворы этих солей? 208. Составьте ионно-молекулярное и молекулярное уравнения гидролиза соли, раствор которой имеет: а) щелочную реакцию; б) кислую реакцию. . 209. Какое значение рН (>7, 7, <7) имеют растворы солей Na3PO4, K2S, CuSО4? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. 210. Составьте ионные и молекулярные уравнения гидролиза солей CuCl2, Cs2CO3, ZnCl2. Какое значение рН (>7, 7, <7) имеют растворы этих солей? 211. Какие из солей RbCI, Cr2(SO4)3, Ni(NO3)2 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. 212. При смешивании растворов CuSO4 и K2CO3 выпадает осадок основной соли (CuOH)2CO3 и выделяется CO2. Составьте ионно-молекулярное и молекулярное уравнения происходящего гидролиза 213. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей K2S, Cs2CO3, NiCl2, Рb(СН3СОО)2. Какое значение рН (>7, 7, <7) имеют растворы этих солей? 214. При смешивании растворов AI2(SO4)3 и Na2CO3 каждая из взятых солей гидролизуется необратимо до конца. Составьте ионно-молекулярное и молекулярное уравнения происходящего совместного гидролиза. 215. Какие из солей NaBr, Na2S, K2CO3, СоСl2 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. 216. Какие из солей KNO3, CrCl3, Cu(NО3)2, NаСN подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. 217. Составьте ионно-молекулярное и молекулярное уравнения совместного гидролиза, происходящего при смешивания растворов Сr(NО3)3 и Na2S? Каждая из взятых солей гидролизуется необратимо до конца. 218 Какое значение рН (>7, 7, <7) имеют растворы следующих солей: К3РO4, Рb(NОз)2, Na2S? Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей. 219. Какие из солей К2СО3, FeCl3, K2SO4, ZnCl2 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. 220. При смешивании растворов Al2(SO4)3 и Na2S каждая из взятых солей гидролизуется необратимо до конца. Выразите этот совместный гидролиз ионно-молекулярным и молекулярным уравнениями. КОНТРОЛЬНОЕ ЗАДАНИЕ 2 Окислительно-восстановительные реакции Пример 1. Какие из приведенных ниже реакций являются окислительно-восстановительными? Укажите для каждой из них окислитель и восстановитель. 1. Fe + 2HCl = FeCl2 + H2. 2. FeCl2 + 2NaOH = Fe(OH)2 + 2NaCl. 3. Ba(NO3)2 + K2SO4 = BaSO4 + 2KNO3. 4. 2KI + Cl2 = 2KCl + I2. Решение. Окислительно-восстановительными называются реакции, протекающие с изменением степеней окисления атомов. Степень окисления – это условный заряд, появляющийся на атоме в результате смещения электронного облака к более электроотрицательному атому. Степень окисления может быть отрицательной, положительной и нулевой. Окисление – это процесс отдачи электронов, сопровождающийся повышением степени окисления. Атомы, молекулы и ионы, отдающие электроны, называются восстановителями. Восстановление – процесс присоединения электронов, сопровождающийся понижением степени окисления. Атомы, молекулы и ионы, принимающие электроны, называют окислителями. Определим степени окисления атомов. 1. Железо и водород меняют степени окисления. Следовательно, данная реакция относится к окислительно-восстановительным: 2 2. 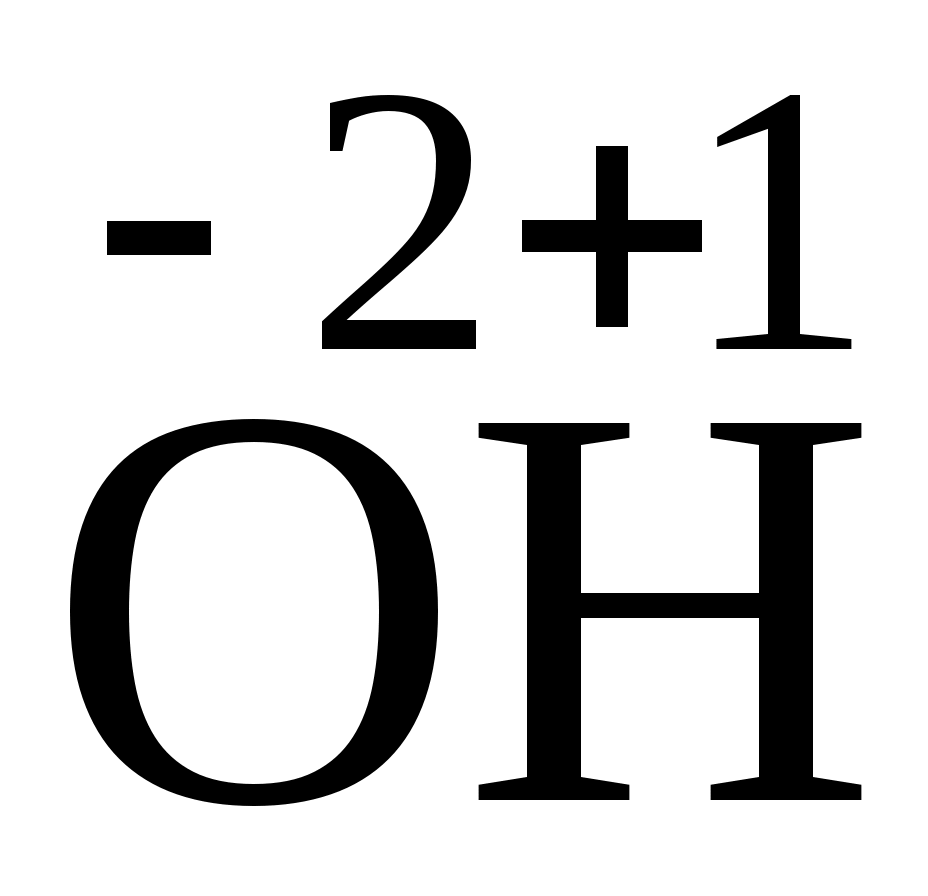 = = С тепени окисления атомов в веществах не изменяются, поэтому реакция не является окислительно-восстановительной. 3. Эта реакция также не относится к окислительно-восстановительным, степени окисления атомов постоянны. 4. 2K Хлор и йод меняют степени окисления, это окислительно-восстано-вительная реакция: 2 |
