химия. Методические указания и контрольные задания для студентов заочников инженернотехнических (нехимических)
 Скачать 2.15 Mb. Скачать 2.15 Mb.
|
|
Раздел химии, изучающий закономерности протекания химических реакций, называется химической кинетикой. Скорость химической реакции это изменение концентрации реагирующих веществ (или продуктов реакции) в единицу времени в единице объема: V = По условию задачи меняется объем и давление в системе, которые тесно связаны с изменением концентрации компонентов реакции. Зависимость скорости реакции от концентрации реагирующих веществ выражает закон действующих масс (з. д. м.): «При постоянной температуре скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные коэффициентам реакции». Аналитическая запись закона для реакции в общем виде следующая: aA + bB cC + dD, V = k[A]a [B]b, где k константа скорости реакции, равная скорости реакции при концентрации компонентов равной единице. Запишем уравнение реакции и по закону действующих масс выразим скорость реакции: N2 +3H2 2NH3, V = k[N2] [H2]3. Чтобы увеличить давление в системе в два раза, можно в два раза уменьшить объем, при этом во столько же раз увеличится концентрация каждого компонента и скорость реакции в этих случаях будет представлена формулой V' = k' [2N2] [2H2]3 = k' 16 [N2][H2]3. Найдем отношение скоростей реакций до и после увеличения давления: 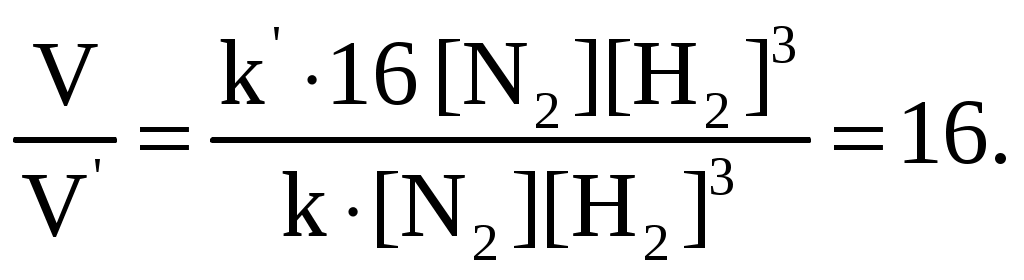 Таким образом, при увеличении давления в два раза скорость реакции увеличится в 16 раз. Увеличение объема газовой смеси в три раза равносильно уменьшению концентрации компонентов во столько же раз, и скорость реакции будет представлена формулой Найдем отношение скоростей до и после увеличения объема: 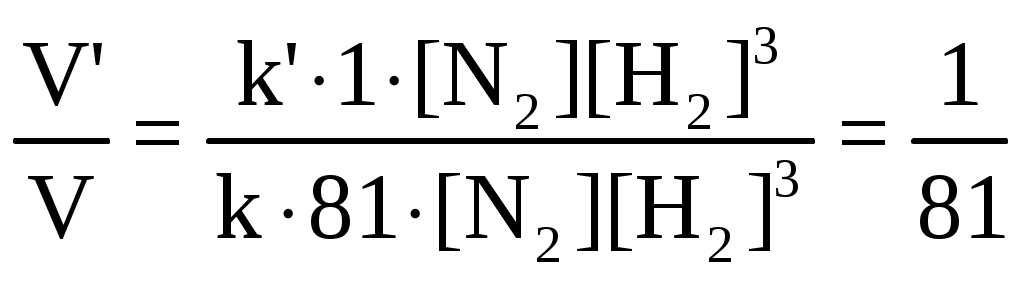 . .Итак, при увеличении объема газовой смеси в три раза, скорость химической реакции уменьшится в 81 раз. Пример 2. Вычислите температурный коэффициент скорости реакции, зная, что с повышением температуры на 60 С скорость возрастает в 128 раз. Решение. Зависимость скорости химической реакции от температуры выражается эмпирическим правилом ВантГоффа: «При повышении температуры на каждые 10 С скорость большинства реакций увеличивается в два четыре раза». где Vt2 скорость реакции при температуре t2; Vt1 скорость реакции при температуре t1; температурный коэффициент скорости реакции: Пример 3. Окисление аммиака идет по уравнению 4NH3 + 5O2 4NO + 6H2O. Через некоторое время концентрации веществ стали равными (моль/л): [NH3] = 0,009; [O2] = 0,002; [NO] =0,003. Вычислите концентрацию водяного пара в этот момент и исходные концентрации аммиака и кислорода. Решение. До начала реакции концентрации продуктов равны нулю, а через некоторое время концентрация [NO] стала равной 0,003 моль/л, т. е. [NO] = [NO] = 0,003. Изменение концентрации компонентов реакции происходит в строгом соответствии со стехиометрическим соотношениями, т. е. коэффициентами уравнения. Тогда [H2O] = [H2O], [H2O] : [NO] = 6 : 4, [H2O] : 0,003 = 6 : 4, [H2O] = (6 0,003) : 4 = 0,0045 моль/л, [H2O] = [H2O] = 0,0045 моль/л. Чтобы найти исходные концентрации аммиака и кислорода, необходимо рассчитать их убыль в ходе реакции и сложить с конечной концентрацией [NH4] и [O2]: [NH3] : [NO] = 4 : 4, [NH3] : 0,003 = 4 : 4, [H2O]: [O2] = 6 : 5, 0,0045: [O2] = 6 : 5. Отсюда [NH3]исх. = [NH3] + [NH3] = 0,009 + 0,003 = 0,012 моль/л, [O2]исх. = [O2] + [O2] = 0,02 + 0,00375 = 0,0238 моль/л. Пример 4. Равновесие системы 2SO2 + O2 2SO3 установилось, когда концентрации компонентов (моль/л) были: [SO2]равн. = 0,6; [O2]равн. = 0,24; [SO3]равн. = 0,21. Вычислите константу равновесия этой реакции и исходные концентрации кислорода и диоксида серы. Решение. Химическим равновесием называется такое состояние, когда скорости прямой и обратной реакций равны. Характеризуется химическое равновесие константой К, она имеет вид aA + bB cC + dD, 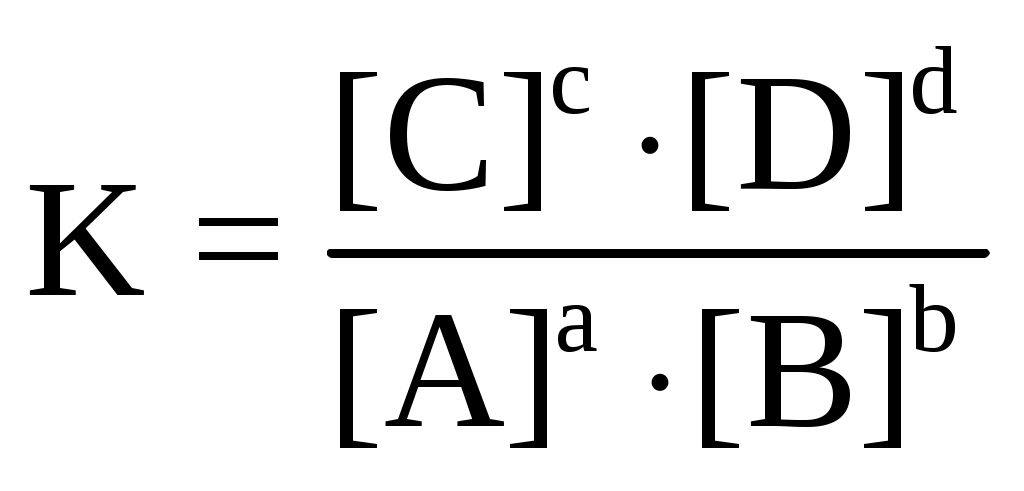 K= . K= .В условии задачи даны равновесные концентрации. Поэтому сразу можно рассчитать константу химического равновесия для реакции: 2SO2 + O2 2SO3, 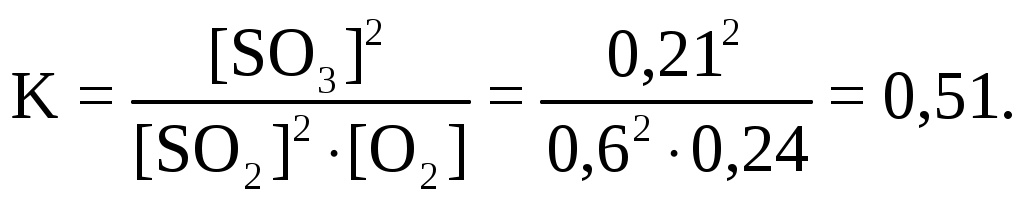 Чтобы рассчитать исходные концентрации кислорода и диоксида серы, необходимо найти, сколько этих компонентов было израсходовано на получение 0,21 моля триоксида серы и сложить с равновесными концентрациями. Согласно уравнению реакции для получения 2 молей триоксида серы требуется 2 моля диоксида серы, а для получения 0,21 моля триоксида серы Х молей диоксида серы. Отсюда X = Итак, [SO2]изр. = 0,21 моль/л. На получение SO3 было израсходовано 0,21 моля SO2, тогда [SO2]исх. = [SO2]равн. + [SO2]изр. = 0,6 + 0,21 = 0,81 моль/л, [SO2]исх = 0,81 моль/л. Для получения 2 молей SO3 требуется 1 моль O2. Для получения 0,21 моля SO3 X молей O2. X = Итак, [O2]изр. = 0,105 моль/л. [O2]исх. = [O2]равн. + [O2]изр. = 0,24 + 0,105 = 0,345 моль/л. Пример 5. В каком направлении сместится равновесие в реакциях: 1. CO(г) + H2O(г) CO2(г) + H2(г), H0 = 41,84 кДж; 2. N2(г) + 3H2(г) 2NH3(г), H0 = 92,40 кДж; 3. H2(г) + S(тв) H2S(г), H0 = 20,50 кДж, при повышении температуры, понижении давления и увеличении концентрации водорода? Решение. Химическое равновесие в системе устанавливается при постоянстве внешних параметров (Р, С, Т и др. ) Если эти параметры меняются, то система выходит из состояния равновесия и начинает преобладать прямая или обратная реакции. Влияние различных факторов на смещение равновесия отражено в принципе Ле Шателье: «Если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то равновесие сместится в таком направлении, что оказанное воздействие уменьшится». Используем этот принцип для решения задачи. При повышении температуры равновесие смещается в сторону эндотермической реакции, т. е. реакции, идущей с поглощением тепла. Первая и третья реакции экзотермические (H0 < 0), следовательно, при повышении температуры равновесие сместится в сторону обратной реакции, а во второй реакции (H0 > 0) в сторону прямой реакции. При понижении давления равновесие смещается в сторону возрастания числа молей газов, то есть в сторону большего давления. В первой и третьей реакциях в левой и правой частях уравнения одинаковое число молей газов (22 и 11 соответственно). Поэтому изменение давления не вызовет смещения равновесия в системе. Во второй реакции в левой части 4 моля газов, в правой 2 моля, поэтому при понижении давления равновесие сместится в сторону обратной реакции. При увеличении концентрации компонентов реакции равновесие смещается в сторону их расхода. В первой реакции водород находится в продуктах, и увеличение его концентрации усилит обратную реакцию, в ходе которой он расходуется. Во второй и третьей реакциях водород входит в число исходных веществ, поэтому увеличение его концентрации смещает равновесие в сторону прямой реакции, идущей с расходом водорода. Задания 121. Окисление серы и ее диоксида протекает по уравнениям: a) S (к) + O2 (г) = SO2 (г); б) 2SO2 (г) + О2 (г) = 2SO3 (г). Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в четыре раза? 122. Напишите выражение для константы равновесия гомогенной системы N2 + 3H2 2NH3. Как изменится скорость прямой реакции образования аммиака, если увеличить концентрацию водорода в три раза? 123. Реакция идет по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакция были: [N2] = 0,049 моль/л; [О2] = 0,01 моль/л. Вычислите концентрацию этих веществ в момент, когда [NO]=0,005 моль/л. Ответ: [N2] = 0465 моль/л; [О2] = 0,0075 моль/л. 124. Реакция идет по уравнению N2 + 3H2 = 2NH3. Концентрации участвующих в ней веществ были: [N2] = 0,80 моль/л, [Н2] = 1,5 моль/л; [NH3] = 0,10 моль/л. Вычислите концентрацию водорода и аммиака, когда [N2] = 0,5 моль/л. Ответ: [NH3] = 0,7 моль/л; [H2 ] = 0,60 моль/л. 125. Реакция идет по уравнений H2 + J2 = 2НJ. Константа скорости этой реакции при 508 0С равна 0,16. Исходные концентрации реагирующих веществ: [H2] = 0,04 моль/л;[J2] = 0,05 моль/л. Вычислите начальную скорость реакции и скорость ее, когда [H2] = 0,03 моль/л. Ответ: 3,210–4; 1,9210–4. 126. Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80 °С. Температурный коэффициент скорости реакции 3. 127. Как изменится скорость реакции, протекающей в газовой фазе, при повышении температуры на 60 °С, если температурный коэффициент скорости данной реакции 2? 128. Как изменится скорость реакции, протекающей в газовой фазе, при понижении температуры на 30 °С, если температурный коэффициент скорости данной реакции 3? 129. Напишите выражение для константы равновесия гомогенной системы 2SO2 + O2 2SO3. Как изменится скорость прямой реакции – образования SO3, если увеличить концентрацию SO2 в три раза? 130. Напишите выражения для константы равновесия гомогенной системы CH4 + CO2 2CO + 2H2. Как следует изменить температуру и давление, чтобы повысить выход водорода? Реакция образования водорода эндотермическая. 131. Реакция идет по уравнению 2NО + О2 = 2NО2. Концентрации исходных веществ: [NO] = 0,03 моль/л; [О2] = 0,05 моль/л. Как изменится скорость реакции, если увеличить концентрацию кислорода до 0,10 моль/л и концентрацию NO до 0,06 моль/л? 132. Напишите выражение для константы равновесия гетерогенной системы CО2 + С 2CO. Как изменится скорость прямой реакции – образования СО, если концентрацию СО2 уменьшить в четыре раза? Как следует изменить давление, чтобы повысить выход СО? 133. Напишите выражение для константы равновесия гетерогенной системы C + H2O (г) СО + Н2. Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции – образования водных паров? 134. Равновесие гомогенной системы 4HCl (г) +O2 (г) 2H2О (г) + Cl2 (г) установилось при следующих концентрациях реагирующих веществ: [Н2О] = 0,14 моль/л; [Сl2] = 0,14 моль/л; [НС1] = 0,20 моль/л; [O2] = 0,32 моль/л. Вычислите исходные концентрации хлороводорода и кислорода Ответ: [HCI]исх. = 0,48 моль/л; [О2]исх. = 0,39 моль/л. 135. Вычислите константу равновесия для гомогенной системы СО (г) + Н2О (г) СО2 (г) + Н2 (г) если равновесные концентрации реагирующих веществ: [СО] = 0,004 моль/л; [H2O] = 0,064 моль/л; [СО2] = 0,016 моль/л; [H2]-=0,016 моль/л. Ответ: К = 1. 136. Константа равновесия гомогенной системы СО (г) + Н2О (г) СО2 (г) + Н2 (г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации: [CO] = 0,10 моль/л; [H2O] = 0,40 моль/л. Ответ: [CO2] = [H2] = 0,08 моль/л [СО] = 0,02 моль/л; [Н2О] = 0,32 моль/л. 137. Константа равновесия гомогенной системы N2 + 3H2 2NH3 при температуре 400 0С равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрацию азота. Ответ: 8 моль/л; 8,04 моль/л. 138. При некоторой температуре равновесие гомогенной системы 2NO + O2 2N2 установилось при следующих концентрациях реагирующих веществ: [NO] = 0,2 моль/л; [О2] = 0,1 моль/л; [NO2] = 0,1 моль/л. Вычислите константу равновесия и исходную концентрацию NO и О2. Ответ: К = 2,5; [NO] = 0,3 моль/л; [О2] = 0,15 моль/л. 139. Почему при изменении давления смещается равновесие системы N2 + 3H2 2NH3 и не смещается равновесие системы N2 + O2 2NO? Напишите выражения для констант равновесия каждой из данных систем. 140. Исходные концентрации NO и Cl2 в гомогенной системе 2NО + Cl2 2NOCl составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если, к моменту наступления равновесия прореагировало 20 % NО. Ответ: 0,416. Способы выражения концентрации растворов Пример 1. К 1 литру раствора с массовой долей HCl 20 % (d = 1,100 г/см3) добавили 400 см3 раствора с массовой долей HCl 5 % (d = 1,024 г/см3). Вычислите массовую долю HCl в полученном растворе. Решение. В условии задачи требуется рассчитать массовую долю (), которая показывает, сколько граммов вещества растворено в 100 граммах раствора: = 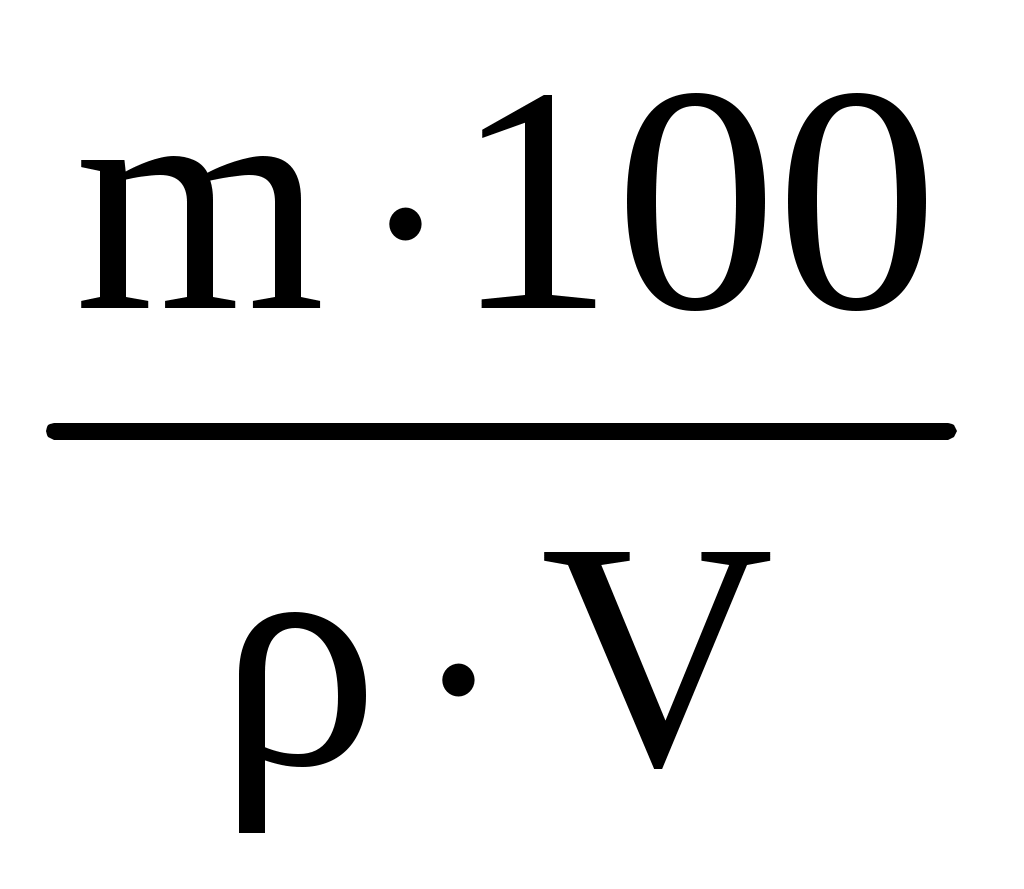 , ,где m масса растворенного вещества, г; плотность раствора, г/см3; V объем раствора, мл. Рассчитаем массу HCl, содержащейся в 1000 · 1,100 = 1100 г раствора из соотношения: в 100 г раствора с массовой долей HCl 20 % содержится 20 г HCl, в 1100 г раствора HCl содержится Х г HCl. Отсюда, X = 400 см3 растворас массовой долей HCl 5 % весят m = · V = 400 · 1,024 = 409,6 г, а количество HCl в этом растворе определим из соотношения: в 100 г раствора с мвссовой долей HCl 5 % содержится 5 г HCl, в 409,6 г Х г HCl. Найдем X: X = Общая масса раствора после сливания будет 1100 + 409,6 = 1509,6 г. Количество растворенной в нем кислоты будет 220 + 20,48 =240,48 г. Массовую долю HCl и полученном растворе вычислим из соотношения: в 1509,6 г раствора HCl содержится 240,48 г HCl, в 100 г раствора HCl содержится Х г HCl. Отсюда X = 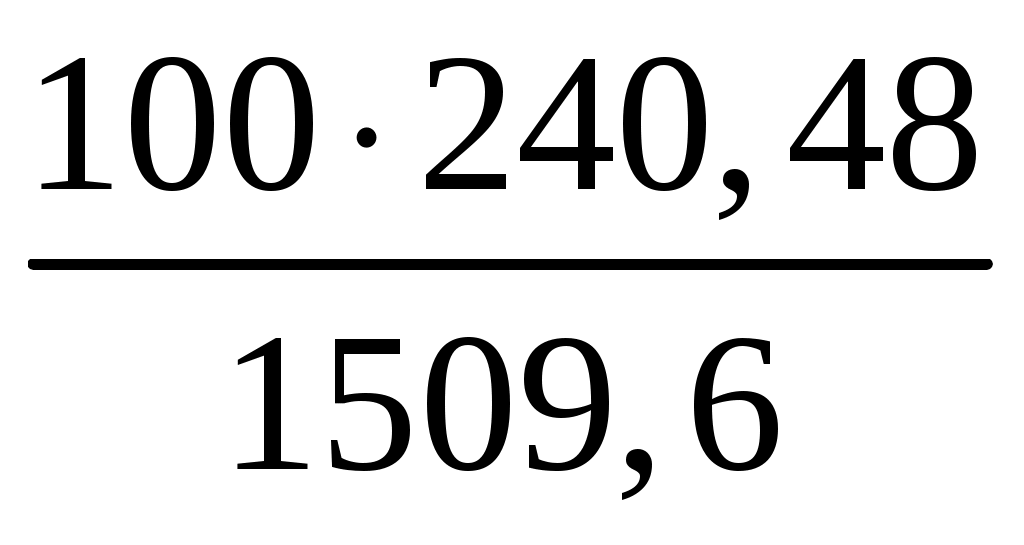 = 15,93 г, а (HCl) = 15,93 %. = 15,93 г, а (HCl) = 15,93 %.Пример 2. Вычислите молярную концентрацию раствора сульфата калия, 20 мл которого содержат 1,74 г этой соли. Решение. Молярная концентрация указывает на количество молей вещества в 1000 мл раствора. Ее вычисляют по формуле, (моль/л): См = 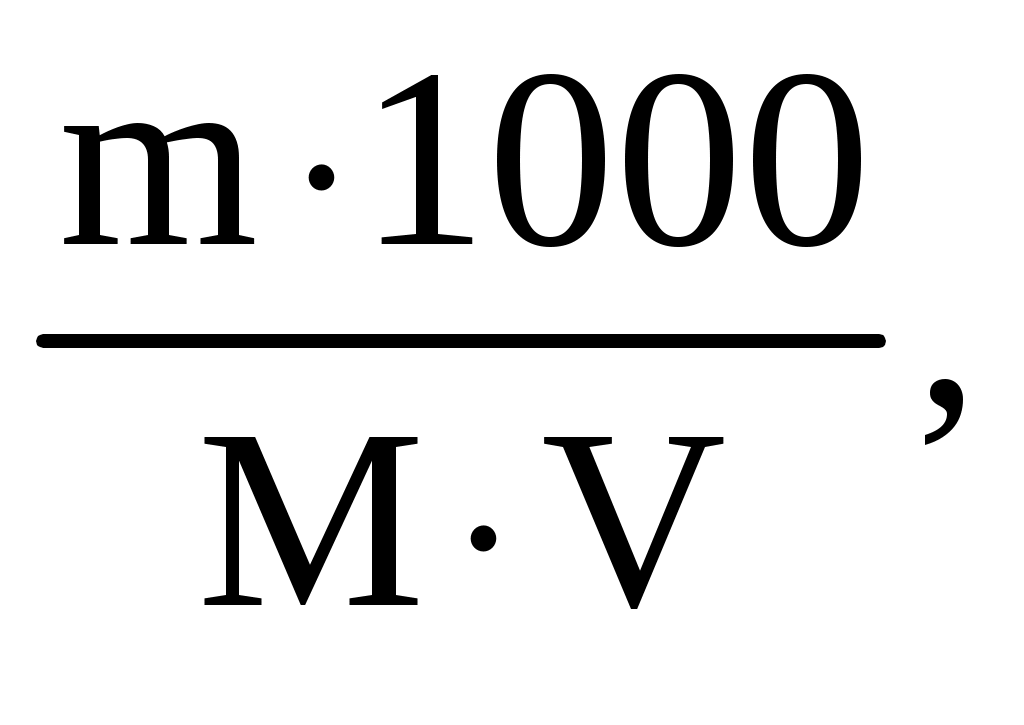 моль/л, моль/л,где m масса растворенного вещества, г; М молярная масса растворенного вещества, г; V объем раствора, мл. Молярная масса сульфата калия (К2SO4) равна: 39,10 + 32,06 + 4 · 16 = 174 г/моль. Рассчитаем массу сульфата калия, содержащегося в 1 литре раствора, из соотношения: в 20 мл раствора К2SO4 содержится 1,74 г К2SO4; в 1000 мл Х г К2SO4. Тогда Х = 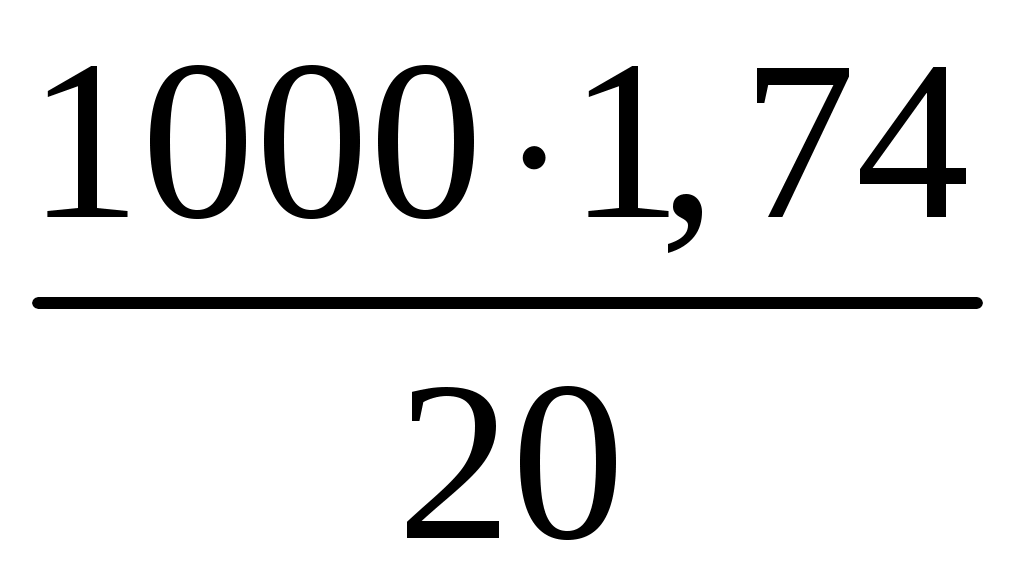 = 87 г. = 87 г.Молярная масса сульфата калия 174,26 г/моль, а 87 г этой соли составят 87 : 174,26 = 0,5 молей. Итак, в 1 литре раствора сульфата калия содержится 0,5 молей этой соли. Следовательно, раствор 0,5 молярный (0,5 М). Эту же задачу можно решить по формуле См = 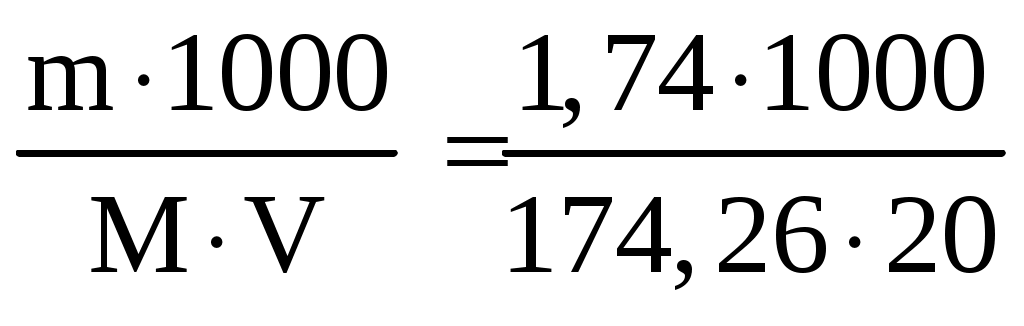 = 0,5моль/л. = 0,5моль/л. |
