химия. Методические указания и контрольные задания для студентов заочников инженернотехнических (нехимических)
 Скачать 2.15 Mb. Скачать 2.15 Mb.
|
|
Пример 3. Сколько граммов оксида кальция содержится в 200 мл 0,3 н. раствора? Рассчитайте титр раствора. Решение. Молярная концентрация эквивалентов или нормальная концентрация (Сэкв) показывает, сколько молей эквивалентов вещества содержится в 1 литре раствора, ее рассчитывают по формуле, (моль/л): Сэкв = 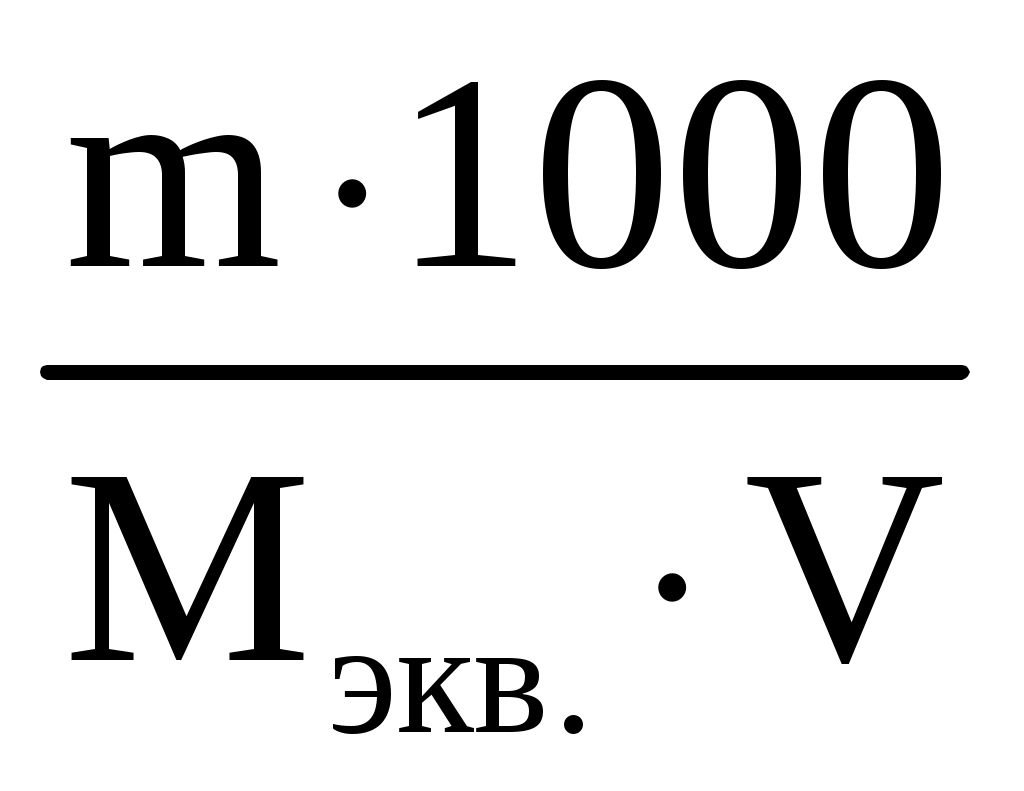 . .Здесь m масса растворенного вещества, г; Мэкв. молярная масса эквивалента вещества, г/моль; V объем раствора, мл. Титр раствора (Т) показывает, сколько граммов вещества содержится в 1 мл раствора. Титр раствора связан с нормальной концентрацией соотношением, (г/мл): Т = Рассчитаем молярную массу эквивалента гидроксида кальция: Мэкв.Ca(OH)2 = и массу Ca(OH)2 в 200 мл раствора по формуле Сэкв = 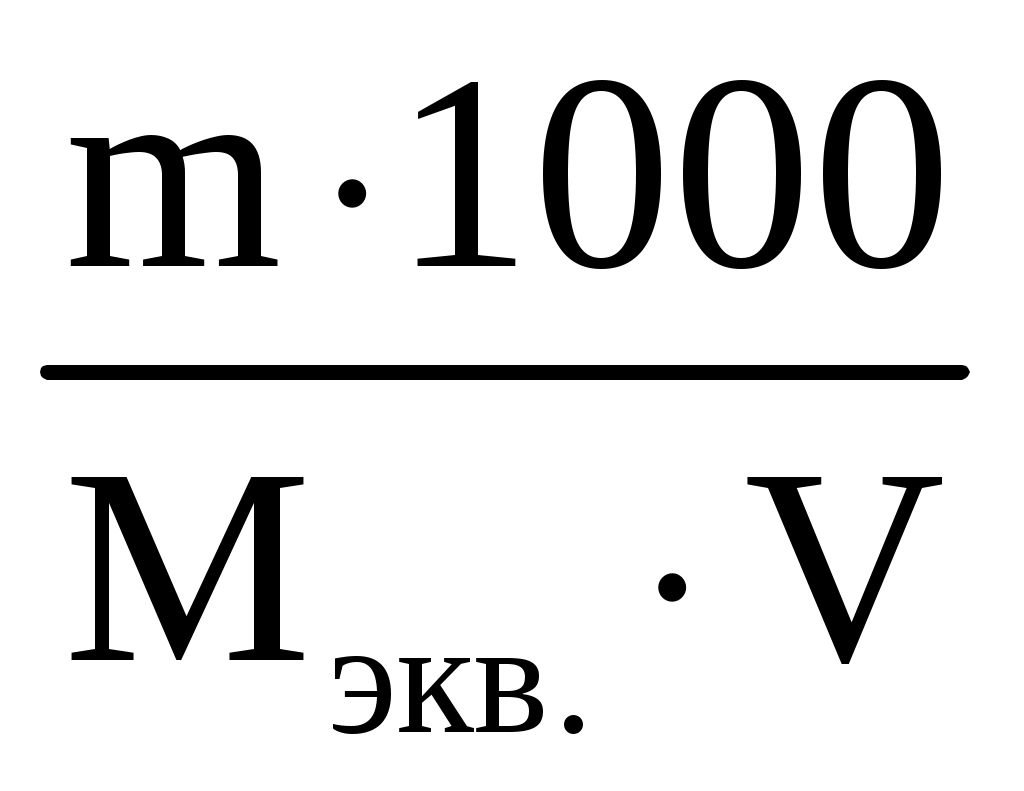 . Мэкв. = . Мэкв. = 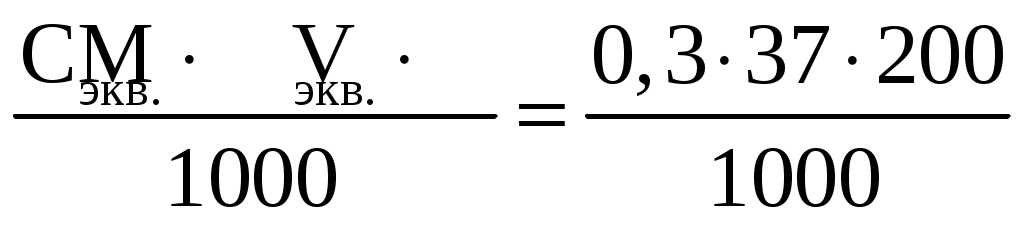 = 2,22 мль/л. = 2,22 мль/л.Зная нормальную концентрацию раствора, можно рассчитать его титр: Т = Задания 141. Вычислите молярную и нормальную концентрации раствора с массовой долей хлорида кальция 20%, плотность которого 1,178 г/см3. Ответ: 2,1 М; 4,2 н. 142. Чему равна нормальная концентрация раствора с массовой долей NaOH 30 %, плотность которого 1,328 г/см3? К 1 л этого раствора прибавили 5 л воды. Вычислите массовую долю NaOH в полученнм растворе. Ответ: 9,96 н.; 6.3%. 143. К 3 л раствора с массовой долей HNO3 10%, плотность которого 1,054 г/см3, прибавили 5 л раствора той же кислоты с массовой долей 2% плотностью 1,009 г/см3. Вычислите массовую долю и молярную концентрации полученного раствора, если считать, что его объем равен 8 л. Ответ: 5,0 %; 0,82 М. 144. Вычислите нормальную и моляльную концентрации раствора HNO3 с массовой долей 20,8 %, плотность, которого 1,12 г/см3. Сколько граммов кислоты содержится в 4 л этого раствора? Ответ: 3,70 н.; 4,17 м; 931,8 г. 145. Вычислите молярную, нормальную и моляльную концентрации раствора с массовой долей хлорида алюминия 16 %, плотность которого 1,149 г/см3. Ответ: 1,38 М; 4,14 н; 1,43 м. 146. Сколько и какого вещества останется в избытке, если к 75 см3 0,3 н. раствора H2SO4 прибавить 125 см3 0,2 н. раствора КОН? Ответ: 0,14 г КОН. 147. Для осаждения в виде AgCl всего серебра, содержащегося в 100 см3 раствора AgNO3, потребовалось 50 см3 0,2 н раствора НСl. Чему равна нормальная концентрация раствора AgNO3? Сколько граммов АgCl выпало в осадок? Ответ: 0,1 н; 1,433 г. 148. Какой объем раствора с массовой долей НСl 20,01% (плотность 1,100 г/см3) требуется для приготовления 1 л раствора с массовой долей HCl 10,17 % (плотность 1,050 г/см3)? Ответ: 485,38 см3. 149. Смешали 10 см3 раствора с массовой долей HNO3 10 % (плотность 1,056 г/см3) и 100 см3 раствора с массовой долей HNO3 30 % (плотность 1,184 г/см3). Вычислите массовую долю HNO3 в полученном растворе. Ответ: 28,38 %. 150. Какой объем раствора с массовой долей КОН 50 % (плотность 1,538 г/см3) требуется для приготовления 3 л раствора с массовой долей КОН 6 % (плотность 1,048 г/см3)? Ответ: 245,5см3. 151. Какой объем раствора с массовой долей карбоната натрия 10 % (плотность 1,105 г/см3) требуется для приготовления 5 л раствора с массовой долей карбоната натрия 2 % (плотность 1,02 г/см3)? Ответ: 923,1 см3. 162. На нейтрализацию 31 см3 0,16 н. раствора щелочи требуется 217 см3 раствора H2SO3. Чему равны нормальная концентрация и титр раствора H2SO4? Ответ: 0,023 н.; 1,12710–3 г/см3. 153. Какой объем 0,3 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3? Ответ: 26,6 см3. 154. На нейтрализацию I л раствора, содержащего 1,4 г КОН, требуется 50 см3 раствора кислоты. Вычислите нормальную концентрацию раствора кислоты. Ответ: 0.53 н. 155. Сколько граммов HNO3 содержалось в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н. раствора NaOH? Чему равен титр раствора NaOH? Ответ: 0,882 г, 0,016 г/см3. 156. Сколько граммов NaNO3 нужно растворить в 400 г воды, чтобы приготовить раствор с массовой долей NaNO3 20 %? Ответ: 100 г. 157. Смешали 300 г раствора с массовой долей NaCl 20 % и 500 г раствора c массовой долей NaCl 40 %. Чему равна массовая доля NaCl в полученном растворе? Ответ: 32,5%. 158. Смешали 247 г раствора с массовой долей серной кислоты 62 % и 145 г раствора с массовой долей серной кислоты 18%. Какова массовая доля серной кислоты в полученном растворе после смешения? Ответ: 45,72 %. 159. Из 700 г раствора серной кислоты с массовой долей 60 % выпариванием удалили 200 г воды. Чему равна массовая доля серной кислоты в оставшемся растворе? Ответ: 84 %. 160. Из 10 кг раствора с массовой долей растворенного вещества 20 % при охлаждении выделилось 400 г соли. Чему равна массовая доля растворенного вещества охлажденного раствора? Ответ 16,7 %. Свойства растворов Пример 1. Вычислите температуры кристаллизации, и кипения раствора с массовой долей сахара C12H22O11 5 %. Решение. При растворении в растворителе нелетучего вещества давление пара растворителя над раствором уменьшается, что вызывает повышение температуры кипения раствора и понижение температуры его замерзания по сравнению с чистым растворителем. При этом, согласно закону Рауля, повышение температуры кипения (tкип.) и понижение температуры замерзания (tзам.) раствора пропорционально моляльной концентрации раствора: Тк = Э · Cm, Тз = К · Сm. Здесь Cm моляльная концентрация раствора (число молей растворенного вещества в 1000 г растворителя); Э эбуллиоскопическая константа растворителя, град; К криоскопическая константа растворителя, град. Так как молярная концентрация 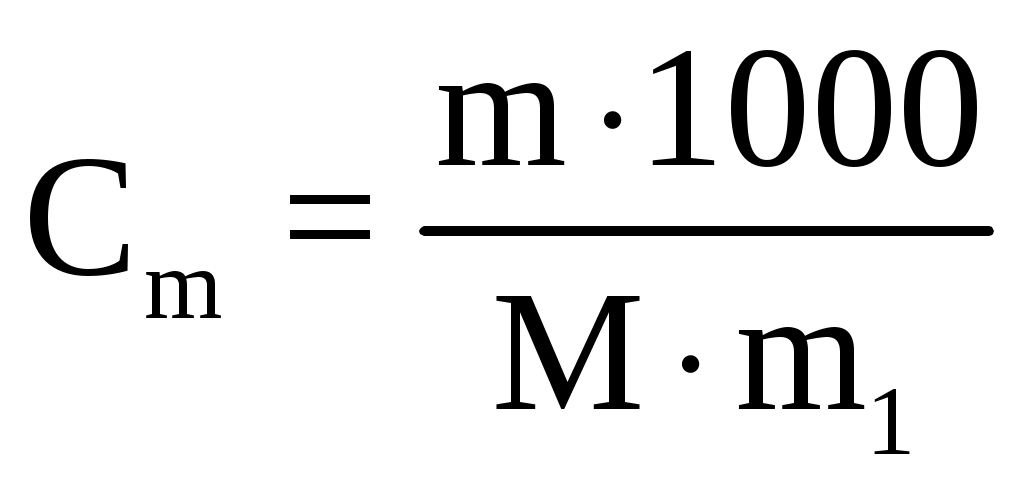 , , где m масса растворенного вещества, г; M молярная масса растворенного вещества, г/моль; m1 масса растворителя, г, то формулы закона Рауля можно записать следующим образом: Тк = 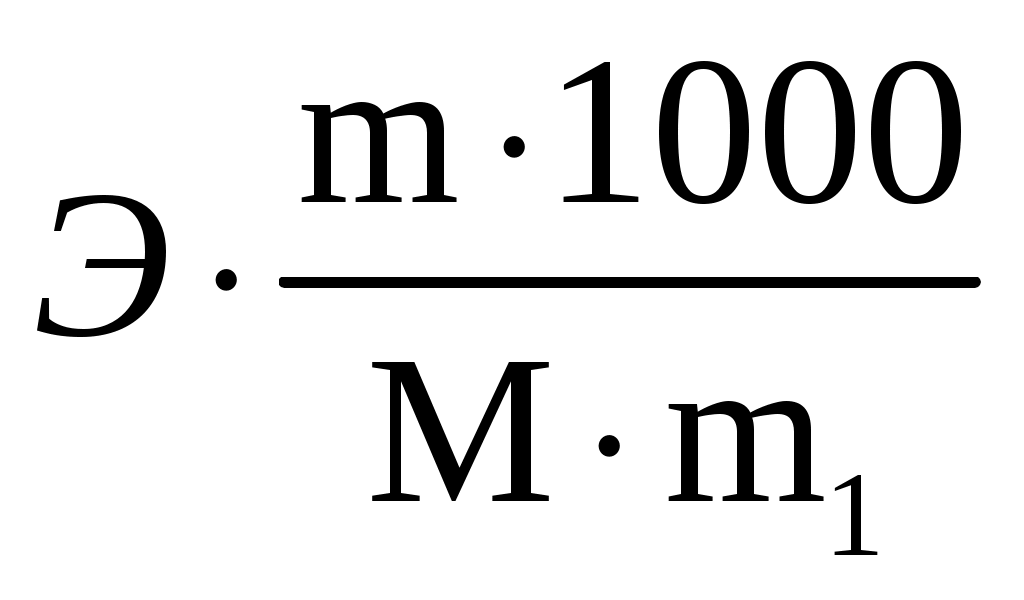 , Тз = , Тз = 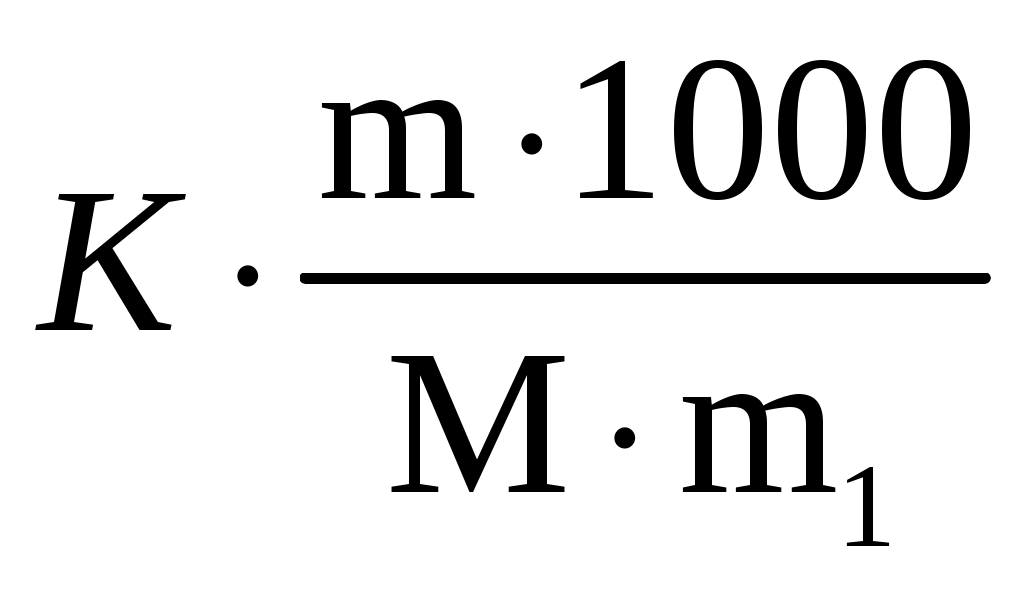 . .Эти формулы позволяют определить температуры замерзания и кипения растворов по их концентрации, а также находить молекулярную массу растворенного вещества по понижению температуры замерзания и повышению температуры кипения раствора. Для воды криоскопическая константа (К) и эбуллиоскопическая константа (Э) соответственно равны 1,86 и 0,52 град. Молярная масса сахара 342 г/моль. Рассчитаем понижение температуры кристаллизации раствора с массовой долей сахара 5 %: Тз = Вода кристаллизуется при 0 С, следовательно, температура кристал-лизации раствора будет 0 0,29 = 0,29 С. Из формулы рассчитываем повышение температуры кипения этого раствора: Тк = Вода кипит при 100 С. Следовательно, температура кипения этого раствора будет 100 + 0,06 = 100,06 С. Пример 2. Рассчитайте, при какой температуре будет кристаллизоваться раствор, содержащий в 200 г бензола, 12 г нафталина? Решение. Криоскопическая константа бензола равна 5,10 град. Молярная масса нафталина C10H8 = 128 г/моль. Из формулы понижение температуры замерзания этого раствора Тз = Бензол кристаллизуется при 5,53 С. Таким образом, температура кристаллизации раствора равна: 5,5 2,38 = 2,15 С. Пример 3. В каком количестве воды следует растворить 20 г глюкозы, чтобы получить раствор с температурой кипения 100,2 С? Решение. Температура кипения воды 100 С. Повышение температуры кипения раствора Тк = 100,2 100 = 0,2 С. Молярная масса глюкозы C6H12O6 180 г/моль. Из формулы находим количество воды, в котором нужно растворить 20 г глюкозы, чтобы получить раствор с температурой кипения 100,2 С: Тк = 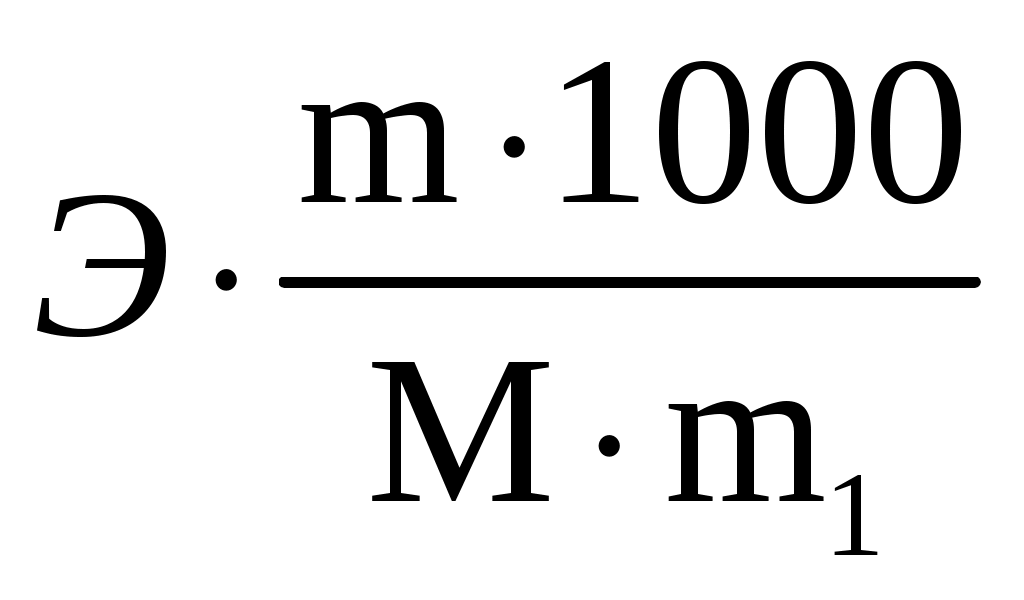 , , 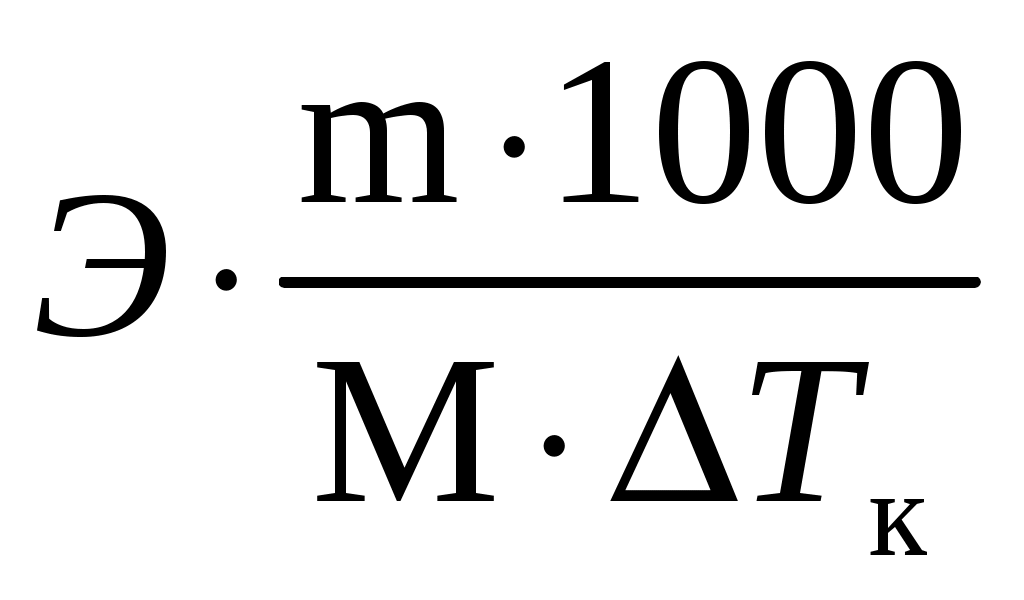 , = , = 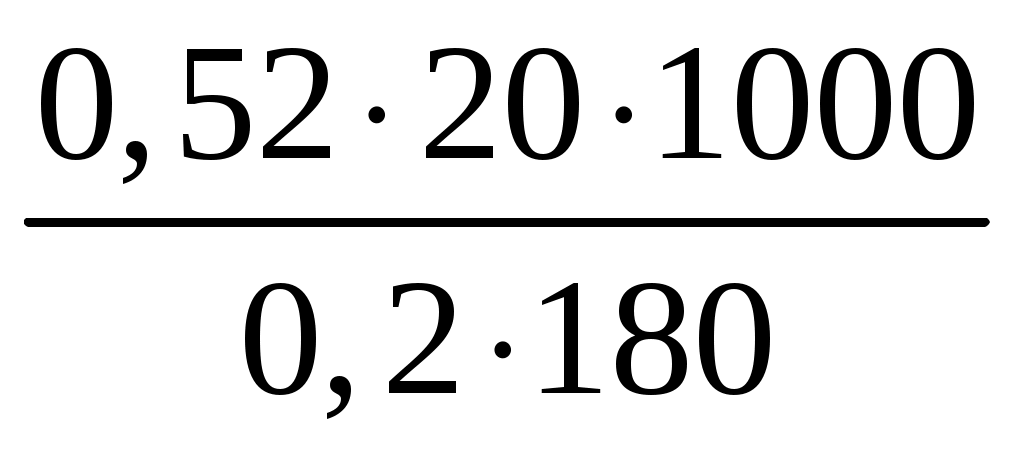 = 289 г. = 289 г.Пример 4. При растворении 6,9 г глицерина в 500 г воды температура замерзания понизилась на 0,279 С. Определите молярную массу глицерина. Решение. Для расчета молярной массы глицерина преобразуем формулу и подставим известные величины: Тз = 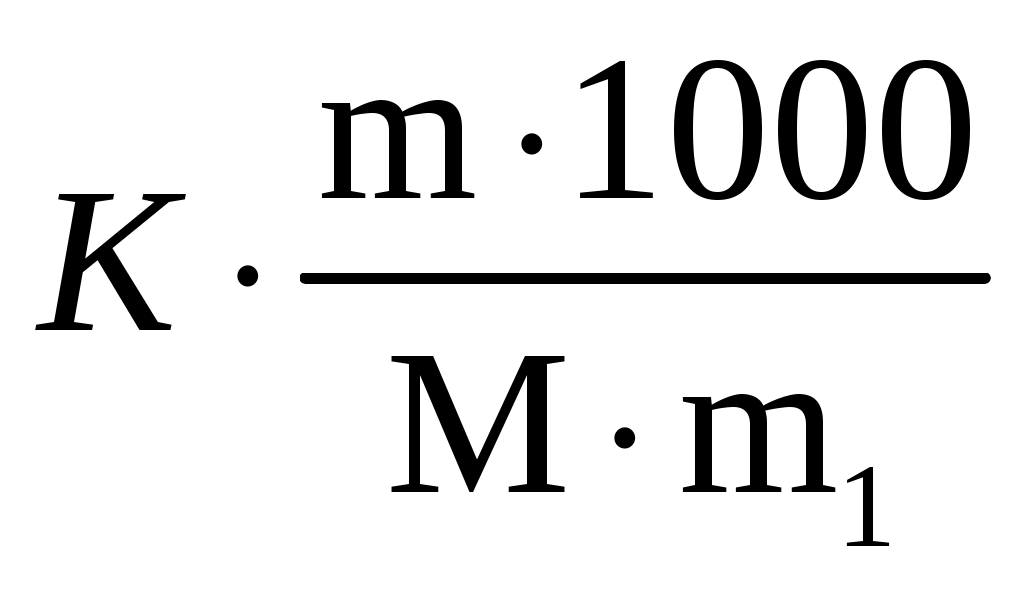 . . 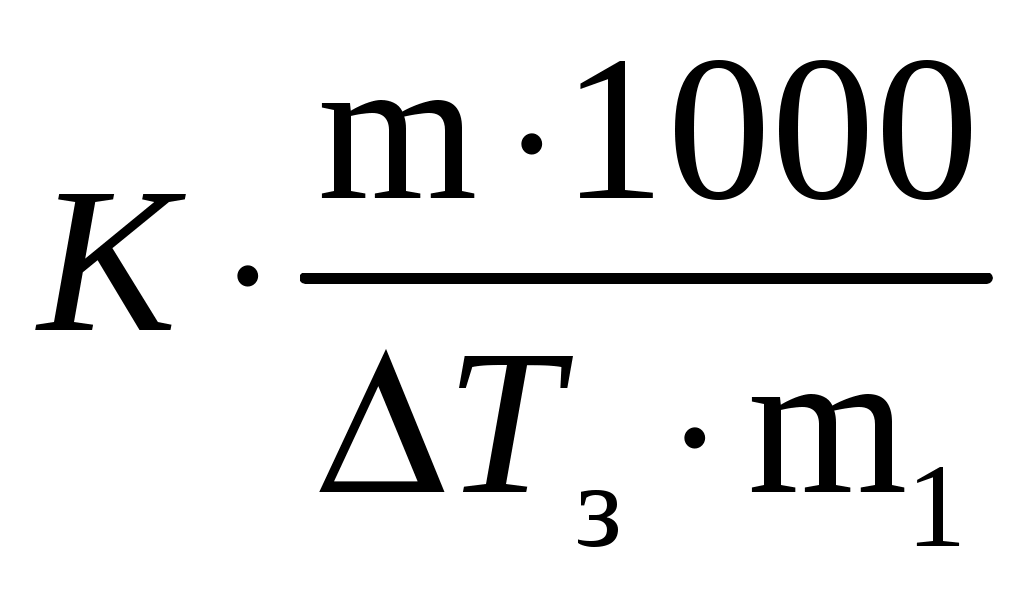 = = 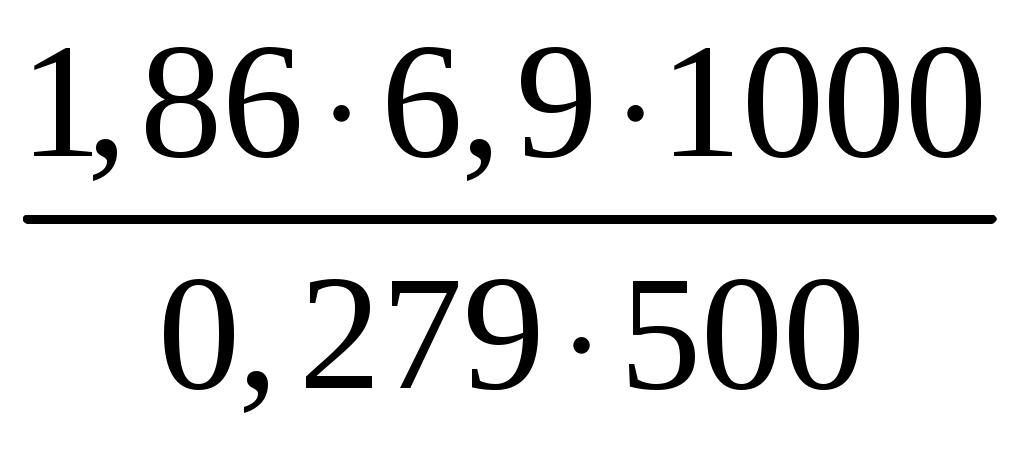 = 92 г/моль. = 92 г/моль.Здесь 1,86 криоскопическая константа воды. Пример 5. Раствор, приготовленный из 1 кг этилового спирта (C2H5OH) и 9 кг воды, залили в радиатор автомобиля. Вычислите температуру замерзания раствора. Решение. Молярная масса этилового спирта равна 44 г/моль, криоскопическая константа 1,85 град. По формуле находим понижение температуры замерзания раствора: Тз = 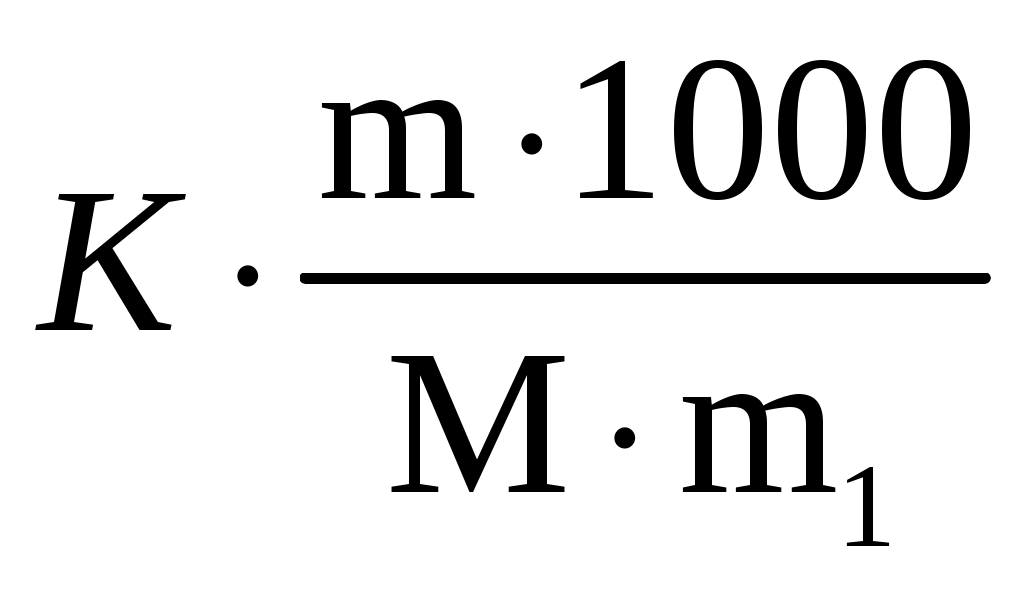 . Тз = . Тз = Вода кристаллизируется при 0 С, следовательно, температура кристаллизации раствора этилового спирта будет 0 4,7 = 4,7 С. Задания 161. Раствор, содержащий 0,512 г неэлектролита в 100 г бензола, кристаллизуется при 5,296°С. Температура кристаллизации бензола 5,5 °С. Криоскопическая константа 5,1 град. Вычислите мольную массу растворенного вещества. Ответ: 128 г/моль. 162. Вычислите массовую долю сахара С12Н22О11 в водном растворе, зная температуру кристаллизации раствора (–0,93 °С). Криоскопическая константа воды 1,86 град. Ответ: 14,6 %. 163. Вычислите температуру кристаллизации раствора мочевины (NH2)2CO, содержащего 5 г мочевины в 150 г воды. Криоскопическая константа воды 1,86 град. 164. Раствор, содержащий 3,04 г камфары C10H16O в 100 г бензола, кипит при 80,714 °С. Температура кипения бензола 80,2 °С. Вычислите эбуллиоскопическую константу бензола. 165. Вычислите массовую долю водного раствора глицерина С3Н5(ОН)3, зная, что этот раствор кипит при 100,39°С. Эбуллиоскопическая константа воды 0,52 град. Ответ: 6,45 %. 166. Вычислите мольную массу неэлектролита, зная, что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при –0,279°С. Криоскопическая константа воды 1,86 град. Ответ: 60 г/моль. 167. Вычислите температуру кипения раствора с массовой долей нафталина С10Н8 5 % в бензоле. Температура кипения бензола 80,2 °С. Эбуллиоскопическая константа его 2,57 град. Ответ: 81,25 °С. 168. Раствор, содержащий 25,65 г некоторого неэлектролита в 300 г воды, кристаллизуется при –0,465 °С. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86 град. Ответ: 342 г/моль. 169. Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 3,56 г антрацена С14H10 в 100 г уксусной кислоты, кристаллизуется при 15,718 °С. Температура кристаллизации уксусной кислоты 16,65 °С. 170. Равные массовые количества камфары С10Н16О и нафталина С10Н8 растворены в одинаковых количествах бензола. Какой из растворов кипит при более высокой температуре? 171. Температура кристаллизации раствора, содержащего 66,3 г некоторого неэлектролита в 500 г воды, равна –0,558 0С. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86 град. Ответ: 442 г/моль. 172. Сколько граммов анилина C6H5NH2 следует растворить в 50 г этилового эфира чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0.53 0С. Эбуллиоскопическая константа этилового эфира 2,12 град. Ответ: 1,16 г. 173. Вычислите температуру кристаллизации раствора с массовой долей этилового спирта C2H5OH 2 %, зная, что криоскопическая константа воды 1,86 град. Ответ: –0,82 °С. 174. Сколько граммов мочевины (NH2)2CO следует растворить в 75 г воды, чтобы температура кристаллизации понизилась на 0,465 0C? Криоскопическая константа воды 1,86 град. Ответ: 1,12 г, 175. Вычислите массовую долю глюкозы С6Н12О6 в водном растворе, зная, что этот раствор кипит при 100,26 0С. Эбуллиоскопическая константа воды 0,52 град. Ответ: 8,25 %. 176. Сколько граммов фенола С6Н5ОН следует растворить в 125 г бензола, чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,7 0С? Криоскопическая константа бензола 5,1 град. Ответ: 3,91 г. 177. Сколько граммов мочевины (NH2)2CO следует растворить в 250 г воды, чтобы температура кипения повысилась на 0,26 °С? Эбуллиоскопическая константа воды 0,52 град. Ответ: 7,5 г. 178. При растворении 2,3 г некоторого неэлектролита в 125 г воды температура кристаллизации понижается на 0,372 0С. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86 град. Ответ: 92 г/моль. 179. Вычислите температуру кипения водного раствора с массовой долей пропилового спирта C3H7OН 15 %, зная, что эбуллиоскопическая константа воды 0,52 град. Ответ: 101,52 0С. 180. Вычислите массовую долю метанола CH3OH в воде, температура кристаллизации которого –2,79 °С. Криоскопическая константа воды 1,86 град. Ответ: 4,58 %. Ионно-молекулярные (ионные) реакции обмена Пример 1. Составьте молекулярные и ионные уравнения реакций, протекающих между веществами: 1. AgNO3 + FeCl3 2. Na2S + HCl 3. HCN + KOH 4. Zn(OH)2 + NaOH Решение. Реакции в растворах электролитов протекают между ионами, их записывают с помощью ионных уравнений. Большинство этих реакций относят к типу обменных, и сущность их сводится к соединению ионов в молекулы новых веществ. Обязательным условием протекания реакций обмена между электролитами в растворах является образование: малорастворимых веществ, слабых электролитов, газообразных веществ, комплексных ионов. При составлении ионного уравнения все перечисленные выше вещества пишутся в виде молекул, а сильные электролиты в виде ионов, независимо от того, в левой или правой частях уравнения они находятся. Распишем реакции, приведенные в условии задачи в молекулярном и ионном виде. Молекулярное уравнение: 1. 3AgNO3 + FeCl3 = 3AgCl + Fe(NO3)3. Полное ионное уравнение: 3Ag+ + 3NO Если из правой и левой частей уравнения исключить одинаковые ионы, то получим краткое ионное уравнение, выражающее суть данной реакции. Краткое ионное уравнение: 3Ag+ + 3Cl = 3AgCl. Подобным образом расписываем остальные реакции. 2. Na2S + 2HCl =2NaCl + H2S. 2Na+ + S2– + 2H+ + 2Cl– =2Na+ + 2Cl– + H2S. 2H+ + S2– = H2S. 3. HCN + KOH = KCN + H2O. HCN + K+ + OH = K+ + CN + H2O. HCN + OH = CN + H2O. 4. Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]. Zn(OH)2 + 2Na+ + 2OH = 2Na+ + [Zn(OH)4]2. Zn(OH)2 + 2OH = [Zn(OH)4]2. |
