Методические указания к лабораторным и практическим занятиям по курсу общей химии для студентов химических и нехимических специальностей дневных, вечерних и заочных факультетов
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
|
Федеральное агентство по образованию Государственное образовательное учреждение высшего профессионального образования НИЖЕГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ им. Р.Е. АЛЕКСЕЕВА Кафедра "Общая и неорганическая химия" КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ Методические указания к лабораторным и практическим занятиям по курсу общей химии для студентов химических и нехимических специальностей дневных, вечерних и заочных факультетов Нижний Новгород 2010 Составители: В.И.Наумов, Ж.В.Мацулевич, Ю.В.Батталова УДК 54 (07) Коррозия и защита металлов от коррозии: Метод. указания к лабораторным и практическим занятиям по курсу общей химии/ НГТУ им. Р.Е. Алексеева Сост.: В.И.Наумов, Ж.В.Мацулевич, Ю.В.Батталова. Н.Новгород, 2010. с. Предложены теоретическая часть, вопросы и задачи для домашних и практических занятий, а также описание лабораторных работ по теме "Коррозия металлов". Научный редактор: Паничева Г.А. Редактор Подп. к печ. Формат 60х84 1/16. Бумага газетная. Печать офсетная. Печ. .л. . Уч.-изд. .л. .Тираж 1500 экз. Заказ . Нижегородский государственный технический университет Типография НГТУ. 603600, Н.Новгород, ул. Минина, 24. © Нижегородский государственный технический университет, 2010 Теоретическая часть Коррозия – это самопроизвольное разрушение металлов под действием окружающей среды. Первопричиной коррозии является термодинамическая нестойкость подавляющего числа металлов в различных средах при данных условиях (∆G<0). Ущерб от коррозии связан не только с потерей больших количеств металла, но и с порчей и выходом из строя металлических конструкций и оборудования, так как вследствие коррозии они теряют прочность, пластичность, герметичность, тепло- и электропроводность, отражательную способность и т.д. С коррозией связаны потери воды, газа, нефти и других технологических жидкостей и газов в результате протечки труб и резервуаров. Например, в США в 2005 г. ущерб от коррозии и затраты на борьбу с ней составили 276 млрд. долларов. В Германии ущерб составил 2,8 % от ВВП. При этом потери металла, включающие массу вышедших из строя металлических конструкций, изделий, оборудования, составляют до 20 % годового производства стали, т.е. каждая 5-я домна работает на восполнение потерь от коррозии. Различают два вида потерь: прямые и косвенные. Прямые - безвозвратные потери металла, стоимость замены оборудования и металлоконструкций, расходы на противокоррозионную защиту. Косвенные - простой оборудования, снижение мощности, снижение качества продукции и расход металла на утолщения стенок труб. Отличительной чертой коррозионных процессов является их многостадийность. Обычно коррозионный процесс состоит, по меньшей мере, из трех основных стадий: 1) переноса реагирующих веществ (окислителей) к поверхности раздела фаз металл - окружающая среда; 2) реакции, протекающей на поверхности раздела фаз (окисление металла); 3) отвода продуктов коррозии из реакционной зоны. Каждая из этих стадий в разных условиях может быть лимитирующей и определять скорость процесса коррозии в целом. 3 Классификация коррозионных процессов По механизму процесса различают химическую и электрохимическую коррозию металлов: 1) химическая коррозия – это взаимодействие металлов с окружающей средой, не сопровождающееся возникновением электрохимических (электродных процессов). Чаще всего химическая коррозия протекает при взаимодействии металлов с сухими газами при высоких температурах (газовая коррозия) и в растворах неэлектролитов, где коррозия металла представляет собой обычные гетерогенные химические реакции: 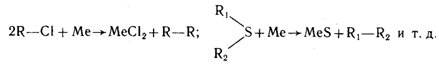 Где R, R1 и R2 – фрагменты органических молекул. 2) электрохимичекая коррозия - возникает во влажных средах и связана с возникновением коррозионного гальванического элемента. При электрохимической коррозии анодным процессом является окисление металла, а катодным – в большинстве случаев – восстановление ионов водорода или растворенного в воде кислорода. По условиям протеканиякоррозии различают: 1) газовую коррозию - коррозия металлов в газах при высоких температурах (например, в атмосфере дымовых или выхлопных газов); 2) атмосферную коррозию - коррозия металлов в атмосфере воздуха; 3) жидкостную коррозию - коррозия металлов в жидкой среде: в неэлектролите (органический растворитель, бром, расплавленная сера, бензин, мазут) и в электролите (кислая или щелочная среда, морская и речная вода, растворы солей); 4) биохимическую коррозию - это разрушение металлов под действием микроорганизмов, использующих металлы в качестве питательной среды, или выделяемых бактериями газов (Н2S, СО2, NO2), кислот, H2O2; бактерий особенно много в сточных и застойных водах, болотах, различных биомассах). 4 По характеру коррозионных разрушенийразличают следующие виды коррозии (рис.1): 1) сплошнуюили общую коррозию, охватывающую всю поверхность металла. Сплошная коррозия бывает: а) равномерной, протекающей с одинаковой скоростью по всей поверхности металла; б) неравномерной; в) избирательной (селективной), при которой разрушается один компонент сплава (обесцинкование латуней – сплав Cu-Zn) или одна структурная составляющая металла (например, коррозии подвергаются отдельные кристаллиты, выходящие на поверхность металла или сплава определенными гранями, а другие кристаллиты, выходящие на поверхность другими гранями, растворяются с низкой скоростью. 2) местную коррозию, охватывающую отдельные участки поверхности металла. Местная коррозия бывает: а) избирательная (селективной), при которой разрушается один компонент сплава (обесцинкование латуней - сплав Cu-Zn - в морской воде, так как локально вытравливается цинк) или одна структурная составляющая металла (например, коррозии подвергаются отдельные кристаллиты, выходящие на поверхность металла или сплава определенными гранями, а другие кристаллиты, не подвергаются коррозии); б) язвенная (локальное) разрушение, характеризующееся большой глубиной проникновения в металл (коррозия стали в грунте); в) точечная или питтинговая коррозия (в силу разных причин приводит к точечному, неглубокому разрушению); г) межкристаллитная, распространяющаяся по границам зерен отдельных кристаллов. Это опасный вид коррозии, так как не заметен внешне и ведет к быстрой потере металлом прочности и пластичности; д) ножевая (транскристаллитная) – локальная коррозия металла, имеющая вид надреза ножом в зоне сварных и сильно нагруженных соединений в агрессивных средах. 5 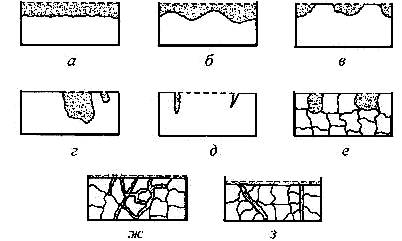 Рис. 1. Основные виды коррозионных разрушений: а) равномерная коррозия; б) неравномерная; в) пятнами; г) язвами; д) питтинг; е) селективная коррозия; ж) межкристаллитная; з) транскристаллитная Электрохимическая коррозия металлов Этот вид коррозии всегда сопровождается возникновением гальванических пар и подразделяется на два вида: коррозия в растворах электролитов и атмосферная коррозия. Термодинамически возможен процесс электрохимической коррозии, для которого соблюдается условие ∆G= -nFE< 0 (1) где ∆G– изменение энергии Гиббса для процесса, кДж/моль; n – число электронов, принимающих участие в коррозионном, окислительно-восстановительном процессе; F= 96500 Кл – число Фарадея; E = Ек – Еа – ЭДС гальванического элемента, в котором протекает данный коррозионный процесс (Ек и Еа – потенциалы катодного и анодного процессов соответственно, в вольтах). Таким образом, возможность протекания электрохимической коррозии металла определяется соотношением потенциалов анодного (окисление металла) и катодного (восстановление окислителя) процессов в данных условиях. 6 Ионы и молекулы раствора, обеспечивающие протекание катодного процесса, называются деполяризаторами. Чаще всего в качестве деполяризаторов выступают растворенные в электролите или воде молекулярный кислород или ионы водорода, либо то и другое вместе (рис.2). 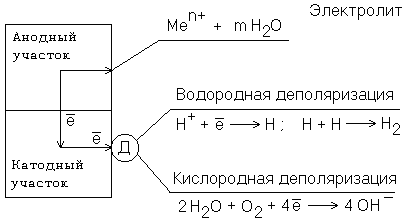 Рис. 2. Схема коррозионного процесса. Д – деполяризатор Вследствие этого следует различать два вида электрохимической коррозии: с водородной (1) и кислородной деполяризацией (2): 1) анодный процесс: Ме – 2е = Ме2+ катодный процесс: 2Н+ + 2е = Н2 (медленная стадия) 2) анодный процесс: Ме – 2е = Ме2+ катодный процесс: О2 + 2Н2О +4е = 4ОН- (медленная стадия) Анодный и катодный процессы всегда являются сопряженными. Катодный процесс в обоих случаях является самым медленным и определяет скорость всего коррозионного процесса в целом. Коррозия с водородной деполяризацией наблюдается в кислых средах, где содержание Н+ велико (рН ≤ 6); При большем рН, коррозия протекает с кислородной деполяризацией. Первый случай - наиболее опасный, так как водород, растворяясь в стали, создает повышенную хрупкость металла (водородное охрупчивание). Следует иметь в виду, что потенциалы водородного и кислородного электродов зависят от рН раствора по уравнениям: Е(н+/н2) = - 0,059 · рН, В; Е(о2 /н2о) = 1,23 - 0,059 · рН, В Эти зависимости в графическом варианте называются диаграммами Пурбэ (рис.3, кр.1 и 2). 7 Е 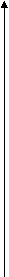 ,В ,В 1,2 Е(о2 /н2о) = 1,23 - 0,059 · рН, В 1,2 Е(о2 /н2о) = 1,23 - 0,059 · рН, В III – область металлов стойких во всех средах III – область металлов стойких во всех средах2 II – коррозия с кислородной деполяризацией      0,0 0,0 7 14 рН Е(н+/н2) = - 0,059 · рН, В -  1,2 I – коррозия с выделением Н2 и 1 1,2 I – коррозия с выделением Н2 и 1поглощением из электролита О2 Рис. 3. Диаграммы Пурбэ для водородного (1) и кислородного (2) электродов Все металлы с потенциалами, более отрицательными, чем потенциал водородного электрода, термодинамически должны подвергаться коррозии. Часто этого не наблюдается из-за образования оксидных или солевых пленок на поверхности металла. По этой причине, коррозия не всегда имеет деструктивный характер. Например, зеленый налет, наблюдаемый на бронзовых скульптурах, является малахитом, образующимся по реакции Cu + O2 + CO2 + H2O = (CuOH)2CO3] и который защищает металл от атмосферной коррозии. Этим объясняется прекрасное состояние многих старинных бронзовых и медных скульптур и монет. Из рис. 3 следует, что потенциалы кислородного электрода в зависимости от рН равны: О2 + 4Н+ + 4е = 2Н2О ( рН=0) Е°= +1,23 В О2 + 2Н2О + 4е = 4ОН- (рН=7) Е°= +0,81 В О2 + 2Н2О + 4е = 4ОН- (рН=14) Е°= +0,41 В Очевидно, в насыщенной кислородом кислой среде подвергаться коррозии с кислородной деполяризацией могут те металлы, стандартный электродный потенциал которых лежит 8 отрицательнее +1,23 В, в нейтральной - +0,81 В, а в щелочной - отрицательнее + 0,4 В. Коррозии с водородной деполяризацией в кислой среде будут подвергаться металлы, стандартный электродный потенциал которых лежат отрицательнее +0,00 В (Fe, Ni, Zn, Cd, Al), в нейтральной - – 0,41 В, а в щелочной – отрицательнее - - 0,82 В. Таким образом, все металлы, у которых равновесные потенциалы отрицательнее соответствующего для этих условий потенциала водородного или кислородного электродов, могут растворяться, а металлы, у которых равновесный потенциал положительнее этих потенциалов, не подвергаются коррозии. Из приведенных данных видно, что более активными в коррозионном отношении являются среды, содержащие кислород, так как потенциал кислородного электрода больше потенциала водородного электрода на 1,23 В при любых значениях рН. В нейтральной среде коррозия всегда протекает с кислородной деполяризацией. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде, почве и в атмосфере. С кислородной деполяризацией ржавеет большинство оборудования, мосты, путепроводы, вышки ЛЭП; металлоконструкции и корпуса судов, соприкасающиеся с речной или морской водой, растворами солей и влажным воздухом. Коррозия с водородной деполяризацией имеет место: 1) при большой концентрации [H+] в растворе (коррозия Fe, Zn, Cd, Ni в растворах кислот); 2) в отсутствие в растворе кислорода при отрицательных значениях электродных потенциалов металлов, когда они не покрыты оксидными пленками и способны вытеснять водород из воды. Рассмотрим наиболее распространенный коррозионный процесс, связанный с коррозией железа в атмосферных условиях, в которых Fe под действием воздуха и воды быстро покрывается ржавчиной. Коррозионный процесс при этом можно записать следующим образом: 9 F  e – 2e = Fe2+ 2 e – 2e = Fe2+ 2O2 + 2 H2O + 4e = 4OH- 1 2 Fe + O2 + 2H2O = 2 Fe2+ + 4OH- Вторичным коррозионным процессом является стадия осаждения железа в виде гидроксида железа (II), а затем под действием кислорода воздуха и в виде гидроксида железа (III) 1) Fe2+ + 2OH- = Fe(OH)2 ; 2) 2Fe(OH)2 + ½О2 + Н2О = 2Fe(OH)3 Эти продукты коррозии могут претерпевать дальнейшие превращения с образование сложных гидратированных оксидов FeO· Fe2О3 · nH2O – так называемой ржавчины. Факторы, влияющие на коррозию металлов. Наиболее простой моделью коррозионного процесса, идущего по электрохимическому механизму, является модель коррозионного гальванического элемента. Возникновение катодных и анодных участков на поверхности металла связано с химической и геометрической неоднородностью поверхности, механическими напряжениями, неоднородностью коррозионной среды, температурным градиентом поверхности, контактом с другими металлами и т.п. Рассмотрим наиболее распространенные случаи. Химическая неоднородность поверхности. Часто в роли катодов в коррозионных микрогальванических элементах выступают включения: неметаллов, оксидов, нитридов, карбидов и др. В частности, в чугуне – это микровключения графита, в стали – кристаллиты цементита (Fe3C). На рис. 4 приведена схема разрушения углеродистой стали с кислородной и водородной деполяризациями. Коррозионный микрогальванический элемент образуется из зерен железа и его соединения – карбида железа (Fe3C),отличающихся по значениям электрохимической активности (потенциалов). 10 (-) А (α-Fe): Fe – 2e → Fe2+ PH<7 (+)K (Fe3C): 2H+ + 2e → H2 ∑ Fe +2H+ → Fe2+ + H2 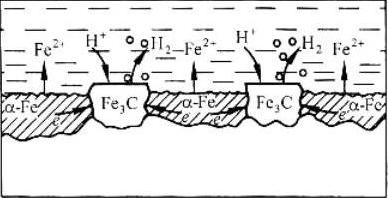 а) (-) А (α-Fe): Fe – 2e → Fe2+ 2 PH≥7 (+)K (Fe3C): O2 + 2H2O + 4e → 4OH-1 +O2 ∑ 2Fe + O2 + 2H2O → 2Fe(OH)2 → mFexOy•nH2O 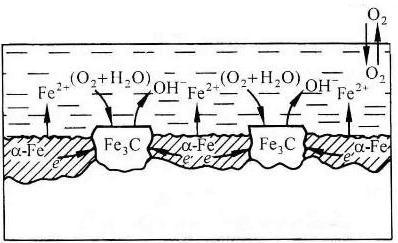 б) Рис. 4. Схема коррозионного разрушения стали с водородной (а) и кислородной (б) деполяризациями Геометрическая неоднородность связана с наличием шероховатости поверхности, наличия острых углов, граней, которые приводят к разным значениям энергии Гиббса на отдельных участках поверхности и, следовательно, к разным потенциалам Е1 и Е2. На 11 выступах количество оборванных связей металла больше, чем во впадинах, соответственно и энергия Гиббса выпуклого участка больше, а потенциал поверхности на нем более отрицательный (выступ является анодом).    G1 G1 = - zFЕ1 = - zFЕ1     ● ●G2 = - zFЕ2 G1 > G2 ; Е1 < Е2 Контактная коррозия металлов. Электрохимическая коррозия может развиваться в результате контакта двух различных металлов. В результате будет возникать не микро-, а макрогальванопара. Сочетания металлов, сильно отличающихся значениями электродных потенциалов, в технике недопустимы (например, скрутки проводов алюминий – медь, соединение железа алюминиевыми или медными клепками и т.д.). На рис.5 показана коррозия железа, находящегося в контакте с медью. Возникает коррозионный гальванический элемент, в котором железо является анодом (Е°= -0,44 В), а медь – катодом (Е°= 0,34 В). Анодный процесс будет представлять собой растворение железа, катодный же будет определяться видом и составом коррозионной среды.   зона коррозии Рис. 5. Коррозия при контакте двух металлов Влияние неоднородности состава коррозионной среды может приводить к образованию микрогальванопар даже на поверхности одного и того же металла. Примером может служить коррозия 12 металла под каплей воды (рис.6). Так как поверхностные слои воды содержат больше растворенного кислорода, чем внутренние, поверхность металла в центре под каплей оказывается более активной (анодный участок), а на периферии капли будет наблюдаться восстановление кислорода (катодный участок). После высыхания капли в ее центре появляется довольно глубокое пятно ржавчины.  Рис. 6. Схема коррозии железа под каплей воды Подобные гальванопары возникают очень часто при коррозии бытового и промышленного оборудования и в подземных сооружениях, из-за неравномерной аэрации кислородом отдельных участков поверхности металла. В качестве примера может служить коррозия стальной сваи, закопанной в речное дно (рис 7).  Рис. 7. Коррозия в результате неравномерного доступа кислорода. Б – свая; А – анодный участок; К – катодный участок |
