Методические указания к лабораторным и практическим занятиям по курсу общей химии для студентов химических и нехимических специальностей дневных, вечерних и заочных факультетов
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
|
Часть сваи, находящаяся в воде, омывается растворенным в ней кислородом и, будет играть роль катода. Почва практически не 13 содержит растворенного кислорода и та часть сваи, которая находится в ней, будет анодом и подвергается разрушению. Механические напряжения. Микрогальванопары могут возникать при действии внешних и внутренних механических напряжений (например, изгиб и провисание балки, напряженные сварные швы). Коррозия в этом случае приводит к межкристаллитному растрескиванию или так называемой "ножевой" коррозии. Такой вид коррозии возникает из-за того, что на растянутой стороне балки межатомные связи растянуты и более слабы, чем на верхней стороне. Энергия Гиббса на этой стороне балки равна ∆G1. На сжатой стороне балки энергия Гиббса имеет более отрицательные значения ∆G2. Так как ∆G связано с потенциалом ∆G = -nFЕ, то на сжатой стороне имеем более положительный потенциал Е2 (катод), а на растянутой – более отрицательный потенциал Е1 (анод). Таким образом, механические напряжения всегда приводят к возникновению гальванопар с ЭДС = Е2 – Е1. При этом в области растяжений наблюдается растворение металла, а в области сжатий (катодные участки) восстанавливается окислитель (Н+ или О2). Кинетика коррозионных процессов. Имеется много примеров того, как более активные металлы растворяются значительно медленнее, чем менее активные. Например, скорость коррозии алюминия в атмосферных условиях значительно меньше скорости коррозии железа (-0,44 В), хотя стандартный электродный потенциал алюминия более отрицателен (-1,66 В). Это говорит о том, что помимо влияния термодинамических факторов на процессы коррозии необходимо учитывать также и кинетические факторы, из которых наиболее важным является способность металлов переходить в пассивное состояние. Процесс пассивации металлов связан с образованием на их поверхности тонких пленок малорастворимых соединений - оксидов, гидроксидов, солей или их смесей. Эти пленки блокируют поверхность и препятствуют переносу электронов и окислителя к поверхности металла. Известно, что коррозия металла с водородной деполяризацией 14 протекает тем быстрее, чем меньше перенапряжение реакции выделения водорода (Н2,В) на нем (см. табл. 3). Например, Е°Pb2+/Pb = - 0,126 В, т.е. свинец термодинамически неустойчив в кислых средах, однако с разбавленными серной и соляной кислотами металл не взаимодействует, так как на свинце Н2 = -1,56 В. По этой же причине цинк (Е° (Zn2+/Zn) = -0,76 В) тоже неустойчив в кислых средах. Однако, из-за большого перенапряжения водорода, он очень медленно вытесняет водород из кислот. В контакте цинка с медью (Zn | H+ | Cu), на Cu восстановление водорода протекает значительно быстрее (Н2 на меди на 0,4 В меньше, чем на Zn). По этой причине в контакте с медью цинк растворяется очень активно, что сопровождается интенсивным выделением водорода на меди. Факторы, влияющие на скорость коррозии металлов Влияние рН раствора. Пассивация металла чаще всего связана с образованием на его поверхности малорастворимых пленок оксидов и гидроксидов. Реакция среды, т.е. рН раствора, влияет на характер растворимости этих пленок. В том случае, если оксиды обладают основными свойствами, защитное действие их будет в большей степени проявляться в щелочных средах, где растворимость этих пленок меньше. Если оксидные (гидроксидные) пленки металлов обладают кислотными свойствами, коррозионная устойчивость металлов будет в большей степени проявляться в кислых средах. В соответствии с этим все металлы можно разделить на ряд групп: 1) металлы, неустойчивые в кислых растворах, но стойкие в щелочных средах (Ni, Co, Cd, Mg, Mn, Fe); 2) металлы, стойкие в кислых средах, но не стойкие в щелочных растворах (Ta, Mo,W); 3) металлы, стойкие в нейтральных растворах, но неустойчивые в кислых и щелочных средах (Zn, Al, Sn, Pb, Bi, Be). У этих металлов защитные оксидные слои имеют амфотерный характер. 15 4) металлы, скорость коррозии которых практически не зависит от рН среды (Ag, Au, Pt) из-за высоких положительных значений Ео. Cостав растворов. Скорость коррозии в водных растворах зависит от природы растворенных в воде веществ, что связано со следующими факторами: 1) растворенные соли гидролизуются, изменяя рН растворов. Это приводит к изменению растворимости оксидных и солевых поверхностных пленок на металле; 2) растворенное в воде вещество может давать с металлом или продуктами его коррозии пленку малорастворимых соединений, тем самым делая пассивной его поверхность; 3) некоторые анионы, чаще галогены (например, ионы Cl-), адсорбируясь на поверхности металла, разрушают оксидную пленку и ускоряют процесс коррозии. Такие частицы часто называют депассиваторами коррозии. Особенно большие неприятности связаны с хлоридом натрия, разбрасываемым в зимнее время на дорогах и тротуарах для удаления снега и льда. В присутствии NaCl они плавятся и образующиеся растворы приводят к ускоренному разрушению транспортных средств и подземных коммуникаций. Только в США применение NaCl (СаС12) приводит к потерям на сумму 2 млрд. долларов в год в связи с коррозией двигателей и 0,5 млрд. на дополнительный ремонт дорог, подземных магистралей и мостов. 4) наличие в растворе таких веществ, как NH3, CN- и др., способствующих образованию комплексных соединений, резко увеличивает скорость растворения металлов. Например, медь, коррозионноустойчивый металл, а при добавлении в раствор аммиака растворяется с достаточно большой скоростью: 2Cu + O2 + 8NH4OH = 2[Cu(NH3)4](OH)2 + 6H2O Увеличение скорости коррозии связано с тем, что ионы металла связываются в прочный комплекс , при этом наблюдается сдвиг потенциала металла в отрицательную сторону, делая его более активным. Например: EoCu//Cu2+ = +0,337B; Eo[Cu(NH3)4]2+/Cu = -0,04 B. 16 Методы защиты металлов от коррозии Применение различных методов защиты металлов от коррозии позволяет в какой-то степени свести к минимуму потери металла. В зависимости от причин, вызывающих коррозию, различают следующие методы защиты. 1) Обработка среды, в которой протекает коррозия металла. К подобным методам относят процессы нейтрализации среды, обескислороживание, введение ингибиторов (замедлителей) коррозии. Эти методы используются в случаях, когда объем коррозионной среды достаточно ограничен. Широкое распространение получили ингибиторы, которые защищают от атмосферной коррозии изделия из черных и цветных металлов при хранении, транспортировке и т.д. В качестве ингибиторов используют как неорганические, так и органические вещества: хроматы, полифосфаты, формальдегид, различные амины, уротропин и др. Введение в раствор таких окислителей как K2Cr2O7 и K2CrO4 способствуют образованию на железе оксидных пассивирующих пленок. Полифосфаты, к которым относится и «Калгон» (гексаметафосфат натрия – (NaPO3)n, где n = 6 - 20), образуют с ионами Са2+ и Mg2+ водорастворимые соли, т.е. одновременно умягчают воду и ингибирует процесс коррозии за счет образования на поверхности плотной пленки фосфата железа. Действие ингибиторов заключается в следующем. При малых концентрациях, ингибитор адсорбируется на активных участках поверхности металла и блокирует их, снижая скорость коррозии в разы. При больших концентрациях ингибитор создает на поверхности плотно закрывающие защитные пленки, наподобие масляных, которые препятствуют доступу деполяризатора к поверхности металла и замедляют скорость его растворения. Ингибиторы могут замедлять как анодную реакцию окисления металла, так и катодную стадию восстановления окислителя - деполяризатора. 17 2) Метод деаэрации (обескислороживания) заключается в удалении из воды кислорода. Для этого используют специальные вещества: сульфит натрия (Na2SO3 + 1/2O2 = Na2SO4), пирогаллол и другие, а также пропускают воду через слои металлической стружки, которая корродирует по механизму кислородной деполяризации и при этом поглощает кислород из воды. 3) Легирование металла. Для сталей, работающих в агрессивных газовых и жидких средах, широко используют легирование металла. В металлы вводятся такие легирующие компоненты, которые увеличивают химическую стойкость и жаропрочность (сопротивление образованию окалины), которые обладают высокой диффузионной способностью в данном металле или сплаве и, выходя на поверхность, образуют устойчивые оксидные слои, а в растворах сдвигают потенциал легированного металла в положительную сторону. Важнейшими коррозионностойкими сплавами являются нержавеющие стали с повышенным содержанием хрома: хромистые и хромоникелевые. На рис. 8 показано влияние количества хрома в железохромистых сплавах на электрохимический потенциал сплава.    Рис. 8. Влияние хрома на потенциал сплавов Fe - Cr Из рис.8 видно, что содержание хрома в нержавеющей стали должно быть не менее 15 % и при этом потенциал стали сдвигается в положительную сторону почти на 1,0 В, снижая возможность ее окисления. Наиболее распространенная нержавеющая сталь Х18Н10Т, содержит 18 % хрома и 10 % никеля. Кроме сдвига потенциала, хром и никель на поверхности нержавеющих сталей 18 этого класса, образуют оксидный слой, содержащий NiCr2O4 и FeCr2O4, который более устойчив, чем просто оксид Cr2O3. Аналогичным действием обладают Аl (аллитирование), Si (силицирование) и другие. Во многих случаях на поверхности металлов (Ti, Nb, Zr, Cr, А1) специально формируют стойкие оксидные пленки, которые предохраняют металлы от коррозии (так, на поверхности алюминия методом анодирования создают слои Al2O3, препятствующие дальнейшему окислению металла). Высокая химическая стойкость большинства оксидов этих металлов связана с тем, что по своей природе они являются либо диэлектриками, либо полупроводниками и плохо проводят электрический ток. По этой причине катодная и анодная реакции, связанные с переносом заряда (электрона) через закрывающий металл оксид, из-за большого электрического сопротивления становятся невозможными. Защитные покрытия Неметаллические покрытия. Представляют собой изолирующие слои красок, лаков, резины, эмалей, пластмасс и другие. Наиболее распространенными являются лакокрасочные покрытия, однако их механические свойства значительно ниже, чем у металлических. Химические покрытия. Это специально создаваемые на поверхности металла химически стойкие соединения, способные изолировать его от окружающей среды: оксиды, фосфаты, сульфаты и другие. Фосфатирование металлической поверхности представляет собой процесс осаждения нерастворимых фосфатов этого металла. Сущность процесса фосфатирования: 2Fe2+ + Fe(H2PO4)2 = Fe3(PO4)2 ↓+ 4H+ Нерастворимые фосфаты прочно связаны с поверхностью металла и тормозят отвод продуктов коррозии и доставку деполяризатора к ней. 19 Металлические защитные покрытия подразделяют на четыре типа: 1) металлические покрытия, оксидный слой которых делает металлы пассивными (А1, Zn, Sn, Cr, Pb, Ni); 2) металлические покрытия, которые сами по себе являются химически стойкими (Au, Ag, Сu) из-за высоких положительных Ео. 3) Анодные покрытия. Если на металл нанести покрытие из другого, более электроотрицательного металла, то в случае возникновения условий для электрохимической коррозии разрушаться будет покрытие, а не защищаемый металл. Такое покрытие называется анодным и примером анодных покрытий могут служить хром или цинк, термическим или гальваническим путем, нанесенные на железо. В случае нарушения целостности покрытия при контакте с влажным воздухом будет работать гальванический элемент: А (–) Cr H2O, O2 Fe (+) К на аноде: Cr – 2e = Cr2+ на катоде (Fe): 2 H2O + O2 + 4e = 4 OH– 2Cr + 2H2O + O2 = 2 Cr(OH)2 Далее, протекает реакция 4 Cr(OH)2 + 2H2O + O2 = 4 Cr(OH)3 Таким образом, в результате электрохимической коррозии разрушается анодное покрытие, а конструкция остается целой. 4) Катодные покрытия. У катодного покрытия стандартный электродный потенциал более положителен, чем у защищаемого металла. Пока слой покрытия изолирует металл от окружающей среды, электрохимическая коррозия не протекает. При нарушении сплошности покрытия оно перестает защищать металл от коррозии. Более того, нарушенное катодное покрытие интенсифицирует коррозию основного металла, так как в возникающей при этом гальванопаре, анодом будет служить основной металл, который и будет разрушаться. В качестве примера можно привести оловянное покрытие на железе (луженое железо). Рассмотрим работу гальванического элемента, возникающего в этом случае. А (–) Fe / H2O, O2 / Sn (+) К 20 на аноде: Fe – 2e = Fe2+ на катоде (Sn): 2 H2O + O2 + 4e = 4 OH– 2Fe + 2H2O + O2 = 2Fe(OH)2 Таким образом, при сравнении свойств анодных и катодных покрытий можно сделать вывод, что наиболее эффективными являются анодные покрытия. Они защищают основной металл даже в случае нарушения целостности покрытия, тогда как катодные покрытия защищают металл лишь механически. Электрохимическая защита Различают три вида электрохимической защиты: протекторная, катодная и анодная. Протекторная защита. Защищаемое от коррозии изделие соединяют с металлическим ломом из более электроотрицательного металла (протектора). Это равносильно созданию гальванического элемента, в котором протектор является анодом и будет разрушаться. Например, для защиты подземных сооружений (трубопроводов) на некотором расстоянии от них закапывают протектор (сплавы магния, цинк), присоединив его к сооружению (рис.9). 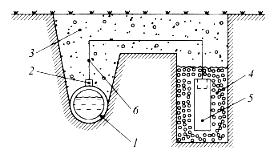 Рис. 9. Схема протекторной защиты: 1-защищаемый трубопровод; 2- стальной наконечник; 3-грунт; 4-засыпка (суспензия бетонита и алебастра); 5-протектор («жертвенный анод – Mg,Zn); 6-стальной провод с изоляцией Цинковые протекторы применяются с 1825 г., когда Х. Дэви предложил использовать цинк для защиты медной обшивки 21 деревянных корпусов кораблей. В настоящее время протекторы на основе магниевых сплавов широко используются для защиты корпусов судов от коррозии в морской воде. Протекторы, играющие роль анода, чаще применяются по сравнению с методами, связанными с использованием внешних источников тока (см. ниже катодная и анодная защита), поскольку протекторы не требуют затрат на оборудование и электроэнергию. Катодная защита отличается от протекторной тем, что защищаемая конструкция, находящаяся в электролите (почвенная вода), присоединяется к катоду внешнего источника тока. В ту же среду помещают металлолом, который соединяют с анодом внешнего источника тока (рис.10). 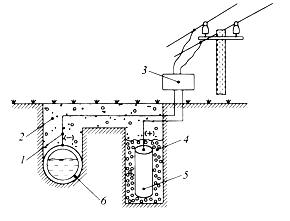             Рис. 10. Схема катодной защиты. 1- провод с изоляцией; 2- грунт; 3-выпрямитель тока; 4- засыпка; 5-вспомогательный анод; 6-защищаемая конструкция (трубопровод) Металлический лом, являясь анодом, подвергается разрушению, предохраняя от разрушения защищаемую конструкцию. На конструкцию подается отрицательный потенциал и, следовательно, на ней возможны процессы только восстановления. Анодная защита используется только для тех металлов, которые 22 при анодной нагрузке способны образовывать на своей поверхности пассивные оксидные или солевые пленки, защищающие металл от коррозии, например, железо в серной кислоте (рис.11). Б  I, А  А В С +Е, В  |
