Методические указания к лабораторным и практическим занятиям по курсу общей химии для студентов химических и нехимических специальностей дневных, вечерних и заочных факультетов
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
|
ЛАБОРАТОРНЫЕ РАБОТЫ. Опыт 1. Влияние реакции среды (рН) на скорость коррозии металлов. Для сравнения влияния характера среды на скорость коррозии металлов, оксиды и гидроксиды которых обладают соответственно основными и амфотерными свойствами, используйте следующие пары (по заданию преподавателя): а) Mg и Al; б) Fe и Zn; в) Mg и Sn. Возьмите три пробирки и налейте в них по 3 мл: 1) 20% раствора NaOH; 2) разбавленного 1:1 раствора HCl; 3) чистой воды + 1 каплю фенолфталеина. В каждую из пробирок опустите по кусочку первого металла и наблюдайте как протекает коррозия (есть или нет газовыделение, обратите внимание на изменение цвета воды). Повторите этот же опыт со вторым металлом. Постройте график зависимость скорости (относительной) коррозии от рН раствора. ОПЫТ 2. а). Влияние хлорид-ионов на скорость коррозии металлов. В две пробирки налейте по 3 мл 10% раствора сульфата меди CuSO4. В первую пробирку добавьте несколько капель насыщенного раствора NaCl (или кристалликов NaCl). Затем в каждую пробирку положите по кусочку Al или Zn. Определите, в каком случае вытеснение меди из ее раствора происходит более интенсивно. Объясните роль ионов хлора. б).Влияние процесса комплексообразования на скорость коррозии. В пробирку налейте 6 мл 25% раствора аммиака и положите кусочек меди. Интенсивно перемешайте. Наблюдайте интенсивное окрашивание раствора в синий цвет. Это объясняется переходом меди в раствор в виде комплексных ионов [Cu(NH3)4]2+ . Запишите уравнения протекающих процессов. С какой деполяризацией идет коррозия меди в этом случае? Почему процесс комплексообразования увеличивает скорость коррозии? Аналогичный опыт можно проделать с никелем, предварительно зачистив его поверхность. В растворе аммиака никель окисляется с образованием комплексного иона [Ni(NH3)4]2+ , что также приводит к указывающего на протекание коррозионного процесса. Подсоедините 39 синему окрашиванию раствора. ОПЫТ 3. Влияние перенапряжения реакции восстановления водорода на скорость коррозии. Возьмите две гранулы Zn или Al (по заданию преподавателя). Одну из них поместите на 2-3 минуты в стаканчик с 1М раствором сульфата меди (CuSO4). Выньте гранулу и осторожно промойте дистиллированной водой. В две пробирки налейте 1М раствор соляной кислоты (по 2-3 мл) и опустите в них цинковые гранулы. Наблюдайте выделение водорода. В какой пробирке выделение водорода протекает более интенсивно? Объясните наблюдаемое. Составьте схемы коррозионных гальванических элементов при коррозии чистого и омедненного цинка (алюминия). ОПЫТ 4. Анодные и катодные покрытия на металлах. В две пробирки налейте по 5 мл 1М раствора соляной кислоты, добавьте по 2 капли раствора красной кровяной соли K3[Fe(CN)6], которая является реактивом на ионы Fe2+. В первую пробирку опустите полоску оцинкованного железа, а во вторую - луженого железа. Предварительно поверхность пластинок зачистите наждачной бумагой. Появление синего окрашивания раствора свидетельствует о появлении ионов железа и, значит, о процессе его коррозии. В каком случае железо корродирует? К каким покрытиям относятся для железа цинковое и оловянное покрытия? Составьте схемы коррозионных гальванических элементов и запишите уравнения протекающих процессов. ОПЫТ 5. Электрохимические методы защиты металлов от коррозии а) Протекторная защита. В стакан с 20% раствором NaCl добавьте 2 капли фенолфталеина, который в щелочной среде дает малиновое окрашивание, и опустите соединенные проводником пластины из Fe и Zn. Около какой пластины появляется малиновое окрашивание? Составьте схему коррозионного процесса и запишите протекающие реакции. Какая из пластин защищена от коррозии? б) Катодная защита. В стакан с 20% раствором NaCl добавьте 2 40 капли красной кровяной соли (реактив на ионы Fe2+) и опустите две железные пластины. Отметьте появление синего окрашивания, указывающего на протекание коррозионного процесса. Подсоедините пластины к разным полюсам источника постоянного тока. Около какой пластины появляется синее окрашивание? Какая из пластин защищена от коррозии? Запишите уравнения коррозионных процессов. ПРИЛОЖЕНИЕ Таблица I Стандартные окислительно-востановительные потенциалы
41 Таблица 2 Равновесные потенциалы водородного и кислородного электродов при разных значениях рН
Таблица 3 Перенапряжение реакций выделения водорода и кислорода
Варианты домашних заданий
(-) А (α-Fe): Fe – 2e → Fe2+ PH<7 (+)K (Fe3C): 2H+ + 2e → H2 ∑ Fe +2H+ → Fe2+ + H2 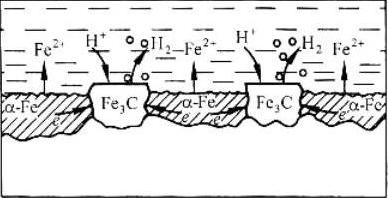 а) (-) А (α-Fe): Fe – 2e → Fe2+ 2 PH≥7 (+)K (Fe3C): O2 + 2H2O + 4e → 4OH-1 +O2 ∑ 2Fe + O2 + 2H2O → 2Fe(OH)2 → mFexOy•nH2O 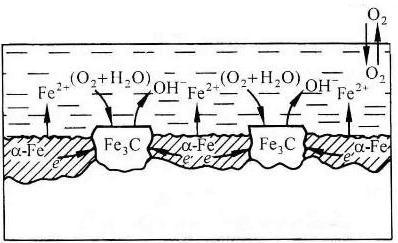 б) Рис.4. Схема коррозионного разрушения стали с водородной (а) и кислородной (б) деполяризациями Геометрическая неоднородность связана с наличием шероховатости поверхности, наличия острых углов, граней, которые приводят к разным значениям энергии Гиббса на отдельных участках поверхности и, следовательно, к разным потенциалам Е1 и Е2. На 11 выступах количество оборванных связей металла больше, чем во впадинах, соответственно и энергия Гиббса выпуклого участка больше, а потенциал поверхности на нем более отрицательный (выступ является анодом).    G1 G1 = - zFЕ1 = - zFЕ1     ● ●G2 = - zFЕ2 G1 > G2 ; Е1 < Е2 Контактная коррозия металлов. Электрохимическая коррозия может развиваться в результате контакта двух различных металлов. В результате будет возникать не микро-, а макрогальванопара. Сочетания металлов, сильно отличающихся значениями электродных потенциалов, в технике недопустимы (например, скрутки проводов алюминий – медь, соединение железа алюминиевыми или медными клепками и т.д.). На рис.5 показана коррозия железа, находящегося в контакте с медью. Возникает коррозионный гальванический элемент, в котором железо является анодом (Е°= -0,44 В), а медь – катодом (Е°= 0,34 В). Анодный процесс будет представлять собой растворение железа, катодный же будет определяться видом и составом коррозионной среды. 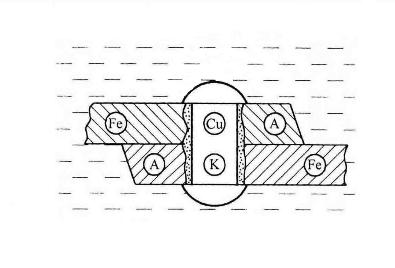  зона коррозии Рис. 5. Коррозия при контакте двух металлов Влияние неоднородности состава коррозионной среды может приводить к образованию микрогальванопар даже на поверхности одного и того же металла. Примером может служить коррозия 12 |
