методичка для лабор химия. Методические указания к лабораторным работам для студентов i курса
 Скачать 0.78 Mb. Скачать 0.78 Mb.
|
4.4 Контрольные вопросы и задачи1 Какие классы неорганических соединений известны? 2 Какие вещества называются оксидами? Приведите примеры основных, кислотных, амфотерных оксидов. 3 Сгруппируйте указанные оксиды по их характеру (основные, кислотные, амфотерные): ZnO, N2O3, CO2, K2O, Al2O3, SO3, CaO, FeO. 4 Напишите уравнения реакций получения оксидов нагреванием следующих веществ: Fe(OH)2, Fe(OH)3, H2WO4, Cu(OH)2. 5 Какие вещества называются основаниями? Как они классифицируются по растворимости? Приведите примеры. 6 Выпишите основные остатки, которые могут быть получены из перечисленных ниже гидроксидов: Mg(OH)2, Cr(OH)3, NaOH, Ba(OH)2, Fe(OH)3. 7 Какие вещества называются кислотами? Чем определяется основность кислот? 8 Приведите примеры двух -, трехосновных кислот. 9 Найдите формулы ангидридов указанных ниже кислот: H2SO4, H2SO3, H3PO4, H2SiO3, HMnO4. 10 Какие вещества называют солями? На какие группы делятся соли? Приведите примеры. 11 Как диссоциируют средние, основные, кислые соли? Приведите примеры на каждый тип солей. 12 С какими из перечисленных будет взаимодействовать соляная кислота: N2O3, Cr(OH)3, MgO, AgNO3, H2SO4? 13 Какие из указанных ниже веществ будут реагировать с гидроксидом натрия: HNO3, BaO, SO3, FeCl3, Zn(OH)2, P2O5? 14 Составьте уравнения реакций, с помощью которых можно осуществить указанные ниже превращения: MgO ® MgCl2 ® Mg(NO3)2 ®MgSO4 Fe(OH)3 ® FeCl3 ® Fe(NO3)3 ® Fe(OH)3 5 ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ ДИОКСИДА УГЛЕРОДА Лабораторная работа № 2 5.1 Цель лабораторной работы. Определение молярной массы диоксида углерода по плотности газа и на основе уравнения Клайперона –Менделеева. 5.2 Теоретическая часть Молярная масса - это масса одного моля вещества. Моль – количество вещества, которое содержит столько определенных структурных единиц (молекул, атомов, ионов и т.д.), сколько атомов содержится в 12 г (0,012 кг) углерода – 12. Определение молярной масс газа может быть выполнено несколькими способами. Определение молярной массы по плотности газа. Плотностью одного газа по другому называется отношение масс равных объемов двух газов, измеренных при одинаковых условиях, т.е. d = где d – плотность одного газа по другому; m1 и m2 – массы равных объемов двух газов. Поскольку в соответствии с законом Авогадро в равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул, то 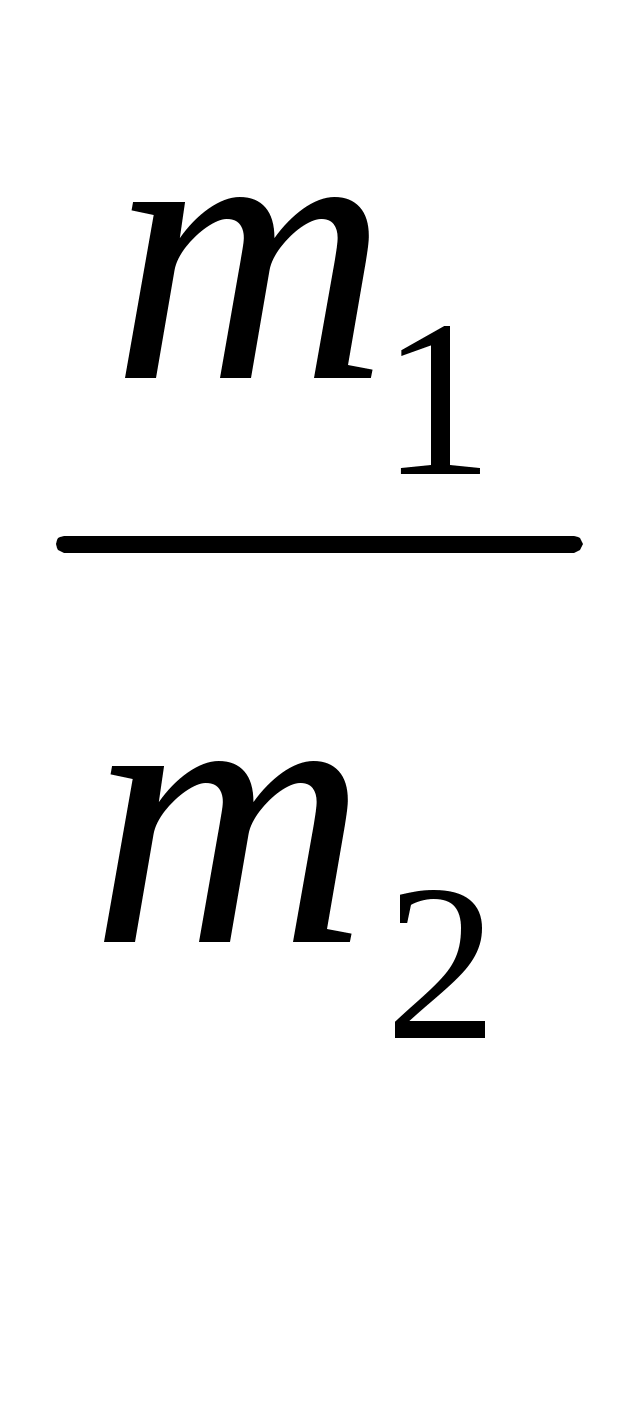 = =где М1 и М2 – молярные массы двух газов. Сравнивая соотношения (5.1) и (5.2), получим: d = Это соотношение используется для определения молярной масс газа, если известна плотность данного газа по другому (если есть возможность ее определить) и молярная масса другого газа. Чаще всего пользуются плотностью по водороду ( где М – молярная масса исследуемого газа, М(Н2) – молярная масса водорода, равная 2 г/моль, М(возд.) – молярная масс воздуха, равная 29 г/моль. Определение молярной массы газа по молярному объему. При нормальных условиях (Т=273 К, Р= 101,3 кПа) один моль любого газа занимает объем, равный 22,4 л. Поэтому, замерив массу определенного исследуемого газа при н.у. и пересчитав на 22,4 л, получим тем самым значение его молярной массы. Пример. Вычислить молярную массу газа, если при н.у. 0,312 г его занимают объем 0,25 л. Решение: 0,312 г газа -------------- 0,25 л Х -------------- 22,4 л. Х = 28,0 г. Ответ. Молярная масса газа равна 28,0 г/моль 5.2.3 Определение молярной массы по уравнению Клайперона- Менделеева. где Р – давление газа, кПа; V – объем газа, л; T – температура, К; M – молярная масса, г/моль; m – масса газа, г; R – универсальная газовая постоянная, равная 8,314 5.3 Экспериментальная часть5.3.1 Опыт 1.Определение молярной массы диоксида углерода Диоксид углерода порлучается в аппарате Киппа при взаимодействии мрамора (карбонат кальция) и соляной кислоты. Написать уравнение реакции. Чистую и сухую колбу емкостью 300-350 мл закрыть резиновой пробкой. Карандашом по стеклу отметить уровень, до которого доходит пробка в горло колбы. Колбу с пробкой взвесить на технохимических весах с точностью до 0,01 г. Записать массу колбы с воздухом (m1). Наполнить колбу диоксидом углерода, для чего опустить в колбу до дна газоотводную трубку от аппарата Киппа и пропускать газ в течение 3-4 минут, затем, не закрывая крана, осторожно вынуть стеклянную трубку, закрыть колбу пробкой (она должна входить до метки). После этого закрыть кран аппарата Киппа (или зажим на газоотводной трубке). Взвесить колбу с диоксидом углерода с точностью до 0,01 г, записать массу m2. Вторично пропустить газ из аппарата Киппа в течение 2-3 минут и снова взвесить колбу. Если разница в массе при двух последних взвешиваниях не превышает 0,01 г, колба считается заполненной. Записать температуру и атмосферное давление по барометру-анероиду (t и Р). Измерить объем колбы, наполнив ее водой до метки. Воду из колбы вылить в мерный цилиндр, объем воды равен объему диоксида углерода. Записать эту величину (V). Вычисления А) Масса диоксида углерода в колбе ( где mв – масса воздуха, которым была заполнена колба. Величины m1 и m2 определены экспериментально. Массу воздуха (mв) нужно подсчитать по уравнению Клайперона-Менделеева: где 29 - средняя молекулярная масса воздуха. Вычислить массу диоксида углерода ( В) Вычислить мольную массу диоксида углерода по уравнению Клайперона-Менделеева: С) Подсчитать относительную ошибку опыта: П = 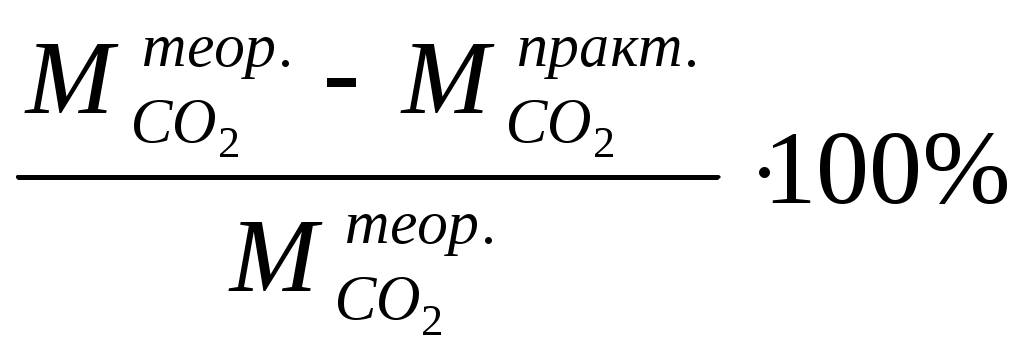 5.4 Контрольные вопросы и задачи 1 Что называется относительной молекулярной массой вещества? В каких единицах она измеряется? 2 Что такое моль? 3 Что называется молярной массой вещества? В каких единицах она измеряется? 4 Что называется относительной плотностью одного газа по другому? 5 Методы определения молярной массы газов и паров. 6 Плотность газа по кислороду равна 2. Вычислить молярную массу этого газа. 7 Масса 0,5 л газа при н.у. равна 1,58 г. Вычислить плотность этого газа по водороду. 8 Какой объем при н.у. займут: а) 17 г аммиака; б) 17 г сероводорода. 9 2 г диоксида серы при 230С занимают объем 500 мл. Под каким давлением находится газ? 6 ЭКВИВАЛЕНТ И МОЛЯРНАЯ МАССА ЭКВИВАЛЕНТОВ Лабораторная работа № 3 6.1 Цель работы Ознакомление с понятием эквивалента, определение молярной массы эквивалентов. 6.2 Теоретическая часть Закон постоянства состава гласит, что каждое химическое соединение имеет постоянный состав независимо от способа его получения. Отсюда следует, что элементы соединяются друг с другом в строго определенных количественных соотношениях. Поэтому в химии были введены понятия «эквивалент» и «молярная масса эквивалентов» (эквивалентная масса) Эквивалентом элемента называют такое его количество, которое соединяется с одним молем атомов водорода или же замещает это же количество атомов водорода в химических уравнениях реакциях. В химии единицей количества вещества является моль, а поэтому и эквивалент выражается в молях. Например, эквивалент хлора в соединениях HCl равен 1 моль, эквивалент серы в H2S равен ½ моль, эквивалент фосфора в РН3 равен 1/3 моль. Масса одного моля эквивалентов называется молярной массой эквивалентов вещества Мэ, г/моль. Так, в приведенных выше соединениях молярные массы эквивалентов хлора, серы, фосфора соответственно равны: Мэ(Cl) = 35,45 г/моль; Мэ(S) = ½ *32 =16 г/моль; Мэ(Р) = 1/3 * 30,9 = 10,3 г/моль. Понятие об эквивалентах и молярных массах эквивалентов распространяется и на сложные вещества. Эквивалентов сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или с одним эквивалентом любого другого вещества. Для расчета молярной массы эквивалентов можно использовать формулы: а) для простого вещества (элемента) где б) для сложного вещества: где М - молярная масса данного вещества; В - валентность функциональной группы; n - число функциональных групп в молекуле. Для кислот функциональной группой является ион водорода, для оснований – гидроксид-ион, для солей – ион металла. Например, Для определения состава эквивалентов вещества, участвующего в реакции, надо исходить из конкретной реакции. В этом случае надо учитывать следующее определение эквивалента: Эквивалент – это реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода в кислотно-основных и ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях. При решении задач содержащих сведения об объемах газообразных веществ, пользуются понятием объема моля эквивалентов. Как известно, моль любого газа при н.у. занимает объем, равный 22,4 л. Исходя из этой величины можно рассчитать объем одного моля эквивалентов газа при н.у. Например, для водорода: Э(Н2) = ½ Н2; моль эквивалентов водорода в два раза меньше его моля, и поэтому объем одного моля эквивалентов водорода в два раза меньше его молярного объема: 22,4 : 2 = 11,2 л Для кислорода Э(О2) = ¼ О2, отсюда объем одного моля эквивалентов кислорода в четыре раза меньше его молярного объема: 22,4 : 4 = 5,6 л Все вещества реагируют друг с другом в эквивалентных количествах. Массы участвующих в реакции веществ пропорциональны молярным массам их эквивалентов (закон эквивалентов). |
