методичка для лабор химия. Методические указания к лабораторным работам для студентов i курса
 Скачать 0.78 Mb. Скачать 0.78 Mb.
|
12.2.1 Степень диссоциацииКоличественной характеристикой процесса диссоциации является степень диссоциации, т.е. отношение числа молекул, распавшихся на ионы к общему числу растворенных молекул. α – выражается в процентах. По величине α электролиты делятся на три группы: 1. Электролиты, имеющие величину α = 3%, или 0,03, называются слабыми электролитами. 2. Электролиты, имеющие величину α от 3 до 30% или 0,03 – 0,2, называются электролитами средней силы. 3. Электролиты, имеющие величину α от 30% до 100%, т.е. от 0,3 до 1 – называются сильными. К сильным электролитам относятся практически все соли, гидроксиды щелочных и щелочно-земельных металлов и некоторые кислоты; например, соляная, серная, азотная, хлорная. К слабым электролитам относятся такие кислоты, как угольная, сернистая, сероводородная, азотистая, синильная, уксусная (и другие) и такие основания, как гидроксид аммония, гидроксид меди (II), гидроксид железа (II), гидроксид железа (III) и другие. 12.2.2 Константа электролитической диссоциацииЭлектролитическая диссоциация слабых электролитов – процесс обратимый. Для уксусной кислоты уравнение электролитической диссоциации можно записать так: СН3СООН ↔ СН3СОО - + Н + Применяя к этому равновесию закон действия масс, получим: 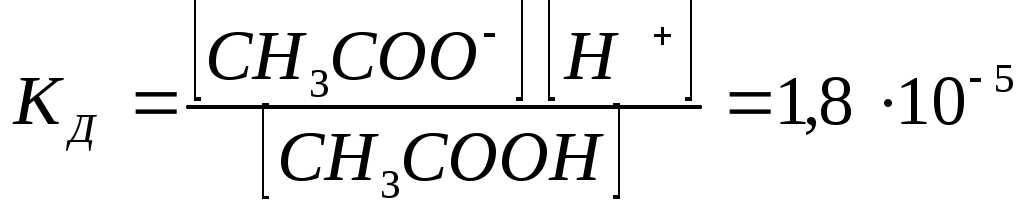 , (12.2) , (12.2)Константа равновесия КД характеризует в данном случае электролитическую диссоциацию СН3СООН и называется константой диссоциации. Чем больше ее величина, тем более ионизировано соединение. Для гидроксида аммония КД диссоциации может быть записана: NH4OH ↔ NH4 + + OH – 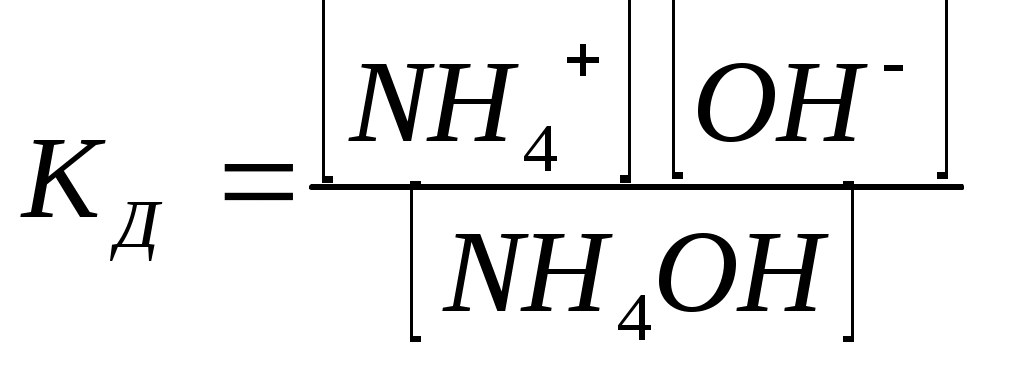 , (12.3) , (12.3)Так как константа диссоциации с изменением концентрации раствора не изменяется, она дает более общую характеристику электролита, чем степень диссоциации. Это верно, однако, лишь для слабых электролитов, растворы которых содержат сравнительно немного ионов. Напротив, у сильных электролитов, в виду большой концентрации ионов (α 12.2.3 Смещение равновесия электролитической диссоциацииБлагодаря тому, что диссоциация слабого электролита при данной температуру – величина постоянная, можно искусственно изменить концентрации ионов водорода или гидроксид-ионов, что будет соответствовать смещению равновесия в сторону недиссоциированных молекул электролита (в сторону обратной реакции – моляризации). Для смещения равновесия в раствор необходимо ввести одноименные ионы. 12.2.4 Диссоциация воды. Водородный показательПрименяя закон действия масс к диссоциации самой воды Н2О ↔ Н + +ОН- имеем: Обозначим «К ∙ Н2О» через КВ: получим [Н+] ∙ [ОН-] = КВ. Величина КВ называется ионным произведением воды. Число КВ можно найти, т.к. КВ и [H2O] известны: КВ = 1,86 ∙ 10-16, а [H2O] = 1000 : 18 = 55,56 (число молей в 1 литре воды). Значит КВ = 1,86 ∙ 10-16 ∙ 55,56 = 1 ∙ 10-14. Для чистой воды при [H+] = [ОН-] = рН = - lg[H+] [H+] моль/литр рН 1 2 3 4 5 6 7 [H+] моль/литр рН 8 9 10 11 12 13 14 В кислой среде [H+] > 1∙ 10-7 рН < 7 В нейтральной среде [H+] = 1∙ 10-7 рН = 7 В щелочной среде [H+] < 1 ∙ 10-7 рН > 7 Примеры: а) 0,01 М раствор соляной кислоты при диссоциации образует 0,01 моль ионов водорода, а [H+] = 0,01 или 10-2 моль/л и рН = - lg 10-2 = 2. б) В 0,1 М растворе едкого натра концентрации [ОH-] равна 0,1 или 1 ∙ 10-1 моль/л (т.к. NаОН сильный электролит. Определяем [H+]. Из ионного произведения воды: и рН = -lg 10-13 = 13. Практически реакцию среды определяют при помощи индикаторов – веществ, изменяющих свой цвет в зависимости от концентрации ионов Н+ и ОН-. Это так называемый колориметрический метод определения рН. |
