методичка для лабор химия. Методические указания к лабораторным работам для студентов i курса
 Скачать 0.78 Mb. Скачать 0.78 Mb.
|
13.3 Экспериментальная часть13.3.1 Опыт 1. Реакции с образованием слабого электролита Из имеющихся на столе реактивов подберите два таких, при взаимодействии которых получается слабый электролит (каждая группа предлагает свой вариант). Полученное вещество определите по запаху или изменению окраски индикатора. Напишите уравнения реакции в молекулярной и ионно-молекулярной форме, объясните сущность и причину необратимости данной реакции. 13.3.2 Опыт 2. Реакции с образованием осадков Подберите из имеющихся на столе такие реактивы, с помощью которых можно получить малорастворимое вещество (каждая группа получает осадок, отличающийся от других). Получите осадок того же состава взаимодействием других веществ. Напишите уравнения реакций в молекулярной и ионно-молекулярной форме, объясните сущность реакций получения малорастворимого вещества. Почему в двух опытах получился один и тот же осадок? 13.3.3 Опыт 3. Смещение равновесия при растворении осадка. Получите реакцией обмена гидроксид меди, добавьте к нему раствор соляной кислоты и наблюдайте процесс растворения осадка. Напишите молекулярное и ионно-молекулярное уравнения реакций. Что является причиной их практической необратимости? 13.3.4 Опыт 4. Образование осадков и произведение растворимости. В две пробирки налейте 1,0-1,5 мл 0,005 М раствора нитрата свинца. В одну из них прибавьте такой же объем 0,05 М раствора хлорида калия, а в другую – 0,05 М раствора иодида калия. В какой из пробирок выпал осадок? Объясните полученный результат, используя значения произведений растворимости. Составьте уравнения реакций. ПРPbCl2 = 2,3 ∙ 10 – 4; ПРPbI2 = 1,4 ∙ 10 –8 (25 0С) Результаты опытов оформите в виде таблицы:
13.4 Контрольные вопросы и задачи1 Какие реакции называются ионообменными? 2 В каких случаях реакции обмена в растворах необратимы? Приведите примеры. 3 Как протекают реакции с участием малодиссоциированных или малорастворимых соединений? 4 Что называется произведением растворимости? 5 Напишите в ионно-молекулярной форме уравнения реакций, приводящих к образованию осадков, газов и малодиссоцирующих соединений: а) FeSO4 + NaOH → б) K2CO3 + HCl → в) ZnS + HCl → г) HCl + KOH → д) NaNO2 + HCl → 6 Составьте в молекулярной форме уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями: а) Cu2+ + 2OH - → ↓ Cu(OH)2 б) Ni2+ + S2- → ↓ NiS в) HCO3- + H+ → H2O + CO2 ↑ г) H+ + OH - → H2O 14 ГИДРОЛИЗ СОЛЕЙ Лабораторная работа № 11 14.1 Цель лабораторной работы Изучение свойств водных растворов солей, подвергающихся гидролизу; составление уравнений гидролиза. 14.2 Теоретическая часть Гидролизом солей называется взаимодействие ионов соли с водой, в результате, которого образуется кислота (кислая соль) или основание (основная соль) и меняется реакция среды. Гидролизу подвергаются соли, в образовании которых участвовал хотя бы один слабый электролит. Известно три случая гидролиза солей: 14.2.1 Гидролиз соли, образованной слабой кислотой и сильным основанием: а) основание и кислота одноосновные: NaNO2 + HOH ↔ NaOH + HNO2 (молекулярное уравнение) Na + + NO2- + HOH ↔ Na+ + OH - + HNO2 (ионное уравнение) NO2- + HOH ↔ OH - + HNO2 , рН > 7 (сокращенное ионное уравнение) б) основание однооcновное, кислота многоосновна: (Количество ступеней гидролиза в данном случае определяется основностью слабой кислоты, но в обычных условиях протекает только первая ступень гидролиза). Na2CO3 + HOH ↔ NaOH + NaHCO3 2 Na+ + CO32- + HOH ↔ Na+ + OH - + Na+ + HCO3- CO32- + HOH ↔ OH - + HCO3- , рН > 7 14.2.2 Гидролиз соли, образованной слабым основанием и сильной кислотой: а) основание и кислота одноосновны: NH4Cl + HOH ↔ NH4OH + HCl NH4+ + Cl - + HOH ↔ NH4OH + H+ + Cl – NH4+ + HOH ↔ NH4OH - + H+ , рН < 7 б) основание многоосновно, кислота одноосновна: CrCl3 + HOH ↔ CrOHCl2 + HCl Cr3+ + HOH ↔ (CrOH)2+ + H+ , рН < 7 (количество ступеней гидролиза определяется кислотностью слабого основания, но в обычных условиях протекает только первая ступень). 14.2.3 Гидролиз, соли образованной слабым основанием и слабой кислотой: а) CH3COONH4 + HOH ↔ CH3COOH + NH4OH В данном случае оба иона воды связаны ионами соли до слабых электролитов, и реакция раствора может быть нейтральной, слабокислой, слабощелочной в зависимости от константы диссоциации продуктов гидролиза. б) основание многоосновно, кислота одноосновна: Al(NO2)3 + HOH ↔ AlOH(NO2)2 + HNO2 Al3+ + NO2- + HOH ↔ HNO2 + AlOH2+ , рН В данном случае реакция определяется так же, как и в выше указанном примере. в) основание и кислота многоосновны. Если кислота летучая, а основание малорастворимо, то гидролиз идет до конца, т.е. такие соли в растворе существовать не могут. Al2S3 + 6 HOH = ↓ 2 Al(OH)3 + 3 H2S ↑ Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются, т.к. не образуются малодиссоциируемые соединения. Степенью гидролиза называется отношение числа гидролизованных молей к общему числу растворенных молей: Гидролиз – реакция обратимая. Нагревание и разбавление раствора смещает равновесие гидролиза в сторону прямой реакции, т.е. усиливают гидролиз. 14.3 Экспериментальная часть14.3.1 Опыт 1. Гидролиз нормальных (средних) солей Из имеющихся на столе солей выберите такую, при гидролизе которой получается щелочная реакция среды. В пробирку с дистиллированной водой поместите несколько кристалликов этой соли, при помощи индикатора докажите, что реакция среды стала щелочной. Напишите уравнение реакции в молекулярной и ионно-молекулярной форме. Аналогичный опыт проделайте с другими солями: а) в результате гидролиза получается кислая реакция среды; б) в результате гидролиза получается нейтральная среда; в) гидролиз соли не идет. Во всех случаях с помощью индикатора покажите, какая реакция среды получилась в результате гидролиза, объясните протекающие процессы. Напишите уравнение реакции в молекулярной и ионно-молекулярной форме. 14.3.2 Опыт 2. Гидролиз кислых солей. В пробирку с дистиллированной водой добавьте три капли фенолфталеина и несколько кристалликов гидрофосфата натрия Na2HPO4. Сравните интенсивность окраски раствора с окраской раствора средней соли Na3PO4 из первого опыта. Составьте уравнение гидролиза гидрофосфата натрия. Объясните, какие из солей – нормальные или кислые, лучше подвергаются гидролизу и почему? 14.3.3 Опыт 3. Смещение равновесия гидролиза при разбавлении и влияние среды на степень гидролиза. В стаканчик или колбочку налейте 25 мл водопроводной воды и добавьте 1-2 капли прозрачного концентрированного раствора нитрата свинца Pb(NO3)2. Наблюдайте образование осадка основной соли. Составьте уравнение гидролиза. Добавьте к осадку небольшое количество концентрированной азотной кислоты. Что наблюдается? Дайте объяснение, исходя из константы равновесия гидролиза. 14.3.4 Опыт 4. Смещение равновесия гидролиза при изменении температуры. Налейте в пробирку 2-3 мл раствора ацетата натрия и добавьте три капли фенолфталеина. Содержимое пробирки разделите на две части, одну из них оставьте для сравнения, другую – нагрейте до кипения. Сравните окраску раствора в обеих пробирках. Дайте пробирке охладиться и снова сравните окраску раствора в обеих пробирках, поясните свои наблюдения. Составьте уравнение гидролиза соли в молекулярной и ионно-молекулярной форме. Сделайте вывод о влиянии температуры на гидролитическое равновесие. 14.4 Контрольные вопросы и задачи1 Что такое гидролиз солей? 2 Какие соли подвергаются гидролизу? 3 Степень гидролиза. 4 Константа равновесия гидролиза. 5 Влияние разбавления на смещение равновесия гидролиза. 6 Влияние изменение температуры на смещение равновесия. 7 Имеются растворы солей NaCl, CuCl2, Na2CO3. В каком случае рН раствора: а) меньше 7; б) больше 7? Ответ поясните, составив уравнение гидролиза в молекулярной и ионной форме. 8 Укажите, какие из перечисленных ниже солей подвергаются гидролизу: K2S, Fe2(SO4)3, MgCl2, Cr(NO3)3, KCl, NaNO3, Na2SiO3. Для каждой из гидролизующихся солей напишите уравнения гидролиза (для первой ступени гидролиза). 9 При сливании водных растворов Cr(NO3)3 и Na2S образуется осадок гидроксида хрома и выделяется газ. Составьте молекулярное и ионно-молекулярное уравнение реакции. 15 КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Лабораторная работа № 12 15.1 Цель лабораторной работы Изучение явления комплексообразования; изучение свойств различных комлексных соединений. 15.2 Теоретическая часть Комплексными соединениями называются такие соединения, в узлах кристаллической решетки которых находятся комплексные ионы, способные к существованию в растворе. Теорию комплексных соединений выдвинул А Верне. По координационной теории комплексных соединений можно привести схему: K   3 3    внешняя сфера координационное координационное число комплексообразователь лиганды внутренняя сфера В растворах комплексные соединения диссоциируют ступенчато: комплексный внешняя ион сфера Комплексные ионы диссоциируют как слабые электролиты: Их диссоциация подчиняется закону действия масс, количественно характеризуется константой нестойкости: Кнест= 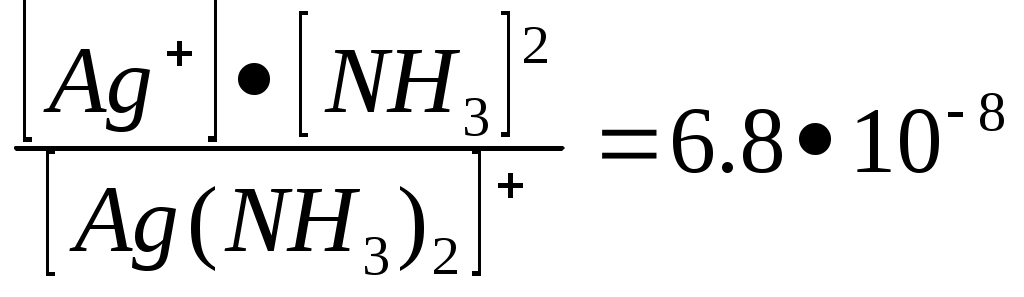 Сложные двойные соли отличаются от комплексных соединений малой устойчивостью, они при растворении полностью распадаются на составляющие ионы (в одну стадию). Например: КАI (SO4)2 15.3 Экспериментальная часть 15.3.1 Опыт 1. Образование анионного комплексного соединения. Налейте в пробирку 1-2 мл. раствора Ag NO3 и добавьте немного раствора NaCl. К образовавшемуся осадку прилейте раствор тиосульфата натрия до его растворения. Составьте уравнения реакций. 15.3.2 Опыт 2. Образование катионного комплексного соединения. Налейте в пробирку 1-2 мл. раствора Си SO4 и прибавьте по каплям раствор аммиака до образования осадка Си (ОН)2, затем прилейте избыток раствора аммиака до растворения осадка. Составьте уравнения реакций. 15.3.3 Опыт 3. Различие между простыми и комплексными ионами железа (111). А) К 1-2 мл. раствора FeCl3 прилейте немного раствора NH4SCN. Эта реакция характерна для катиона Fe3+. Напишите уравнение реакции. Б) Определите, обнаруживается ли катион Fe3+ в растворе К3 В) Налейте в пробирку немного раствора К3 Реакция образования турнбулевой сини является характерной для комплексного иона. 15.3.4 Опыт 4. Гидратная изомерия. Аквакомплекс. Стеклянной палочкой, смоченной раствором СоСl2, напишите что либо на листе фильтровальной бумаги, затем подсушите над пламенем спиртовки, а затем подержите над водяным паром. Что наблюдается? Объясните происходящее явление. 15.4 Контрольные вопросы и задачи. 1 Какие соединения относятся к комплексным соединениям? 2 Строение комплексных соединений (по координационной теории). 3 Диссоциация комплексных соединений. 4 Константа нестойкости комплексного иона. 5 Номенклатура комплексных соединений. 6 Определите степень окисления и координационное число комплексообразователя в следующих соединениях и запишите их названия: А) К Г) К3 7 Пользуясь таблицей констант нестойкости расположите в порядке повышения устойчивости следующие ионы: 8 Напишите в молекулярной и ионной форме уравнения реакций между Си(NO3)2 и К4 9 Сколько миллилитров 0,1 Н раствора АgNO3 требуется для осаждения ионов Сl- из Константы нестойкости некоторых комплексных ионов
|
