методичка для лабор химия. Методические указания к лабораторным работам для студентов i курса
 Скачать 0.78 Mb. Скачать 0.78 Mb.
|
6.3 Экспериментальная часть6.3.1 Опыт 1. Определение молярной массы эквивалентов металла методом вытеснения водорода. Метод основан на измерении объема водорода, который выделяется из кислоты при действии на нее активного металла (Mg, Zn, Al). Применяемый для этой цели прибор (рис. 1) состоит из двух бюреток, укрепленных на штативе и соединенных резиновой трубкой. В такой сообщающийся сосуд наливают воду приблизительно до половины бюреток. Одну из бюреток сверху закрывают пробкой с отводной трубкой, к которой присоединяют пробирку, где происходит реакция между кислотой и металлом. Другая пробирка служит приемником для воды, вытесняемой выделяющимся при реакции водородом. Объем выделившегося водорода определяется по разности уровней воды в любой из бюреток до и после опыта при добавлении в закрытой бюретке, равном атмосферному. Давление газа в закрытой бюретке равно атмосферному, если вода в обеих бюретках находится на одном уровне. Рисунок. 1 – Схема установки. Получите навеску металла (m) у лаборанта. В пробирку налейте 10% раствора соляной кислоты (на одну четверть пробирки). Поддерживая пробирку в наклонном положении, поместите навеску металла на стенку у отверстия пробирки и закройте пробирку пробкой с отводной трубкой от бюретки. Проверьте герметичность прибора. Для этого, не трогая бюретку с пробиркой, переместите другую бюретку вместе с лапкой штатива так, чтобы уровень воды в ней стал на 5-10 см выше, чем в первой бюретке. Если разница в уровнях не меняется, прибор исправен. Приведите воду в бюретках к одному уровню и отметьте уровень воды в открытой бюретке (V1). Отсчет произведите по нижнему мениску жидкости с точностью до 0,01 мл. Стряхните металл в кислоту (смойте его кислотой). Наблюдайте выделение водорода и вытеснения воды из бюретки. По окончании реакции дайте пробирке охладиться на воздухе, после чего снова приведите воду в бюретках к одинаковому уровню. Запишите новый уровень воды в открытой бюретке – V2, по разности уровней воды до и после реакции (V2-V1) определите объем выделившегося водорода. Запишите показания термометра (t), барометра (р) и давление водяного пара при температуре опыта (при t = 23 0C рв. пара = 2,8 кПа, при t = 25 0C рв. пара = 3,2 кПа). Вычисления: А) Объем выделившегося водорода: В) Объем водорода при н.у. С) Теоретическая молярная масса эквивалентов металла (МЭ). Опытная молярная масса эквивалентов металла m г металла вытесняют V0 мл водорода x ------------------------- 11200 мл Е) Относительная ошибка опыта (П) в %. 6.3.2 Опыт 2. Определение молярной массы эквивалентов карбоната кальция. На технохимических весах взвесьте кусочки мрамора общей массой (m1) от 2 до 2,5 г (с точностью до 0,01 г). Поместите их в колбу или химический стакан емкостью 100 мл и добавьте небольшими порциями из бюретки 10 мл 1 н раствора соляной кислоты. Составьте уравнение реакции (учитывая, что мрамор – природный минерал, содержащий карбонат кальция). В процессе реакции выделяется газ. Когда выделение пузырьков газа прекратится, нагрейте колбу (стакан) до 60-70 0С для удаления оставшегося в растворе газа. Полученный раствор осторожно слейте, оставшийся мрамор промойте 2 раза дистиллированной водой, каждый раз осторожно сливая жидкость. Промытые кусочки мрамора промокните фильтровальной бумагой и поместите в эксикатор, после чего взвесьте (m2). Вычисления А) Масса карбоната кальция, вступившего в реакцию с соляной кислотой: В) Количество молей эквивалентов HCl, израсходованных на реакцию с CaCO3, равно (1 мл 1 н раствора HCl содержит 0,001 молей эквивалентов). С) В соответствии с законом эквивалентов с 0,01 моль эквивалентов HCl прореагирует 0,01 моль эквивалентов CaCO3, что соответствует убыли массы , т.е. откуда D) Вычислите теоретическое значение молярной массы эквивалентов CaCO3 и сравните с полученной экспериментальной величиной. Е) Вычислить относительную ошибку опыта по формуле: 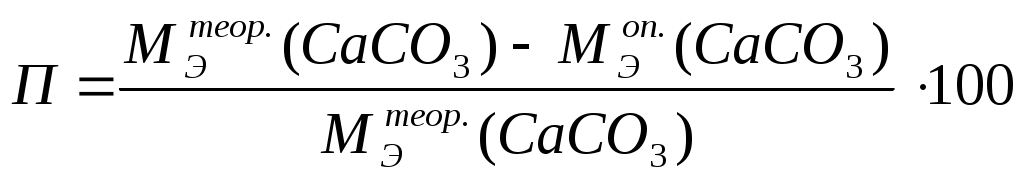 (6.9) (6.9)6.4 Контрольные вопросы и задачи 1 Что называют эквивалентом элемента (простого вещества), сложного вещества? 2 Что называют молярной массой эквивалентов? 3 Как определить молярную массу эквивалентов оксида, кислоты, основания, соли? 4 Сколько молей эквивалентов цинка вступило в реакцию с кислотой, если при этом выделилось 2,8 л водорода при н.у.? 5 Вычислите молярную массу эквивалентов и валентность фосфора в его оксиде, содержащем 43,6 % кислорода. 6 При взаимодействии 6,75 г металла с серой образовалось 18,75 г сульфида. Рассчитайте молярную массу эквивалентов металла. 7 ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ И ОДНОАТОМНЫХ ИОНОВ |
