Химия методичка. Методические указания к написанию и оформлению контрольной работы по химии
 Скачать 0.91 Mb. Скачать 0.91 Mb.
|
Таблица 3.1.Степени окисления фосфора, серы, хлора
Для большинства элементов главных подгрупп высшая степень окисления равна номеру группы, в которой находится элемент, а низшая степень окисления равна разности N–8, где N – номер группы. Ответ на вопрос задачи см. в табл. 3.1. Пример 3.2. На каком основании марганец и бром расположены в одном периоде (4), одной VII группе, но разных подгруппах – А и В? Решение. Электронная конфигурация атомов марганца и брома соответственно – 25Mn [Ar]3d54s2; 35Br [Ar]4s24p5. Количество заполняющихся энергетических уровней в атомах указанных элементов равно 4, значит это элементы 4 периода. Сумма валентных электронов у каждого атома равна 7, следовательно, это элементы VII группы. Но валентные электроны атома марганца расположены на 4s-подуровне внешнего и d-подуровне предвнешнего уровня, значит, это d-элемент и расположен в побочной подгруппе (В). Валентные электроны атома брома находятся на p- и s-подуровнях внешнего уровня. Следовательно, это p-элемент и расположен в главной подгруппе (А). Пример 3.3. У какого из элементов четвертого периода – ванадия или мышьяка – сильнее выражены металлические свойства? Какой из этих элементов образует газообразное соединение с водородом? Решение. Электронные конфигурации атомов данных элементов 23V [Ar]3d34s2; 33As [Ar]4s24p3. Ванадий – d-элемент VB-группы, а мышьяк – p-элемент VA-группы. На внешнем энергетическом уровне у атома ванадия два электрона, а у атома мышьяка – пять. Принадлежность элемента к металлам или неметаллам определяется, в основном, числом электронов на внешнем энергетическом уровне. Атомы металлов на внешнем уровне содержат 1–2, реже 3 электрона. Металлы проявляют только восстановительные свойства и, отдавая свои электроны, переходят в положительно заряженные ионы. Отрицательно заряженных ионов металлы не образуют. Атомы неметаллов на внешнем энергетическом уровне имеют 4–7 электронов. Они могут как принимать электроны, т. е. выступать в качестве окислителей, так и отдавать электроны, т. е. быть восстановителями. У неметаллов окислительная функция выражена сильнее, чем восстановительная. Атомы неметаллов образуют отрицательно заряженные ионы. Таким образом, ванадий, как и все металлы, обладает только восстановительными свойствами, тогда как для мышьяка более свойственны окислительные функции. Общей закономерностью для всех групп, содержащих р- и d-элементы, является преобладание металлических свойств у d-элементов. Следовательно, металлические свойства у ванадия выражены сильнее, чем у мышьяка. Газообразное соединение с водородом образует неметалл мышьяк (As–3H3). Пример 3.4. Вычислите молярную массу и назовите элемент, высший оксид которого отвечает формуле ЭО3, образует с водородом газообразное соединение, массовая доля водорода в котором 1,54%. Решение. Вычислим содержание элемента в гидриде, приняв массу гидрида за 100%: 100 – 1,54 = 98,46%, т. е. на 98,46 частей массы элемента приходится 1,54 частей массы водорода или на 98,46 г элемента приходится 1,54 г водорода. Зная, что молярная масса эквивалентов водорода равна 1 г/моль, определим молярную массу эквивалентов элемента в гидриде по закону эквивалентов: Элемент образует высший оксид ЭО3, следовательно, он находится в VI группе. Его высшая степень окисления в соединении с кислородом +6, а низшая – в соединении с водородом –2. Находим молярную массу элемента из соотношения: Контрольные вопросы41. Исходя из положения марганца, рубидия, мышьяка в периодической системе, составьте формулы оксидов, отвечающих их высшей степени окисления, и соответствующих им гидроксидов. 42. У какого из р-элементов VII группы – хлора или иода – сильнее выражены неметаллические свойства? Почему? Исходя из высшей степени окисления элементов, напишите формулы кислородсодержащих кислот. Какая из них более сильная? 43. У какого элемента пятого периода – молибдена или теллура – сильнее выражены металлические свойства? Ответ мотивируйте, записав электронные конфигурации атомов этих элементов. Какой из них образует газообразное соединение с водородом? Составьте формулу этого соединения. 44. Исходя из положения металла в периодической системе, дайте мотивированный ответ на вопрос: какой из двух гидроксидов более сильное основание: а) Mg(OH)2 или Ba(OH)2; б) Ca(OH)2 или Co(OH)2; в) Ca(OH)2 или Zn(OH)2? Напишите уравнения реакций, доказывающих амфотерность гидроксида цинка. 45. Один из элементов III группы образует оксид с массовой долей кислорода 25,6%. Рассчитайте молярную массу элемента и назовите этот элемент. (Ответ: 69,7 г/моль). 46. Марганец образует соединения, в которых он проявляет степени окисления +2, +3, +4, +6, +7. Составьте формулы его оксидов и гидроксидов, отвечающих этим степеням окисления. 47. Что называется энергией ионизации? Как изменяется восстановительная активность элементов в главных и побочных подгруппах периодической системы с увеличением порядкового номера? Почему? Значения энергии ионизации элементов I группы соответственно равны (в эВ): Li – 5,4; Cs – 3,9; Cu – 7,7; Au – 9,2. У элементов какой подгруппы восстановительные свойства выражены более резко? 48. Назовите элемент по следующим данным: а) элемент 4 периода, высший оксид Э2О7, с водородом образует газообразное соединение НЭ; б) элемент 5 периода, высший оксид ЭО2, с водородом газообразных соединений не образует; в) элемент 4 периода, высший оксид ЭО, с водородом дает солеобразное соединение ЭН2. 49. Исходя из положения элемента в периодической системе, дайте мотивированный ответ на вопрос: как изменяется сила кислот в рядах: а) H2SO4→H2SeO4→H2TeO4; б) H4SiO4→H3PO4→H2SO4→HСlO4? 50. Что называется сродством к электрону? Как изменяется окислительная активность неметаллов в периоде и в группе периодической системы с увеличением порядкового номера? Какой из атомов – хлор или йод – является окислителем при образовании молекулы ICl из атомов? 51. Вычислите массовую долю (в %) элементов в высших оксидах: а) селена; б) рения; в) осмия; г) индия. (Ответ: 62,2%; 76,9%; 74,8%; 82,7%). 52. Составьте формулы оксидов и гидроксидов элементов третьего периода, отвечающих их высшей степени окисления. Как изменяется кислотно-основной характер этих соединений при переходе от натрия к хлору? Напишите уравнения реакций, доказывающих амфотерность гидроксида алюминия. 53. Почему элементы №39 и №49 расположены в одном периоде (5), одной III группе, но разных подгруппах – А и В? 54. Вычислите молярную массу и назовите элемент, высший оксид которого отвечает формуле Э2О5, образует с водородом газообразное соединение, массовая доля водорода в котором 8,82%. (Ответ: 31 г/моль). 55. Напишите формулы высших оксидов и их гидроксидов для элементов с порядковыми номерами 4; 37; 75. Напишите уравнения реакций, доказывающих амфотерный характер гидроксида бериллия. 56. Какие водородные соединения образуют р-элементы третьего периода? Как изменяются кислотные свойства этих соединений в периоде слева направо? 57. Исходя из степени окисления атомов соответствующих элементов, дайте мотивированный ответ на вопрос: какой из двух гидроксидов является более сильным основанием: а) Cr(OH)2 или Cr(OH)3; б) CuOH или Cu(OH)2; в) Fe(OH)2 или Fe(OH)3? 58. Какую низшую степень окисления проявляют кремний, азот, селен, бром? Составьте формулы соединения магния с данными элементами в этой их степени окисления. 59. Исходя из положения элементов в периодической системе и их степеней окисления, дайте мотивированный ответ, какой из оксидов должен быть более сильным окислителем: а) CrO3 или WO3? б) B2O3 или Tl2O3? 60. Какую низшую и высшую степени окисления проявляют углерод, мышьяк, теллур и йод? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления. 4. Энергетика и направление химических процессов Химические реакции сопровождаются выделением или поглощением теплоты. Реакции, протекающие с выделением теплоты в окружающую среду, называются экзотермическими, а с поглощением теплоты – эндотермическими. Количество теплоты, которое выделяется или поглощается при химической реакции, называется тепловым эффектомреакции. Тепловой эффект реакции, протекающей в условиях р=const, T=const, равен изменению энтальпии системы ∆Н и измеряется в кДж. При экзотермической реакции энтальпия системы уменьшается и ∆Н < 0, а при эндотермической – энтальпия системы увеличивается и ∆Н > 0. Если исходные вещества и продукты реакции находятся в стандартном состоянии, то энтальпию реакции называют стандартной и обозначают ∆Н0 или ∆Н0298. Верхний индекс отвечает стандартному давлению (101кПа), нижний индекс соответствует стандартной температуре, принятой по международному соглашению, равной 298 К. Уравнения химических реакций, в которых указаны изменения энтальпии (тепловые эффекты реакций), называются термохимическими. Например, термохимическое уравнение: N2(г) + 3Н2 (г) = 2NH3 (г), ∆Н0х.р = –92, 4 кДж. показывает, что при взаимодействии 1 моль N2 и 3 моль Н2 образуется 2 моль NH3 и выделяется количество теплоты, равное 92, 4 кДж. В основе термохимических расчетов лежит закон Гесса: тепловой эффект химической реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса. Часто в термохимических расчетах применяют следствие из закона Гесса: энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов реакции. Например, стандартная энтальпия реакции aA+bB=сС+dD рассчитывается по формуле: ∆Н0х.р =(с∆fН0С+ d∆fН0D) – (a∆fН0A+ b∆fН0B), где ∆fН0 – стандартная энтальпия образования соединения. Стандартной энтальпией образования называется стандартная энтальпия реакции образования 1 моль сложного вещества из простых веществ, устойчивых при 298 К и давлении 101 кПа. Обозначается ∆fН0298или ∆fН0 (температуру 298 К можно опустить), измеряется в кДж/моль. ∆fН0 простых веществ равна нулю. Направление протекания химической реакции определяет энергия Гиббса (∆G). При р=const, T=const реакция самопроизвольно протекает в том направлении, которому отвечает убыль энергии Гиббса. Если ∆G < 0, то реакциясамопроизвольно протекает в прямом направлении. Если ∆G > 0, то самопроизвольное протекание процесса в прямом направлении невозможно. Если ∆G = 0, то реакция может протекать как в прямом направлении, так и в обратном и система находится в состоянии равновесия.Изменение ∆Gх.р не зависит от пути процесса и может быть рассчитано по следствию из закона Гесса: изменение энергии Гиббса в результате химической реакции равно сумме энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов. Например, стандартная энергия Гиббса реакции aA + bB = сС + dD рассчитывается по формуле: ∆G0х.р. = (с∆fG0С+d∆fG0D) – (a∆fG0A + b∆fG0B), где ∆fG0– стандартная энергия Гиббса образования вещества. Она относится к 1 моль вещества и измеряется в кДж/моль. Энергия Гиббса образования простых веществ равна нулю. ∆G0х.р имеет ту же размерность, что и энтальпия, и поэтому обычно выражается в кДж. Изменение стандартной энергии Гиббса химической реакции может быть также вычислено по уравнению: ∆G0х.р. = ∆Н0х.р – Т∆S0х.р. , где Т – абсолютная температура, ∆S0х.р. – изменениеэнтропии. Энтропия – является мерой неупорядоченности состояния системы. Энтропия – это стремление частиц (молекул, ионов, атомов) к хаотическому движению, а системы – к переходу от более упорядоченного состояния к менее упорядоченному. Энтропия возрастает с увеличением движения частиц: при нагревании, испарении, плавлении, расширении газа, при ослаблении или разрыве связей между атомами и т.п. Процессы, связанные с упорядоченностью системы (конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация), сопровождаются уменьшением энтропии. Измеряется энтропия в Дж/мольК. Изменение энтропии системы в результате протекания химической реакции (∆S) (энтропия реакции) равно сумме энтропий продуктов реакции за вычетом суммы энтропий исходных веществ с учетом стехиометрических коэффициентов. Изменение энтропии в результате протекания химической реакции aA + bB = сС + dD равно: ∆S0х.р.= (сS0С + dS0D ) – (aS0A + bS0 B) При химическом взаимодействии одновременно изменяется энтальпия, характеризующая стремление системы к порядку, и энтропия, характеризующая стремление системы к беспорядку. Если тенденции к порядку и беспорядку в системе одинаковы, то ∆H0х.р. = Т∆S0х.р., что является условием равновесного состояния системы. Если пренебречь изменениями ∆H0х.р. и ∆S0х.р с увеличением температуры, то можно определить температуру, при которой устанавливается равновесие химической реакции для стандартного состояния реагентов Травн.= 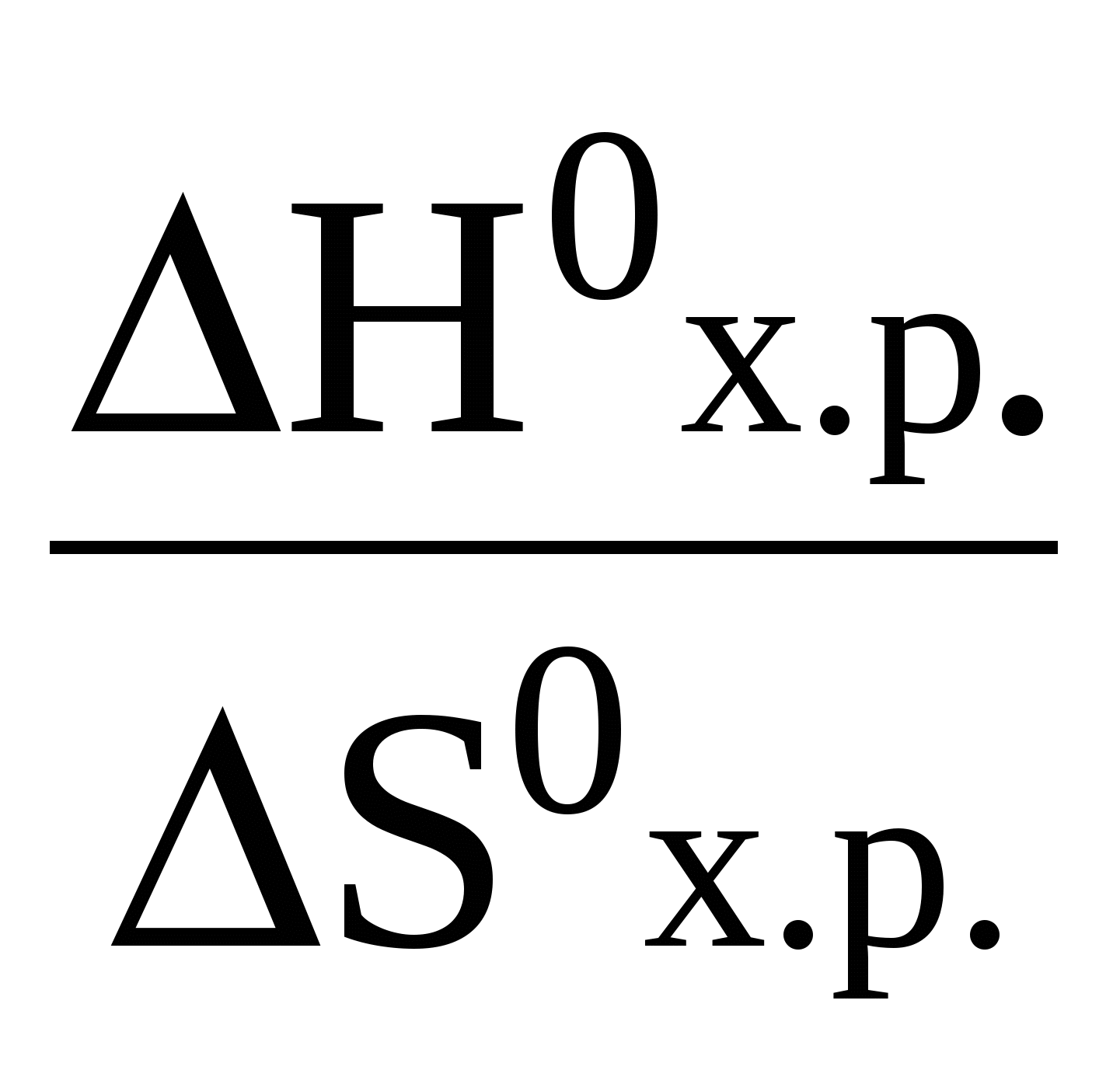 При решении задач этого раздела следует пользоваться табл. 1 приложения. Пример 4.1. Вычислите тепловой эффект и напишите термохимическое уравнение реакции горения ацетилена, в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании 10 л ацетилена (н.у.)? Решение. Реакция горения ацетилена протекает по уравнению: С2Н2(г) + 5½О2 (г) = 2СО2(г) + Н2О(г) Пользуясь следствием из закона Гесса и справочными данными из табл.1, вычисляем тепловой эффект этой реакции: 0х.р. =(2f 0СО2 + f 0Н2О) – (f 0C2H2 + 5½f 0O2) 0х.р. = [2(-393,5)+ (-241,8)] – (226,8+ 5½0)= – 1255,6 кДж Термохимическое уравнение реакции горения ацетилена имеет вид: С2Н2(г) + 5½О2 (г) = 2СО2(г) + Н2О(г), 0х.р. = –1255,6 кДж Тепловой эффект обычно относят к одному молю вещества. Следовательно, при сжигании 1 моль С2Н2 выделяется 1255,6 кДж. Однако, по условию задачи сжигается 10 л ацетилена, что составляет 10 / 22,4 = 0,446 моль С2Н2, где 22,4 л/моль – мольный объем любого газа при нормальных условиях. Таким образом, при сгорании 0,446 моль (10 л) С2Н2 выделится 0,446(–1255,6) = –560 кДж теплоты. Пример 4.2. Реакция идет по уравнению Fe2O3 + 2Al = 2Fe + Al2O3. При восстановлении 48 г Fe2O3 выделяется 256,1 кДж теплоты. Вычислите тепловой эффект реакции и стандартную энтальпию образования Fe2O3. Решение.Число молей Fe2O3, содержащихся в 48 г Fe2O3, составляет 48 / 160 = 0,3 моль, где 160 г/моль – молярная масса Fe2O3. Так как тепловой эффект относят к 1 моль вещества, то тепловой эффект данной реакции равен –256,1 / 0,3 = –853,7 кДж. Запишем термохимическое уравнение этой реакции Fe2O3 + 2Al = 2Fe + Al2O3, 0х.р.= –853,8 кДж Формула для расчета теплового эффекта данной реакции имеет вид: 0х.р.= (2f 0Fe + f 0Al2O3) – (f 0Fe2O3 + 2f 0Al)), отсюда находим f 0Fe2O3 f 0 Fe2O3. = 2f 0Fe + f 0Al2O3 – 2f 0Al – 0х.р. | ||||||||||
