Химия методичка. Методические указания к написанию и оформлению контрольной работы по химии
 Скачать 0.91 Mb. Скачать 0.91 Mb.
|
|
Пример 5.6. Реакция протекает по уравнению 2SO2 + O2 Решение. В начальный момент времени скорости прямой и обратной реакции были следующие: Vпр = При уменьшении объема в 3 раза концентрации всех веществ увеличатся в 3 раза. После увеличения концентрации скорость прямой реакции стала vпр = 1(3 Пример 5.7. В какую сторону сместится химическое равновесие реакции А + В Решение. При повышении температуры на 30° скорость прямой реакции возрастет в 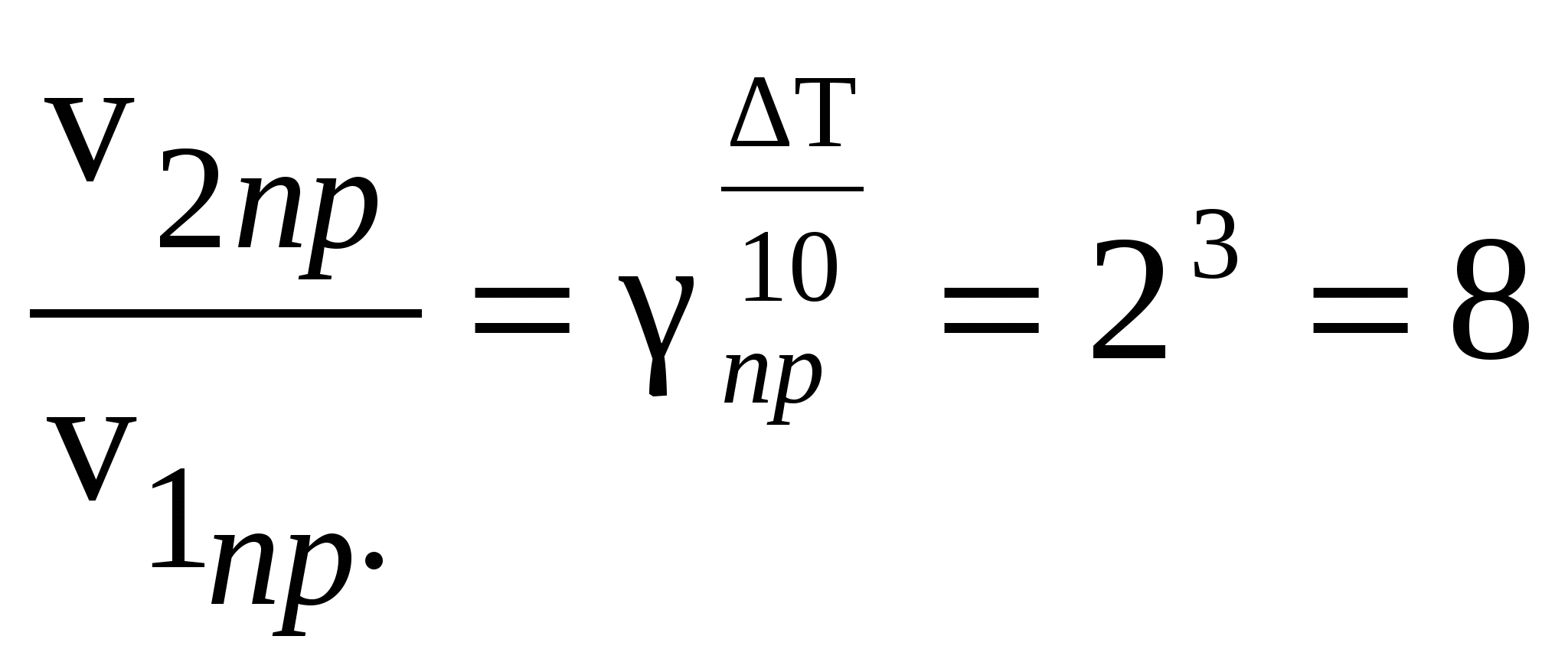 раз, а скорость обратной в раз, а скорость обратной в Пример 5.8. Как изменятся скорости прямой и обратной реакции, если в системе 2NO(г)+О2(г) Решение. До уменьшения давления выражения для скорости прямой и обратной реакции имели вид: vпр = 1 При уменьшении давления в 2 раза концентрации всех реагирующих веществ уменьшаются в 2 раза, так как общий объем системы увеличивается в 2 раза. Тогда В результате уменьшения давления скорость прямой реакции уменьшилась в 8 раз, а скорость обратной в 4 раза. Таким образом, скорость обратной реакции будет в 2 раза больше, чем прямой и смещение равновесия произойдет в сторону обратной реакции, т. е. в сторону разложения NO2. Контрольные вопросы 81. Как изменится скорость прямой и обратной реакции в системе СО(г) + 3Н2(г) если концентрации исходных веществ и продуктов реакции уменьшить в 2 раза? В каком направлении сместится равновесие? (Ответ: 16; 4). 82. При нагревании диоксида азота в закрытом сосуде до некоторой температуры равновесие реакции 2NO2 83. Реакция протекает по уравнению АВ 84. Константа равновесия реакции N2O4 85. Рассчитайте равновесную концентрацию О3 и константу равновесия в реакции 3О2(г) 86. Используя справочные данные табл. 1 приложения, рассчитайте ΔН0 реакции, протекающей по уравнению 2NO2(г) 87. Разложение пентахлорида фосфора происходит по реакции PCl5 88. Рассчитайте равновесные концентрации газообразных веществ в гетерогенной системе FeO(к) + CO(г) 89. При состоянии равновесия системы N2 + 3H2 90. В закрытом сосуде установилось равновесие СО + Н2О (Ответ: 0,5 моль/л; 0,5 моль/л; 0,3 моль/л; 0,36). 91. Реакция разложения вещества АВ выражается уравнением 2АВ = А2 + В2. Константа скорости данной реакции равна 2·10–4. Начальная концентрация САВ = 0,32 моль/л. Определите скорость в начальный момент и в тот момент, когда разложится 50% АВ. (Ответ: 2,05·10–5; 5,12·10–6). 92. Реакция между веществами А и В выражается уравнением А+2В=D. Начальные концентрации: СА = 0,3 моль/л и СВ = 0,4 моль/л. Константа скорости равна 0,8. Вычислите, какова стала скорость реакции в тот момент, когда концентрация вещества А уменьшилась на 0,1 моль. (Ответ: 6,4·10–3). 93. В начальный момент протекания реакции NiO(к) + Н2(г) концентрации были равны (моль/л): СН2 = 0,5; СН2О = 1,7. Рассчитайте равновесные концентрации газообразных веществ, если КС = 5,66. (Ответ: 0,33 моль/л; 1,87 моль/л.). 94. В реакторе при некоторой температуре протекает реакция СО2 + Н2 95. Определите, в какую сторону произойдет смещение равновесия реакции CO2(г) + 4Н2(г) 96. Чему равен температурный коэффициент скорости реакции, если при понижении температуры на 30°, время протекания реакции увеличилось в 64 раза? (Ответ: 4). 97. Горение углерода и оксида углерода (II) выражаются уравнениями: а) C(к) + О2(г) = СО2(г); б) 2СО(г) + О2(г) = 2СО2(г). Как изменится скорость этих реакций, если объемы каждой из систем уменьшить в 3 раза? (Ответ: 3; 27). 98. При 100°С некоторая реакция заканчивается за 10 мин. Принимая температурный коэффициент скорости реакции равным 3, рассчитайте, через какое время закончится эта реакция, если проводить ее при 60°С; при 150°С. (Ответ: 810 мин; 2,47 с). 99. В какую сторону сместится равновесие реакции 2АВ 100. Рассчитайте КР и КС реакции PCl5(г) 6. Ионно-молекулярные реакции обмена Ионные уравнения реакций обмена отражают состояние злектролита в растворе. Электролиты – это вещества, растворы и расплавы которых проводят электрический ток. Распад молекул вещества на ионы называется электролитической диссоциацией. К электролитам относятся кислоты, основания, соли. Кислоты – это электролиты, диссоциирующие в растворах с образованием катионов водорода HCN H+ + RO– В насыщенном водном растворе амфотерного гидроксида ионы H+, RO– и R+, OH– находятся в состоянии равновесия, поэтому амфотерные гидроксиды взаимодействуют и с кислотами и с основаниями. При добавлении кислоты равновесие смещается в сторону диссоциации по типу основания, при добавлении основания – в сторону диссоциации по типу кислоты. Соли – электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода, и отрицательные ионы, отличные от гидроксид-ионов, например: Al2(SO4)3 = 2Al3+ + 3SO42–; CuOHCl По способности к диссоциации электролиты делят на сильные и слабые. У сильных электролитов в растворе диссоциируют на ионы практически все молекулы, у слабых – лишь часть молекул. К сильным электролитам относятся почти все соли, основания щелочных и щелочноземельных металлов, а из важнейших кислот HClO4, H2SO4, HNO3, HCl, HBr, HI, HMnO4. К слабым электролитам относятся почти все органические кислоты, например, CH3COOH, неорганические соединения H2CO3, H2SO3, H2SiO3, HCN, HNO2, H3PO4, HF, NH4OH, H2O и другие. Реакции в растворах электролитов протекают между ионами и идут практически необратимо, если в результате реакции образуются осадки, газы и слабые электролиты. Обычно такие реакции изображаются при помощи ионно-молекулярных уравнений, в которых осадки, газы, слабые электролиты пишутся в виде молекул, хорошо растворимые сильные электролиты – в виде ионов. Одинаковые ионы из обеих частей уравнения исключаются. Рассмотрим типичные варианты реакций в растворах электролитов. а) 3AgNO3 + FeCl3 = Fe(NO3)3 + 3AgCl↓ – молекулярное уравнение осадок 3Ag+ + 3NO3– + Fe3++ 3Cl– = Fe3++ 3NO3– + 3AgCl↓ – полное ионное уравнение Ag+ + Cl– = AgCl↓ – сокращенное ионное уравнение б) Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑ газ 2Na+ + CO32– + 2H+ + SO42– = 2Na+ + SO42– + H2O + CO2↑ 2H+ + CO32– = H2O + CO2↑ в) HСl+ NaOH = NaCl + H2O слабый электролит H+ + Cl– + Na++OH– = Na++ Cl– + H2O H++ OH– = H2O Ионообменные реакции могут проходить между молекулами воды и ионами растворенной соли, что приводит к процессу гидролиза. Гидролиз – это обменное взаимодействие ионов соли с водой, которое приводит к образованию слабого электролита и сопровождается изменением pH-среды. Суть гидролиза заключается в следующем. При внесении в воду солей, в состав которых входят анионы слабых кислот или катионы слабых оснований, эти ионы связываются с ионами H+ или OH– из воды с образованием слабого электролита, в результате чего нарушается равновесие электролитической диссоциации воды H2O а) при гидролизе аниона (A–) слабой кислоты: А–+ HOH б) при гидролизе катиона (B+) слабого основания: B++ HOH в) при гидролизе катиона слабого основания и аниона слабой кислоты: А–+ HOH B++ HOH Гидролиз солей, образованных многоосновными кислотами или многокислотными основаниями, протекает ступенчато, причем преимущественно по первой ступени с образованием кислых или основных солей. Введение дополнительного количества ионов H+ или OH– в равновесную систему может усилить или подавить процесс гидролиза в соответствии с принципом Ле Шателье. Примеры решения задач Пример 6.1. Составьте молекулярные уравнения реакций, которым соответствуют следующие ионно-молекулярные уравнения: а) Fe(OH)3 + 3H+ = Fe3+ + 3H2O б) H3PO4 + 3OH– = PO43– + 3H2O в) HCO3– + OH– = CO32– + H2O Решение. При решении подобных заданий следует пользоваться табл. 2 приложения. В левой и правой частях данных ионно-молекулярных уравнений указаны ионы, которые образуются при диссоциации сильных электролитов. Следовательно, при составлении молекулярных уравнений следует исходить из соответствующих растворимых сильных электролитов. Например: а) Fe(OH)3 + 3HCl = FeCl3 + 3H2O б) H3PO4 + 3NaOH = Na3PO4 + 3H2O в) KHCO3 + KOH = K2CO3 + H2O Пример 6.2. Составьте молекулярные и ионно-молекулярные уравнения реакций, подтверждающие амфотерный характер гидроксида свинца. Решение. Амфотерные электролиты могут диссоциировать по типу кислоты и основания, поэтому Pb(OH)2 может растворяться как в кислоте, так и в щелочи, образуя соответствующие соли: а) растворение Pb(OH)2 в кислоте Pb(OH)2 + 2HNO3 = Pb(NO3)2 + 2H2O Pb(OH)2 + 2H+ = Pb2+ +2H2O б) растворение Pb(OH)2 в щелочи Pb(OH)2 + 2NaOH = Na2PbO2 + 2H2O Pb(OH)2 + 2OH– = PbO22–+ 2H2O В случае (а) Pb(OH)2 выполняет роль основания, поставляя в раствор гидроксид-ионы для образования молекул воды. В случае (б) Pb(OH)2 выполняет роль кислоты (Pb(OH)2 = H2PbO2), поставляя в раствор катионы водорода. Схема диссоциации Pb(OH)2 выглядит так: 2H+ + PbO22– Пример 6.3. Составьте молекулярные и ионно-молекулярные уравнения гидролиза солей: CH3COOK, K2S, CuSO4. Решение. а) Ацетат калия – соль слабой кислоты и сильного основания. При растворении в воде ацетат калия диссоциирует на ионы К+ и анионы CH3COO–. Катионы К+ не могут связывать анионы OH–, так как KOH – сильный электролит. Ионы CH3COO–, связываясь с катионами H+ воды, образуют слабую кислоту CH3COOH. Гидролиз идет по аниону слабой кислоты. Сокращенное ионно-молекулярное уравнение имеет вид: CH3COO– + H2O Для написания уравнения реакции в полной ионной форме прибавим к левой и правой частям уравнения ионы, не претерпевающие в результате гидролиза ни- каких изменений. В рассматриваемом примере – это катионы калия. К++CH3COO– + H2O молекулярное уравнение: CH3COOK + H2O В растворе появляется избыток ионов OH–, поэтому раствор имеет щелочную реакцию (pH > 7). б) Сульфид калия – соль двухосновной слабой кислоты и сильного основания. Анионы слабой кислоты S2– связывают ионы водорода из воды, образуя анионы кислой соли HS–. Соль гидролизуется по аниону. Сокращенное ионно-молекулярное уравнение: S2– + H2O полное ионно-молекулярное уравнение: 2К+ + S2– + H2O молекулярное уравнение: K2S + H2O Появление избыточного количества ионов OH– обусловливает щелочную реакцию среды (pH > 7). в) Сульфат меди – соль слабого двухкислотного основания и сильной кислоты. Гидролиз такой соли идет по катиону слабого основания с образованием катионов основной соли CuOH+. Сокращенное ионно-молекулярное уравнение гидролиза: Cu2+ + H2O полное ионно-молекулярное уравнение: 2Cu2+ + 2SO42– + 2H2O молекулярное уравнение: 2CuSO4 + 2H2O В растворе накопились катионы водорода, которые создадут кислую реакцию среды (pH < 7 ). Пример 6.4. Какие продукты получатся при смешивании растворов AlCl3 и Na2S? Составьте ионно-молекулярные и молекулярное уравнение реакции. Решение. Соль AlCl3 гидролизуется по катиону, Na2S – по аниону: Al3+ + H2O S2– + H2O Образующиеся ионы H+ и OH– связываются в молекулы слабого электролита H2O, сдвигая гидролитическое равновесие вправо. Гидролиз идет до конца с образованием Al(OH)3 и H2S. Ионно-молекулярные и молекулярное уравнение имеют вид: 2Al3+ + 3S2–- + 6H2O = 2Al(OH)3 + 3H2S 2Al3+ + 6Cl– + 6Na+ +3S2- + 6H2O = 2Al(OH)3 + 3H2S + 6Na+ + 6Cl– 2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3 + 3H2S+ 6NaCl Контрольные вопросы 101. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) K2S и CuSO4; б) AgNO3 и NH4Cl; в) Na2SiO3 и H2SO4; г) CaCO3 и HNO3. 102. Какие из перечисленных ниже солей подвергаются гидролизу: NaCN, KNO3, CuCl2, NH4CH3COO? Для каждой из гидролизующихся солей напишите уравнение гидролиза в ионно-молекулярном и молекулярном виде, укажите реакцию среды ее водного раствора. 103. Составьте по два молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Fe3+ + 3OH– = Fe(OH)3 б) H+ + NO2– = HNO2 в) Cu2+ + S2– = CuS 104. Составьте ионно-молекулярное и молекулярное уравнение гидролиза Cr2(SO4)3. К раствору добавили следующие вещества: а) H2SO4; б) KOH. В каком случае гидролиз сульфата хрома усилится? Почему? 105. Какие из солей: K2SO4, Na2SO3, NH4CN, LiCl, Fe2(SO4)3 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. Какое значение pH (>7<) имеют растворы этих солей? 106. Смешивают попарно растворы: а) KOH и Ba(NO3)2; б) Li2CO3 и HCl; в) Pb(NO3)2 и KCl; г) NH4Cl и KOH. В каких случаях реакции практически пойдут до конца? Представьте их в молекулярном и ионно-молекулярном виде. 107. Подберите по два уравнения в молекулярном виде к каждому из ионно-молекулярных уравнений: а) Al3+ + H2O б) S2– + H2O в) CN–+ H2O 108. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) BaCO3 и HNO3; б) Fe2(SO4)3 и KOH; в) HCl и K2S; г) CH3COOK и HCl. 109. Составьте ионно-молекулярные и молекулярные уравнения гидролиза, происходящего при сливании растворов: а) FeCl3 и Na2CO3; б) CuSO4 и K2CO3. 110. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CH3COONa и H2SO4; б) NH4Cl и NaOH; в) Ba(OH)2 и K2CrO4; г) CaCl2 и Na3PO4. 111. Подберите по два уравнения в молекулярном виде к каждому из ионно-молекулярных уравнений: а) Fe3+ + 2H2O б) CO32– + H2O в) NH4+ + H2O 112. Смешивают попарно растворы: а) K2SO3 и HCl; б) Na2SO4 и KCl; в) CH3COONa и HNO3; г) Al2(SO4)3 и избыток KOH. В каких из приведенных случаев реакции практически пойдут до конца? Составьте для этих реакций молекулярные и ионно-молекулярные уравнения. 113. Какие из веществ будут взаимодействовать с гидроксидом калия: Ba(OH)2, Zn(OH)2, FeCl3, H3PO4? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями. 114. Какие из приведенных солей: KCN, Cr(NO3)3, KNO3, ZnSO4 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей, укажите реакцию среды. 115. Составьте по два молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) OH– + HS– = H2O + S2– б) CO32– + 2H+ = H2O + CO2 в) OH– + NH4+ = NH4OH 116. В какой цвет будет окрашен лакмус в водных растворах K2SO3, (NH4)2SO4, Na2CO3, Li2SO4? Ответ обоснуйте ионно-молекулярными уравне- ниями соответствующих реакций гидролиза солей. 117. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) K2SO3 и HCl; б) CH3COOH и KOH; в) Na2HPO4 и NaOH; г) Al(OH)3 и KOH. 118. Какие из солей KI, Cu(NO3)2, KNO2, CrCl3 подвергаются гидролизу? Cоставьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей, укажите реакцию среды. 119. Смешивают попарно растворы: а) Cu(NO3)2 и Na2SO4; б) BaCl2 и K2SO4; в) NaHCO3 и NaOH; г) Cu(OH)2 и HCl. В каких из приведенных случаев реакции практически пойдут до конца? Составьте для этих реакций молекулярные и ионно-молекулярные уравнения. 120. Какие из приведенных солей: Na2SO3, AlCl3, NH4NO2 подвергаются гидролизу по катиону, по аниону, по катиону и аниону? Укажите pH среды, составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. 7. Окислительно-восстановительные реакции Реакции, в результате которых изменяется степень окисления элементов, называются окислительно-восстановительными. Под степенью окисления (с.о.) понимают заряд элемента в соединении, вычисленный, исходя из предположения, что соединение состоит из ионов. Определение степени окисления проводят, используя следующие положения: 1. Степень окисления элемента в простом веществе, например, в Zn, Сa, H2, Вг2, S, O2 равна нулю. 2. Cтепень окисления кислорода в соединениях обычно равна –2. Исключения составляют пероксиды H2+1O2–1, Na2+1O2–1 и фторид кислорода О+2F2. 3. Степень окисления водорода в большинстве соединений равна +1, за исключением солеобразных гидридов, например, Na+1H-1.
В качестве примера рассчитаем с.о. марганца в соединении К2MnO4 и хрома в анионе Cr2O72- К2+1 Mnх O4 –2 2(+1)+ x + 4 (–2) = 0 x = + 6 (Cr2х O7–2 )2– 2x + 7 (–2) = –2 x = + 6 Любую окислительно-восстановительную реакцию можно разделить на две полуреакции: окисление и восстановление, например Ca0 + Cl20 = Ca+2 Cl2–1 восстановитель Ca0 –2ē → Ca+2 окисление окислитель Cl2 0 +2ē → 2Cl– восстановление Окисление – процесс отдачи электронов, сопровождающийся повышением степени окисления элемента. Восстановление – процесс присоединения электронов, сопровождающийся понижением степени окисления элемента. Окисление и восстановление – взаимосвязанные процессы, протекающие одновременно. Окислителями называют вещества (атомы, молекулы или ионы), которые в процессе реакции присоединяют электроны, восстановителями – вещества, отдающие электроны. Различают три типа окислительно-восстановительных реакций: межмолекулярный, внутримолекулярный и диспропорционирования. В межмолекулярных реакциях окислитель и восстановитель содержатся в разных молекулах. В случае внутримолекулярных реакций окислитель и восстановитель находятся внутри одной молекулы. В реакциях диспропорционирования один и тот же элемент является окислителем и восстановителем, т.е. сам себя окисляет и восстанавливает, находясь при этом в составе одной молекулы. Примеры решения задач Пример 7.1. Исходя из степени окисления азота в соединениях NH3, KNO2, KNO3, определите, какое из них может быть только восстановителем, только окислителем и какое из них может проявлять и окислительные и восстановительные свойства? Решение. Возможные степени окисления азота: –3, –2, –1, 0, +1, +2, +3, +4, +5. В указанных соединениях с.о. азота равны: –3 (низшая), +3 (промежуточная), +5 (высшая). Следовательно, NH3 – только восстановитель, KNO2 – и окислитель и восстановитель, KNO3 – только окислитель. Пример 7.2. Могут ли происходить окислительно-восстановительные реакции между веществами: а) HBr и H2S; б) MnO2 и HCl; в) MnO2 и NaBiO3? Решение. а) Степень окисления в HBr с.о. (Br) = –1 (низшая); в H2S с.о. (S) = –2 (низшая). Так как бром и сера находятся в низшей степени окисления, то они могут проявлять только восстановительные свойства и реакция между ними невозможна; б) в MnO2 с.о. (Mn) = +4 (промежуточная); в HCl с.о. (Cl) = –1 (низшая). Следовательно, взаимодействие этих веществ возможно, причем MnO2 является окислителем; в) в MnO2 с.о. (Mn) = +4 (промежуточная); в NaBiO3 с.о. (Bi) = +5 (высшая). Взятые вещества могут взаимодействовать. MnO2 в этом случае будет восстановителем. Пример 7.3. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме: KMnO4+ KNO2+H2SO4 MnSO4+ KNO3 +K2SO4+H2O Определите окислитель и восстановитель. На основании электронных уравнений расставьте коэффициенты. Решение. Определяем степени окисления тех элементов, которые ее изменяют: KMn+7O4+ KN+3O2+H2SO4 Mn+2SO4+ KN+5O3 +K2SO4+H2O Составляем электронные уравнения процессов окисления и восстановления, определяем окислитель и восстановитель: восстановитель N+3 – 2ē → N+5 5 окисление 10 окислитель Mn+7 + 5ē → Mn+2 2 восстановление Уравниваем реакцию методом электронного баланса, суть которого заключается в том, что общее число электронов, отданных восстановителем, равно числу электронов, принятых окислителем. Находим общее наименьшее кратное для отданных и принятых электронов. В приведенной реакции оно равно 10. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Коэффициенты перед веществами, атомы которых не меняют свои степени окисления, находим подбором. Уравнение реакции будет иметь вид: 2KMnO4 + 5KNO2 + 3H2SO4 = 2MnSO4 + 5KNO3 + K2SO4 + 3H2O Пример 7.4. Составьте уравнения окислительно-восстановительных реакций, идущих по схемам: а) Mg + HNO3 (разб.) Mg(NO3)2 + NH4NO3 + H2O б) KClO3 KCl + O2 в) К2MnO4 + H2О КMnO4 + MnO2 + КOН В каждой реакции определите окислитель и восстановитель, расставьте коэффициенты, укажите тип каждой реакции. Решение. Составляем уравнения реакций: а) 4Mgo + 10HN+5O3 = 4Mg+2 (NO3)2 +N -3H4NO3 +3H2O восстановитель Mg0 – 2ē → Mg+2 4 окисление 8 окислитель N+5 + 8ē → N–3 1 восстановление б) 2KCl+5O3–2 = 2KCl–1 + 3O2o восстановитель 2O–2 – 4ē → O20 3 окисление 12 окислитель Cl+5 + 6ē → Cl–1 2 восстановление в) 3K2Mn+6O4 + 2H2O = 2KMn+7O4 + Mn+4O2 + 4КОН восстановитель Mn+6 –1ē →Mn+7 2 окисление 2 окислитель Mn+6 + 2ē → Mn+4 1 восстановление Как видно из представленных уравнений в реакции (а) окислитель и восстановитель – разные элементы в молекулах двух разных веществ, значит, данная реакция относится к типу межмолекулярных окислительно-восстановительных реакций. В реакции (б) окислитель – хлор и восстановитель – кислород содержатся в одной молекуле – реакция внутримолекулярная. В реакции (в) роль окислителя и восстановителя выполняет марганец, следовательно, это реакция диспропорционирования. Контрольные вопросы 121. Исходя из степени окисления серы в веществах: S, H2S, Na2SO3, H2SO4, определите, какое из них является только окислителем, только восстановителем и какие могут быть и окислителем и восстановителем. Почему? На основании электронных уравнений подберите коэффициенты в уравнении реакции, идущей по схеме: KI + KIO3+ H2SO4 I2+ K2SO4 + H2O Определите тип окислительно-восстановительной реакции. 122. Реакции выражаются схемами: Zn + HNO3 (разб) Zn(NO3)2 + N2O + H2O SnCl2 + K2Cr2O7 + H2SO4 Sn (SO4) 2 + CrCl3 + K2SO4 + H2O Составьте электронные уравнения, подберите коэффициенты, укажите, какое вещество в каждой реакции является окислителем, какое восcтановителем. 123. Составьте электронные уравнения и укажите, какой процесс – окисление или восстановление происходит при следующих превращениях: P–3 P+5; N+3 N–3; Cl– ClO3–; SO42– S–2 Реакция выражается схемой: KMnO4 + H2S + H2SO4 MnSO4 + S +K2SO4 + H2O Определите окислитель и восстановитель, на сновании электронных уравнений расставьте коэффициенты в уравнении реакции. 124. Могут ли протекать окислительно-восстановительные реакции между веществами: а) Cl2 и H2S; б) KBr и KBrO; в) HI и NH3? Почему? На основании электронных уравнений подберите коэффициенты, определите тип окислительно-восстановительной реакции, идущей по схеме: NaCrO2 + PbO2 + NaOH Na2CrO4 + Na2PbO2 + H2O 125. Исходя из степени окисления железа, определите, какое из веществ может быть только восстановителем, только окислителем и какое – и окислителем и восстановителем: FeSO4, Fe2O3, K2FeO4. Почему? На основании электронных уравнений подберите коэффициенты для веществ в уравнении реакции, идущей по схеме: CrCl3 + Br2 + NaOH Na2CrO4 + NaBr + NaCl + H2O 126. Составьте электронные уравнения и укажите, какой процесс – окисле- ние или восстановление происходит при следующих превращениях: As+3 As+5; CrO42– CrO2– ; MnO4– MnO42–; Si+4 Si0 На основании электронных уравнений расставьте коэффициенты в реакции, идущей по схеме: H2S + H2SO3 S + H2O 127. Реакции выражаются схемами: KNO2 + KI + H2 SO4 KNO3 + I2+ K2SO4 + H2 O NaNO3 NaNO 2 + O2 Составьте электронные уравнения, расставьте коэффициенты, определите окислитель и восстановитель в каждой реакции. К какому типу относится каждая из приведенных реакций? 128. См. условие задания 127. KBr + KBrO3+ H2SO4 Br2 + K2 SO4 + H2O NH4NO3 N2O + H2O 129. См. условие задания 127. H2S + K2Cr2O7 + H2SO4 S + Cr2(SO4)3 + K2SO4 + H2 O NaBrO NaBrO3 + NaBr 130. Исходя из степени окисления хлора, определите, какое из соедине- ний: Cl2, HCl, HClO4 – только окислитель, только восстановитель и какое из них может иметь функцию и окислителя и восстановителя. Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме: HNO3+ Bi NO + Bi(NO3)3 + H2O 131. См. условие задания 127. H3AsO3 + KMnO4 + H2SO4 H3AsO4 + MnSO4 + K2SO4 + H2O AgNO3 Ag + NO2 + O2 132. Mогут ли происходить окислительно-восстановительные реакции между веществами: а) H2S и Br2 ; б) HI и HIO3; в) KMnO4 и K2Cr2O7? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме: H2O2 + KMnO4 + H2SO4 O2 + MnSO4 + K2SO4 + H2O 133. Составьте электронные уравнения и укажите, какой процесс – окисле-ние или восстановление происходит при следующих превращениях: BrO4– Br2; Bi BiO3–; VO3–V; Si –4 Si +4. На основании электронных уравнений подберите коэффициенты в уравнении реакции, идущей по схеме: Al + KMnO4 + H2SO4 Al2(SO4)3 + MnSO4 + K2SO4 + H2O 134. См. условие задания 127. Na2SO3 + Na2S + H2SO4 S + Na2SO4 + H2O KMnO4 K2MnO4 + MnO2 + O2 135. Могут ли идти окислительно-восстановительные реакции между следующими веществами а) PbO2 и KBiO3; б) Н2S и Н2SO3; в) H2SO3 и HClO4? Почему? На основании электронных уравнений расставьте коэффициенты в уравнении реакции, идущей по схеме: S + KOH K2SO3 + K2S + H2O Определите тип окислительно-восстановительной реакции. 136. См. условие задания 127. (NH4)2Cr2O7 N2 + Cr2O3 + H2O P + HNO3 + H2O H3PO4 + NO 137. См. условие задания 127. Ba(OH)2 + I2 Ba(IO3)2 + BaI2 + H2 O MnSO4 + PbO2 + HNO3 HMnO4 + Pb(NO3)2 + PbSO4 + H2O 138. См. условие задания 127. MnSO4 + KClO3 + KOH K2MnO4 + KCl + K2SO4 + H2O Ni(NO3)2 NiO + NO2 + O2 139. На основании электронных уравнений расставьте коэффициенты в уравнениях реакций, идущих по схемам: HNO2 HNO3 + NO + H2O Cr2O3 + KClO3 + KOH K2CrO4 + KCl + H2O Укажите окислитель и восстановитель в каждой реакции, определите ее тип. 140. См. условие задания 139. Si + O2 + NaOH Na2SiO3 + H2O NH4NO2 N2 + H2O 8. Электродные потенциалы. Гальванические элементы При погружении металла в воду или раствор его соли атомы металла, находящиеся на поверхности, превращаются в ионы и, гидратируясь, переходят в раствор. При этом электроны, остающиеся на металле в избытке, заряжают его поверхностный слой отрицательно. В то же время гидратированные ионы металла, находящиеся в растворе, отбирая у металлической пластинки электроны, образуют атомы металла, которые становятся частью кристаллической решетки. Этот процесс приводит к дефициту электронов и возникновению на пластинке положительного заряда. Таким образом, между металлическим электродом и раствором устанавливается равновесие М В зависимости от того, какой из двух рассматриваемых процессов преобладает в приведенном равновесии, находится знак и величина заряда поверхности металла. Электрическое поле, возникающее вокруг электрода, вызывает неравномерное распределение ионов в растворе вблизи электрода. Если металлическая пластинка заряжена отрицательно, то к ней притягиваются катионы из раствора и раствор вблизи поверхности заряжается положительно. Если поверхность металла заряжена положительно, наблюдается обратная картина. Таким образом, на границе металл – раствор образуется двойной электрический слой и возникает определенный скачок потенциала. Разность потенциалов, которая возникает на границе металл – раствор, называется электродным потенциалом. Абсолютное значение электродного потенциала измерить невозможно. Поэтому электродные потенциалы определяют относительно стандартного водородного электрода, потенциал которого условно принят за ноль. Разность потенциалов между металлом, погруженным в раствор своей соли с концентрацией ионов металла 1 моль/л, и стандартнымводородным электродомназывается стандартным электродным потенциалом металла. Обозначается 0, измеряется в вольтах (В). Значения некоторых стандартных электродных потенциалов приведены в табл. 8.1. Расположенные в порядке увеличения стандартного электродного потенциала металлы образуют ряд напряжений металлов. Положение металла в ряду напряжений определяет относительную окислительно-восстановительную способность металла и его ионов. Чем меньшее значение имеет стандартный электродный потенциал металла, тем более сильным восстановителем он является. Чем больше потенциал металлического электрода, тем более высокой окислительной способностью обладают его ионы. Каждый металл способен вытеснять из растворов солей только те металлы, которые имеют большее значение электродного потенциала – более активный металл замещает менее активный. Таблица 8.1. Стандартные электродные потенциалы (o) при 25oС и электродные реакции для некоторых металлов
|
