Химия методичка. Методические указания к написанию и оформлению контрольной работы по химии
 Скачать 0.91 Mb. Скачать 0.91 Mb.
|
|
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К НАПИСАНИЮ И ОФОРМЛЕНИЮ КОНТРОЛЬНОЙ РАБОТЫ ПО ХИМИИ При решении задач нужно приводить весь ход решения и математические преобразования. Решение задач в контрольной работе должны быть четко обоснованы, за исключением тех случаев, когда по существу вопроса такая мотивировка не требуется, например, когда нужно составить электронную формулу атома, написать уравнение реакции и т.п. Контрольная работа должна быть оформлена в соответствие с требованиями:
ОБРАЗЕЦ ТИТУЛЬНЫЙ ЛИСТ Министерство образования и науки Российской Федерации САХАЛИНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Факультет природных ресурсов и нефтегазового дела Кафедра Нефтегазового дела КОНТРОЛЬНАЯ РАБОТА по ХИМИИ направление подготовки 131000.62 «Нефтегазовое дело» вариант № _______ Выполнил: Студент ____ курса Зоачной формы обучения № зачетной книжки _____________ Проверил: доцент Я.В. Денисова Оценка:_________________ Южно-Сахалинск 2012 ХИМИЯМетодические указания, программа, решение типовых задач и контрольные задания для студентов заочного обучения технических направлений и специальностей 2012 ОглавлениеОбщие методические указания………………………………………..……………...4 Программа……………………………………………………………..…………..…..5 Литература……………………………………………………….…….………………8 Контрольные задания………………………………………….……………………...9 Таблица вариантов контрольных заданий……………………….…………………83 Приложение…………………………………………………………………………..86 Общие методические указания Изучение химии как общеобразовательной дисциплины направлено на расширение кругозора и формирование научного мировоззрения студентов. Кроме того, знание химии необходимо им для последующего усвоения ряда общетехнических и специальных дисциплин, а также для понимания возможностей, предоставляемых химией при решении конкретных технических задач. В процессе изучения химии студенты получают современное научное представление о веществе как одном из видов материи, о механизмах и способах превращения одних веществ в другие. При этом они должны прочно усвоить основные химические понятия, законы и теории, овладеть методологией химических расчетов, выработать навыки самостоятельного выполнения химических экспериментов и обобщения наблюдаемых явлений. Основной вид учебных занятий студентов заочного обучения – самостоятельная работа над учебным материалом. В курсе химии она слагается из следующих элементов: посещение лекций; изучение дисциплины по учебникам и учебным пособиям; индивидуальные консультации; выполнение контрольной работы; выполнение лабораторных работ и представление отчетов по ним; сдача экзамена по всему курсу. Настоящее методическое пособие составлено в соответствии с действующей программой и призвано помочь студентам заочного обучения при самостоятельном изучении курса. Приступая к работе над пособием, студенту рекомендуется внимательно ознакомиться с содержанием программы по каждой теме, после чего приступить к изучению материала по предлагаемым в списке литературы учебникам и учебным пособиям. Каждый студент должен выполнить контрольную работу. В данном пособии приведено 100 вариантов контрольных заданий. Каждый студент выполняет контрольную работу своего варианта. Номер варианта определяется по двум последним цифрам номера студенческого билета. Например, номер студенческого билета 05040143, две последние цифры 43, им соответствует вариант контрольного задания 43. Таблица вариантов контрольных заданий приведена в конце пособия. К выполнению контрольной работы можно приступить только тогда, когда будет усвоена определенная часть курса и тщательно проработаны методические указания к решению типовых задач по соответствующей теме, приведенные в данном пособии. При оформлении контрольной работы необходимо придерживаться следующих правил: – Контрольная работа должна быть выполнена в ученической тетради, на обложке которой необходимо указать ФИО и шифр. – Работа должна быть написана ручкой разборчиво, без сокращений. На каждой странице следует оставлять поля для замечаний преподавателя. – К каждой задаче необходимо списать ее условие, а затем дать краткий, но исчерпывающий ответ. При решении задач нужно приводить весь ход решения и математические преобразования. В конце работы приводится список использованной литературы, ставится дата и подпись. – Контрольная работа может быть выполнена на компьютере на листах формата А4. Получив прорецензированную контрольную работу, следует исправить ошибки с учетом замечаний рецензента. Если контрольная работа не зачтена, она должна быть выполнена повторно в соответствии с указанием преподавателя и представлена на рецензирование вместе с не зачтенной работой. К сдаче экзамена допускаются студенты, которые выполнили контрольную работу, проделали лабораторные работы, предусмотренные программой, и представили отчеты по ним. ПрограммаНастоящая программа по химии составлена в соответствии с Государственными образовательными стандартами высшего профессионального образования по техническим направлениям и соответствует требованиям, предъявляемым к подготовке специалистов технических направлений и специальностей. Введение Химии как часть естествознания – наука о веществах и их превращениях. Понятие о материи, веществе и поле. Связь химии с другими науками. Значение химии в формировании мышления, в изучении природы и развитии техники.
Закон сохранения массы и энергии. Стехиометрические законы. Атомные и молекулярные массы. Количество вещества. Молярная масса и молярный объем вещества. Эквивалент. Молярная масса эквивалентов. Закон эквивалентов. 2. Строение атома Основные сведения о строении атома. Состав атомных ядер. Современное понятие о химическом элементе. Электронные оболочки атомов. Двойственная природа электрона. Уравнение де Бройля. Атомная орбиталь. Квантовые числа. Распределение электронов в многоэлектронных атомах. Принцип минимума энергии и правило Клечковского; принцип Паули; правило Хунда. Электронные конфигурации атомов и ионов. Основное и возбужденное состояние атомов. 3. Периодический закон и периодическая система Д. И. Менделеева Периодический закон и физический смысл периодичности. Структура периодической системы элементов и ее связь с электронным строением атомов. s-, p-, d-, f- элементы. Периодические свойства элементов – энергия ионизации, сродство к электрону, электроотрицательность. Их изменение в периодах и группах периодической системы. Окислительно-восстановительные свойства элементов. 4. Энергетика и направление химических процессов Тепловые эффекты химических реакций. Экзо- и эндотермические реакции. Внутренняя энергия и энтальпия. Стандартное состояние вещества. Термохимия. Термохимические законы и уравнения. Энтальпия образования химических соединений. Энтропия и ее изменение при химических процессах. Энергия Гиббса и направление самопроизвольного протекания химических реакций. 5. Химическая кинетика и равновесие Гомогенные и гетерогенные системы. Скорость химической реакции. Факторы, влияющие на скорость реакции. Зависимость скорости химической реакции от концентрации, закон действия масс. Зависимость скорости реакции от температуры, правило Вант-Гоффа. Скорость реакции в гетерогенных системах. Ускорение химических реакций. Катализ гомогенный и гетерогенный. Необратимые и обратимые реакции. Химическое равновесие. Константа равновесия и ее связь с термодинамическими функциями. Смещение химического равновесия. Принцип Ле Шателье. 6. Растворы Определение и классификация растворов. Растворы электролитов и неэлектролитов. Теория электролитической диссоциации. Диссоциация кислот, оснований, солей. Степень диссоциации. Сильные и слабые электролиты. Ионно-молекулярные уравнения. Электролитическая диссоциация воды. Водородный показатель. Гидролиз солей. 7. Окислительно-восстановительные реакции Степень окисления элементов. Важнейшие восстановители и окислители. Окислительно-восстановительная двойственность. Составление уравнений окислительно-восстановительных реакций. Типы окислительно-восстановительных реакций. 8. Электродные потенциалы. Гальванические элементы Равновесие на границе металл-раствор. Электродный потенциал. Стандартный водородный электрод. Ряд напряжений металлов. Уравнение Нернста. Химические источники электрического тока. Гальванические элементы. ЭДС гальванических элементов. Аккумуляторы. 9. Коррозия и защита металлов Определение и классификация коррозионных процессов. Химическая коррозия. Электрохимическая коррозия. Защита металлов от коррозии – легирование, защитные неметаллические и металлические покрытия, электрохимическая защита. Изменение свойств коррозионной среды. Ингибиторы коррозии. 10. Электролиз Электролиз как окислительно-восстановительный процесс. Электролиз водных растворов и расплавов солей. Катодные и анодные процессы. Законы электролиза. Выход по току. Примерный перечень лабораторных работ
Литература1. Глинка Н. Л. Общая химия. – М.: Интеграл-Пресс, 2002. -728с.
Контрольные задания 1. Эквивалент. Молярная масса эквивалентов. Закон эквивалентов Эквивалент(Э) – это реальная или условная частица вещества, которая может замещать, присоединять или выделять один ион водорода в кислотно-основных или ионообменных реакциях или один электрон в окислительно-восстановительных реакциях. Под «реальной частицей» понимают реально существующие соединения (КОН, H2SO4, Н2О), под «условной» – доли этих реальных частиц (½H2SO4, 1/5KMnO4). Эквивалент так же, как атом, молекула, ион – безразмерная величина и его состав выражают с помощью химических формул и символов. Количество вещества эквивалентов измеряется в молях. Масса 1 моль эквивалентов называется молярной массой эквивалентов (Мэк) и выражается в г/моль. Эквивалент (молярная масса эквивалентов) для одного и того же вещества может иметь различные значения в зависимости от того, в какую реакцию это вещество вступает. Эквивалент и Мэк рассчитываются неодинаково для кислотно-основных и окислительно-восстановительных реакций. Молярная масса эквивалентов вещества, участвующего в окислительно-восстановительной реакции, рассчитывается по формуле: Мэк где М – молярная масса вещества, nе– число электронов, присоединенных одной молекулой окислителя или отданных одной молекулой восстановителя. Например, в окислительно-восстановительной реакции горения сероводорода 2H2S + 3O2 = 2H2O + 2SO2 степень окисления серы изменяется от –2 (в H2S) до +4 (в SO2). Следовательно, молекула H2S теряет 6 электронов, т. е. одному электрону эквивалентна условная частица 1/6 молекулы H2S. Э(H2S) = 1/6H2S, а Мэк(H2S) = У кислорода степень окисления меняется от 0 (в О2) до –2 (в SO2) и, так как в его молекуле содержится 2 атома, то число принятых электронов будет равно 4. И, таким образом, одному электрону эквивалентна условная частица ¼ молекулы О2. Э(О2) = ¼О2, а Мэк (О2) = Молярная масса эквивалентов кислоты или основания, участвующихв кислотно-основной реакции, рассчитывается по формуле Мэк(кислоты, основания)= где М – молярная масса кислоты или основания; n – для кислот – это число атомов водорода, замещенных в данной реакции на металл; n – для оснований – число гидроксильных групп, замещенных в данной реакции на кислотный остаток. Например, в кислотно-основной реакции H2S + 2NaOH = Na2S + 2H2O (1) оба иона водорода молекулы H2S замещаются на металл и, таким образом, одному иону водорода эквивалентна условная частица ½ H2S. В этом случае Э (H2S) = ½ H2S, а Мэк (H2S) = В реакции H2S + NaOH = NaHS + H2O (2) в молекуле H2S на металл замещается только один ион водорода и, следовательно, одному иону Э(H2S) = H2S, а Мэк(H2S) = Э(NaOH) в реакциях (1) и (2) равен NaOH, так как в обоих случаях на кислотный остаток замещается одна гидроксильная группа. Мэк(NaOH) = 40 г/моль. Молярная масса эквивалентов соли в реакциях обмена рассчитывается по формуле Мэк(соли)= где М – молярная масса соли; n – число ионов металла, участвующих в реакции от каждой молекулы; |c. o.| – абсолютное значение степени окисления иона металла (о степени окисления см. стр. 55). Например, от каждой молекулы Al2(SO4)3 в реакции Al2(SO4)3 + 6NaOH = 2Al(OH)3↓ + 3Na2SO4 участвуют два иона алюминия, степень окисления которого+3. Отсюда, Мэк[Al2(SO4)3]= Молярная масса эквивалентов оксида рассчитывается по формуле Мэк(оксида)= где М – молярная масса оксида; n – число катионов соответствующего оксиду основания или число анионов соответствующей оксиду кислоты; |c.o.| – абсолютное значение степени окисления катиона или аниона. В реакции P2O5 + 3CaO = Ca3(PO4)2 эквивалент P2O5, образующего два трехзарядных аниона (РО4)3-, равен 1/6 P2O5, а Мэк(P2O5) = Чтобы определить молярную массу эквивалентов элемента в соединении, можно воспользоваться формулой Мэк (эл-та) = где МА – молярная масса элемента; |c.o.| – абсолютное значение степени окисления элемента. Например, молярные массы эквивалентов фосфора в соединениях РН3, Р2О3 и Р2О5 соответственно равны: 31 / 3 = 10,3 г/моль; 31 / 3 = 10,3 г/моль; 31 / 5 = 6,2 г/моль, а эквивалент фосфора в соединениях РН3 и Р2О3 равен 1/3 Р, в соединении Р2О5 – 1/5 Р. Нужно также иметь в виду, что молярная масса эквивалентов химического соединения равна сумме молярных масс эквивалентов составляющих его частей. Так, Мэк(РН3) = Мэк(Р) + Мэк(Н) = 10,3 + 1 = 11 г/моль; Мэк(Р2О3) = Мэк(Р) + Мэк(О) = 10,3 + 8 = 18,3 г/моль; Мэк(Р2О5) = Мэк(Р) + Мэк(О) = 6,2 + 8 = 14,2 г/моль. Закон эквивалентов: массы реагирующих друг с другом веществ прямо пропорциональны молярным массам их эквивалентов. 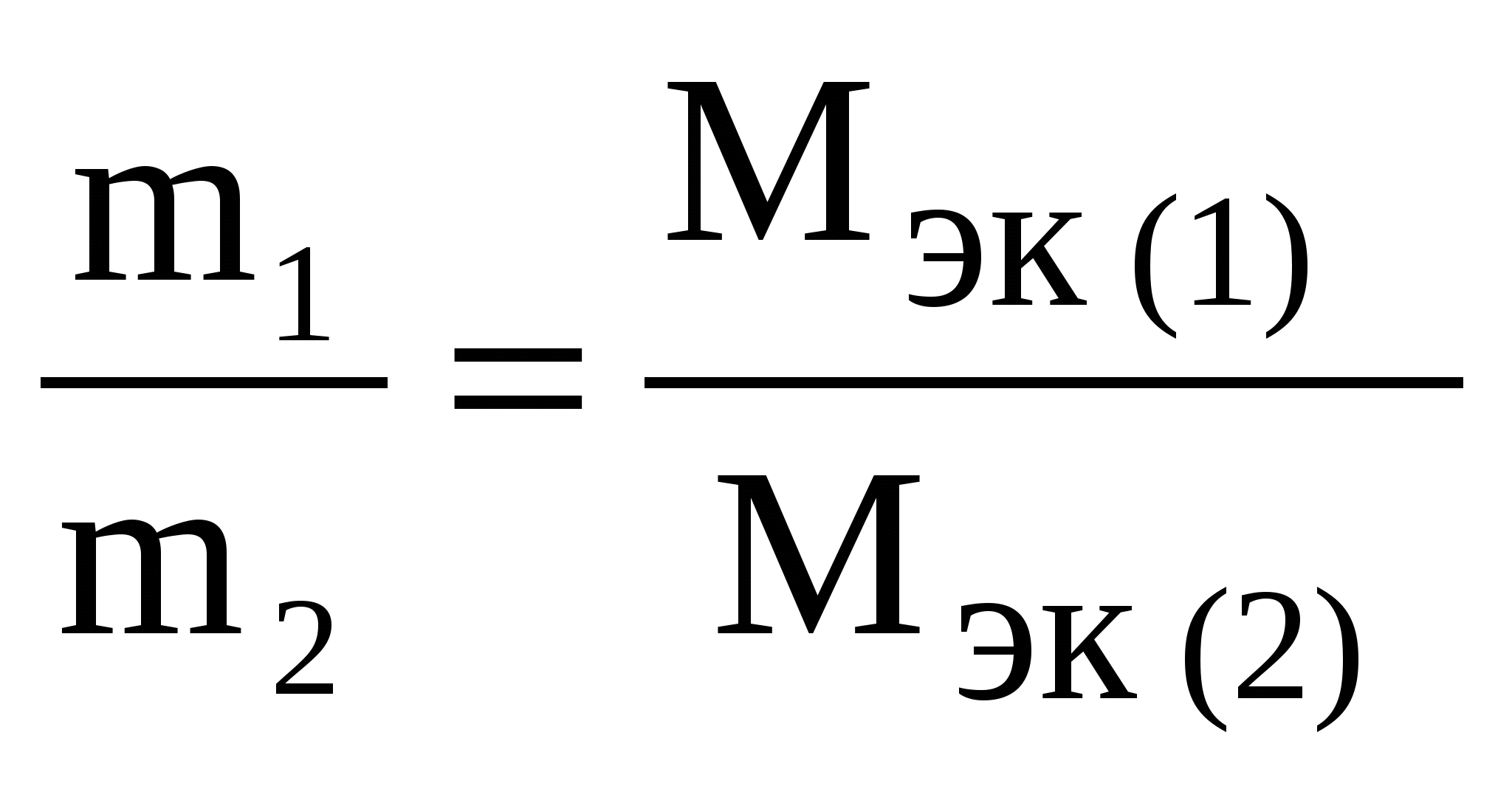 Поделив массу каждого вещества на молярную массу его эквивалентов, получим число молей эквивалентов (υ): Для реакции A + B = C + D должно выполняться соотношение υA=υB=υC=υD, т.е. число молей эквивалентов участвующих в реакции веществ равны между собой. Если одно из реагирующих веществ находится в газообразном состоянии, закон эквивалентов удобно представить в виде 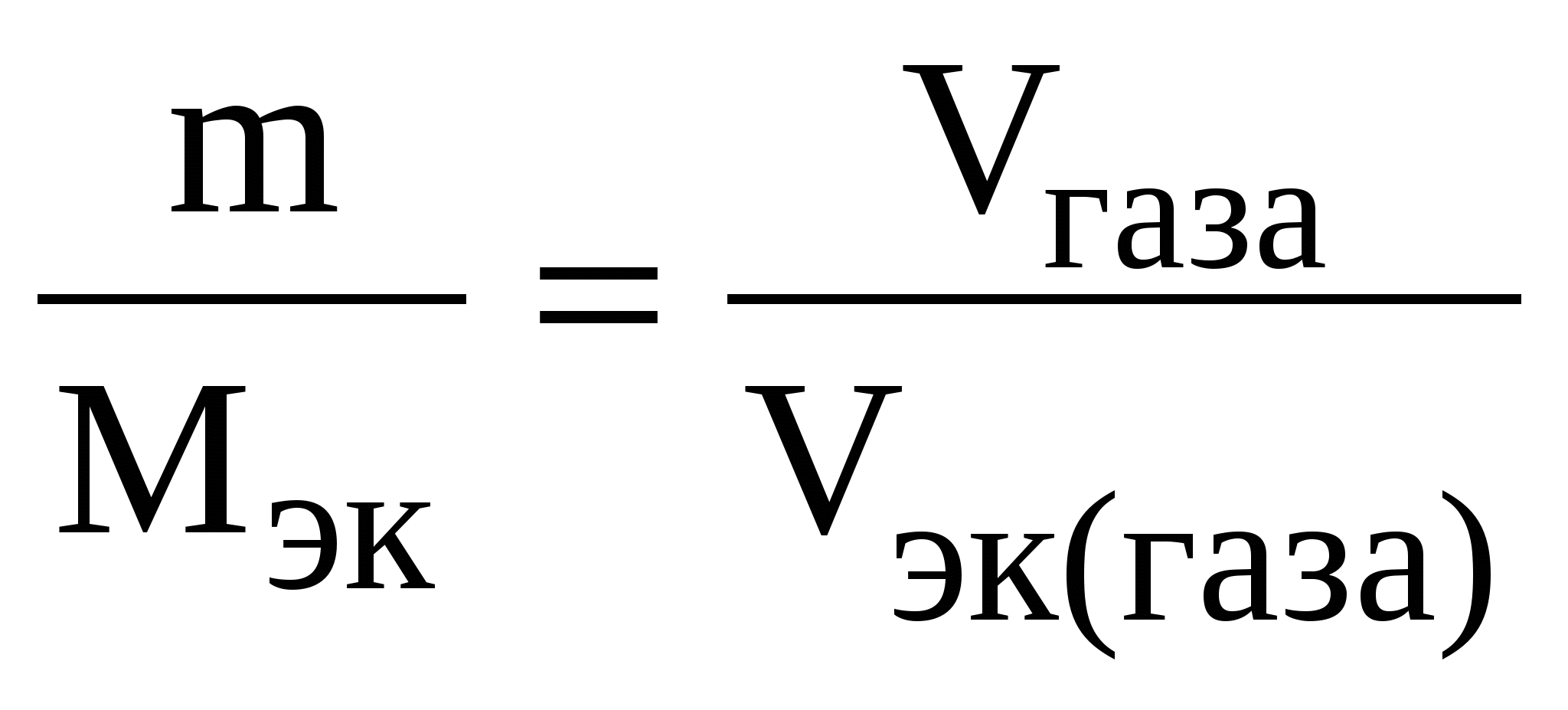 , ,где Vэк – объем одного моля эквивалентов газа. Для вычисления объема моля эквивалентов газа необходимо знать число молей эквивалентов (υ) в одном моле газа: υ = Примеры решения задачПример 1.1. На восстановление 7,09 г оксида металла со степенью окисления +2 требуется 2,24 л водорода (н. у.). Вычислите молярные массы эквивалентов оксида и металла. Чему равна молярная масса металла? Решение. Задача решается по закону эквивалентов. Так как одно из реагирующих веществ находится в газообразном состоянии, то удобно воспользоваться формулой 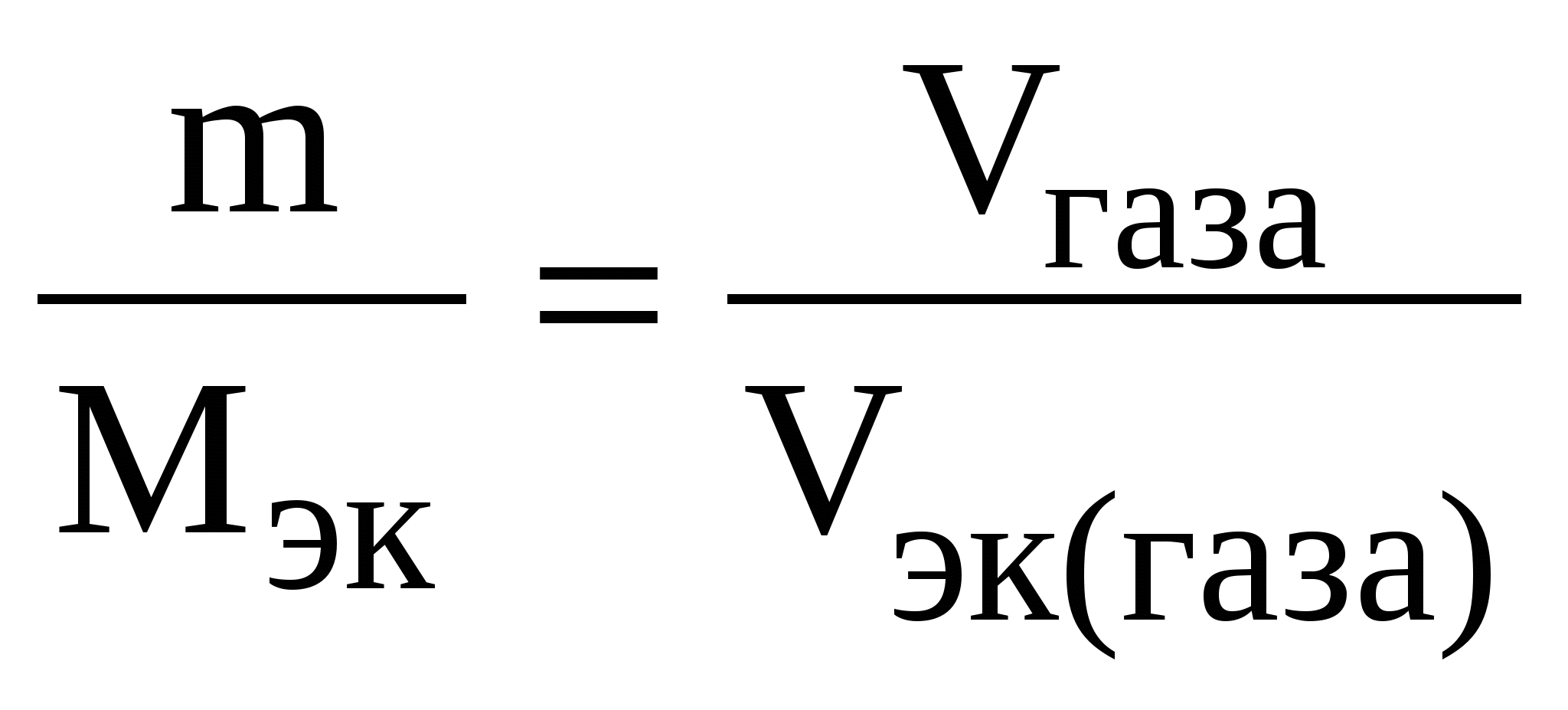 , , 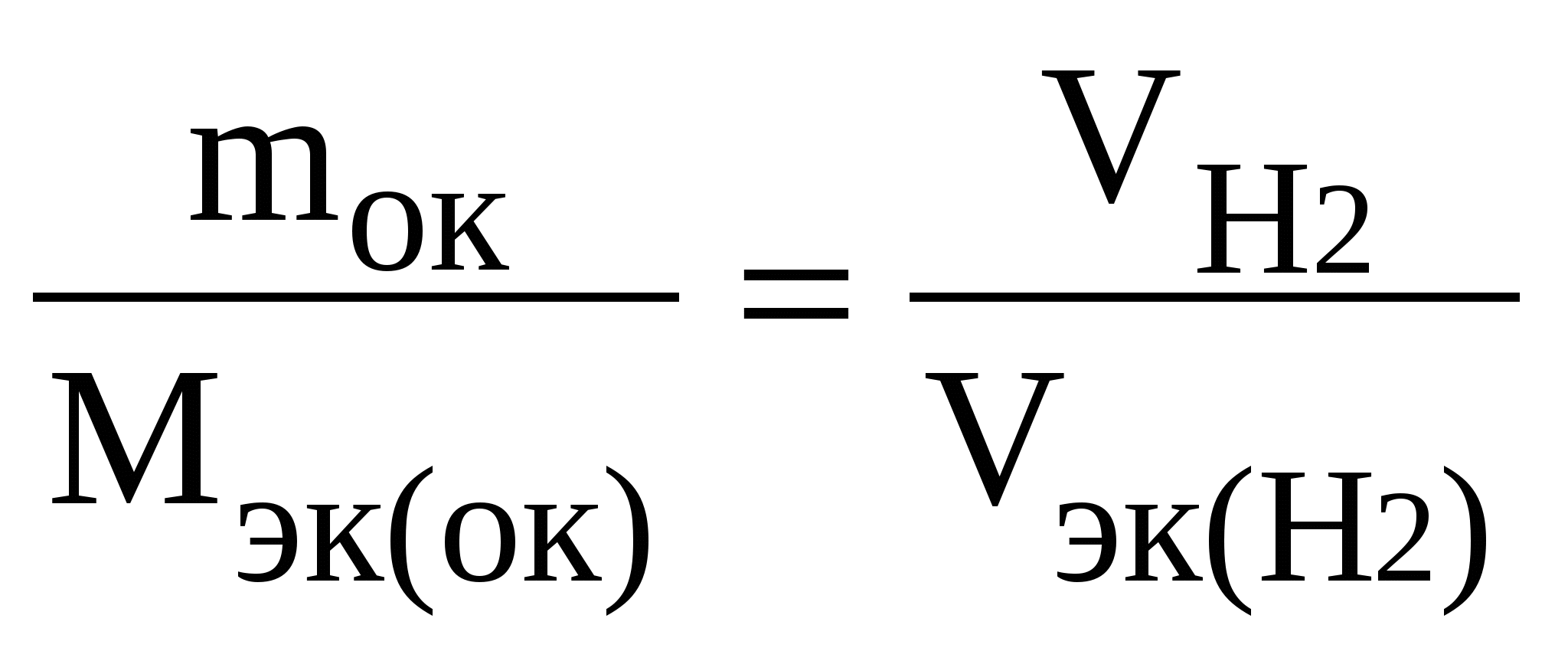 Напомним, что объем 1 моль эквивалентов водорода равен 11,2 л (н. у.), тогда Мэк(ок) = Молярная масса эквивалентов химического соединения равна сумме молярных масс эквивалентов составляющих его частей. Оксид – это соединение ме- талла с кислородом, поэтому молярная масса эквивалентов оксида пред- ставляет собой сумму Мэк (оксида) = Мэк (металла) + Мэк (кислорода). Отсюда, Мэк (металла) = Мэк (оксида) – Мэк (кислорода) = 35,45 – 8 = 27,45 г/моль. Молярная масса металла определяется из соотношения Мэк(металла) = Пример 1.2. При взаимодействии кислорода с азотом получено 4 моль эквивалентов оксида азота (IV). Рассчитайте объемы газов, вступивших в реакцию при н. у. Решение. По закону эквивалентов число молей эквивалентов вступающих в реакцию и образующихся в результате реакции веществ равны между собой, т.е. υ(О2) = υ(N2) = υ(NO2). Так как получено 4 моль эквивалентов оксида азота (IV), то, следовательно, в реакцию вступило 4 моль эквивалентов О2 и 4 моль эквивалентов N2. Азот изменяет степень окисления от 0 (в N2) до +4 (в NО2) и, так как в его молекуле 2 атома, то вместе они отдают 8 электронов, поэтому Мэк(N2)= 28 г/моль N2 – 22,4 л 3,5 г/моль N2 – х х = Так как в реакцию вступило 4 моль эквивалентов N2, то их объем составляет V(N2) = 2,8·4 = 11,2 л. Зная, что моль эквивалентов кислорода при н. у. занимает объем 5,6 л, рассчитываем объем 4 моль эквивалентов О2, вступивших в реакцию: V(O2) = 5,6·4 = 22,4 л. Итак, в реакцию вступило 11,2 л азота и 22,4 л кислорода. Пример 1.3. Определите молярную массу эквивалентов металла, если из 48,15 г его оксида получено 88,65 г его нитрата. Решение. Учитывая, что Мэк(оксида) = Мэк(металла) + Мэк(кислорода), а Мэк(соли) = Мэк(металла) + Мэк(кислотного остатка), подставляем соответствующие данные в закон эквивалентов: Пример 1.4. Вычислите степень окисления хрома в оксиде, содержащем 68,42 % (масс.) этого металла. Решение. Приняв массу оксида за 100%, находим массовую долю кислорода в оксиде: 100 – 68,42 = 31,58%, т.е. на 68,42 частей массы хрома приходится 31,58 частей массы кислорода или на 68,42 г хрома приходится 31,58 г кислорода. Зная, что молярная масса эквивалентов кислорода равна 8 г/моль, определим молярную массу эквивалентов хрома в оксиде по закону эквивалентов: 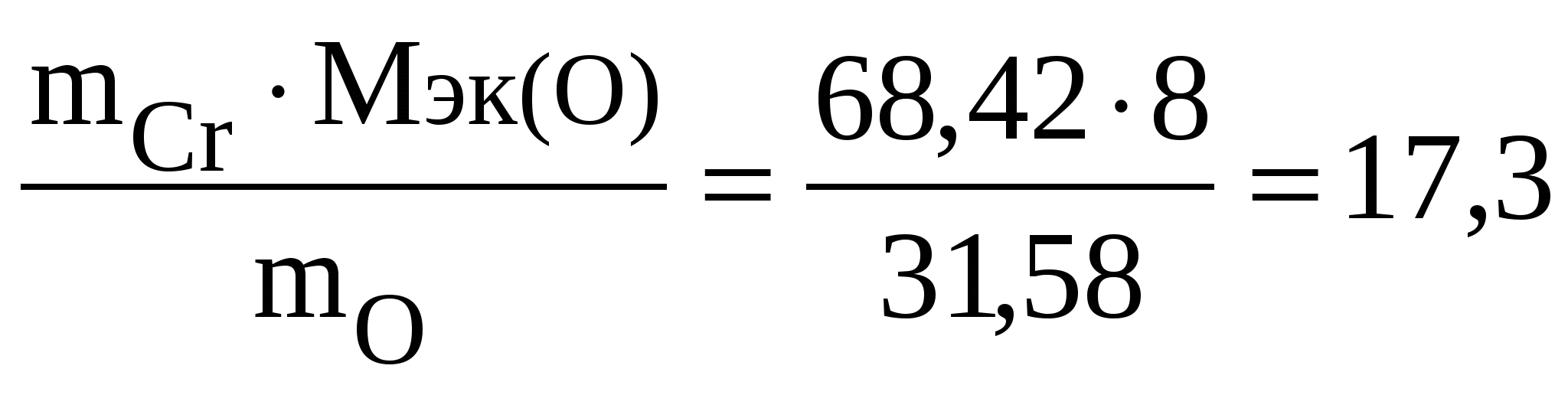 г/моль. г/моль.Степень окисления хрома находим из соотношения Мэк(Cr)= Контрольные вопросы1. При взаимодействии 6,75 г металла с серой образовалось 18,75 г сульфида. Рассчитайте молярные массы эквивалентов металла и его сульфида. Молярная масса эквивалентов серы равна 16 г/моль. (Ответ: 9 г/моль; 25 г/моль). 2. Вычислите степень окисления золота в соединении состава: 64,9% золота и 35,1% хлора. Молярная масса эквивалентов хлора 35,45 г/моль. (Ответ: 3). 3. Вычислите молярные массы эквивалентов и эквиваленты Р2О5 в реакциях, идущих по уравнениям: Р2О5 + 3MgO = Mg3(PO4)2 (1) P2O5 + MgO = Mg(PO3)2. (2) (Ответ: 23,7 г/моль; 71 г/моль; 1/6 Р2О5; 1/2 Р2О5). 4. Сколько молей эквивалентов металла вступило в реакцию с кислотой, если при этом выделилось 5,6 л водорода при нормальных условиях? (Ответ: 0,5 моль). 5. На нейтрализацию 0,943 г фосфористой кислоты Н3РО3 израсходовано 1,291 г КОН. Вычислите молярную массу эквивалентов кислоты. (Ответ: 41 г/моль). 6. Определите молярную массу эквивалентов металла и назовите металл, если 8,34 г его окисляются 0,68 л кислорода (н. у.). Металл окисляется до степени окисления +2. (Ответ: 68,7 г/моль). 7. Вычислите степень окисления свинца в оксиде, в котором на 1 г свинца приходится 0,1544 г кислорода. (Ответ: 4). 8. Вычислите эквивалент и молярную массу эквивалентов Al(OH)3 в каждой из следующих реакций, выраженных уравнениями: Al(OH)3 + 3HCl = AlCl3 + 3H2O (1) Al(OH)3 + 2HCl = AlOHCl2 + 2H2O (2) Al(OH)3 + HCl = Al(OH)2Cl + H2O (3) 9. Для получения гидроксида железа (III) смешали растворы, содержащие 0,2 моль эквивалентов щелочи и 0,3 моль эквивалентов хлорида железа (III). Сколько граммов гидроксида железа (III) получилось в результате реакции? (Ответ: 7,13 г). 10. Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите молярную массу эквивалентов этого металла. (Ответ: 9 г/моль). 11. При взаимодействии 22 г металла с кислотой выделилось при н. у. 8,4 л водорода. Рассчитайте молярную массу эквивалентов металла. Сколько литров кислорода потребуется для окисления этого же количества металла? (Ответ: 29,33 г/моль; 4,2 л.). 12. Вычислите степень окисления мышьяка в соединении его с серой, в котором на 1 г мышьяка приходится 1,07 г серы. Молярная масса эквивалентов серы 16 г/моль. (Ответ: 5). 13. Вычислите эквивалент и молярную массу эквивалентов Н3РО4 в каждой из следующих реакций, выраженных уравнениями: Н3РО4 + КОН = КН2РО4 + Н2О (1) Н3РО4 + 2КОН = К2НРО4 + 2Н2О (2) Н3РО4 + 3КОН = К3РО4 + 3Н2О. (3) 14. При взаимодействии водорода и азота получено 6 моль эквивалентов аммиака. Какие объемы водорода и азота вступили при этом в реакцию при нормальных условиях? (Ответ: 67,2 л; 22,4 л.) 15. При пропускании сероводорода через раствор, содержащий 2,98 г хлорида металла, образуется 2,2 г его сульфида. Вычислите молярную массу эквивалентов металла. (Ответ: 39 г/моль). 16. Молярная масса эквивалентов металла равна 56,2 г/моль. Вычислите массовую долю металла в его оксиде. (Ответ: 87,54%). 17. Определите эквивалент и молярную массу эквивалентов азота, кислорода, углерода в соединениях NH3, H2O, CH4. 18. Рассчитайте молярную массу эквивалентов металла, если при взаимодействии 7,2 г металла с хлором было получено 28,2 г соли. Молярная масса эквивалентов хлора равна 35,45 г/моль. (Ответ: 12,15 г/моль). 19. Рассчитайте молярную массу эквивалентов воды при реакции ее: а) с металлическим натрием; б) с оксидом натрия. (Ответ: 18 г/моль; 9 г/моль). 20. 0,43 г металла при реакции с кислотой вытеснили при н. у. 123,3 мл водорода. 1,555 г этого же металла вступают во взаимодействие с 1,415 г некоторого неметалла. Рассчитайте молярную массу эквивалентов неметалла. (Ответ: 35,5 г/моль) 2. Строение атома Атом – это наименьшая частица химического элемента, сохраняющая все его химические свойства. Атом состоит из положительно заряженного ядра и вращающихся вокруг него электронов. Заряд ядра атома численно равен порядковому номеру элемента в периодической системе. Так как атом в целом электронейтрален, то и число электронов, движущихся вокруг ядра атома, равно порядковому номеру. Например, порядковый номер натрия 11. Значит, заряд ядра атома натрия +11. Вокруг ядра размещается 11 электронов с общим отрицательным зарядом –11. Все электроны атома образуют его электронную оболочку, строение которой определяет многие химические свойства элемента. Электроны имеют двойственную природу: они обладают как свойствами частицы, так и волновыми свойствами. Для движущегося электрона невозможно указать его точное местоположение. Можно лишь определить вероятность нахождения электрона в различных частях внутриатомного пространства. Область пространства, в которой наиболее вероятно нахождение электрона, называется атомной орбиталью (АО). Состояние электрона в атоме характеризуется четырьмя квантовыми числами. Главное квантовое числоn определяет энергию электрона в атоме и размер АО, т.е. удаленность электрона от ядра. Главное квантовое число n принимает значения целых чисел 1, 2, 3, 4… Совокупность электронов с одинаковым значением n называется энергетическим уровнем. Наименьшей энергией обладают электроны первого от ядра энергетического уровня (n=1); с увеличением n энергия электрона и его удаленность от ядра возрастает. Состояние атома, когда его электроны находятся на таких энергетических уровнях, что их суммарная энергия является минимальной, называется основным или невозбужденным. Состояния с более высокими значениями энергии называются возбужденными. Энергетические уровни обозначают буквами: Числовое значение n 1 2 3 4 5 6 7 Буквенное обозначение KLMNOPQ Число энергетических уровней в атоме, находящемся в основном состоянии, равно номеру периода, в котором находится элемент. На одном и том же энергетическом уровне могут находиться атомные орбитали различной формы, отличающиеся друг от друга по энергии. Поэтому энергетические уровни разделяются на подуровни. Энергию электрона на подуровне и форму атомной орбитали характеризуеторбитальное квантовое число l. Значение l зависит от главного квантового числа: l принимает значения от 0 до (n–1), т. е. 0, 1, 2, 3… (n–1). В пределах данного энергетического уровня совокупность электронов, характеризующихся одинаковым значением l, называется энергетическим подуровнем. Подуровни обозначают буквами: Орбитальное квантовое число l 0 1 2 3 Обозначение энергетического подуровня spdf Таким образом, при l=0, 1, 2, 3 электроны находятся соответственно на s-, p-, d-, f-подуровнях. Электроны различных подуровней называют s-, p-, d-, f-электронами. В этом случае говорят также о состояниях s-, p-, d-, f-электронов или s-, p-, d-, f-атомных орбиталях. Число энергетических подуровней в уровне не должно превышать главное квантовое число n. Так, первый уровень (n=1) имеет один подуровень (s), второй уровень (n=2) – два подуровня (s и p), третий (n=3) – три (s, p, d), четвертый (n=4) – четыре (s, p, d, f). В оболочках атомов ныне известных элементов электроны застраивают на каждом уровне не более четырех подуровней. Уровни O (n=5), P (n=6), Q (n=7) содержат по четыре подуровня. При данном значении главного квантового числа n наименьшей энергией обладают электроны s-подуровня, затем p-, d-, f-подуровней. Каждый подуровень составлен из орбиталей, число которых определяется магнитными квантовым числом ml. Магнитное квантовое числоml определяет возможные ориентации орбитали в пространстве. Оно связано с орбитальным квантовым числом и может принимать целочисленные значения от –l до +l, включая ноль. Определенному значению l соответствует (2l+1) возможных значений магнитного квантового числа. Число значений ml указывает на число атомных орбиталей в подуровне и число возможных направлений, по которым они могут ориентироваться в пространстве. Для s-подуровня l=0 и потому ml имеет единственное значение: ml =0. Таким образом, на s-подуровне имеется единственная s-орбиталь и она расположена симметрично относительно ядра атома. Для p-подуровня l=1 и ml приобретает три значения: –1, 0, 1, т. е. р-подуровень имеет три р-орбитали и они ориентированы по трем осям координат. d-подуровень с l=2 имеет пять значений ml: –2, –1, 0, 1, 2 и, следовательно, пять d-орбиталей, которые ориентированы по пяти разным направлениям. f-подуровень с l=3 имеет семь значений ml: –3, –2, –1, 0, 1, 2, 3, т. е. семь f-орбиталей. Число ориентаций f-орбиталей равно семи. У    словно АО обозначают в виде квадрата (квантовой ячейки) Error: Reference source not found. Соответственно для s-подуровня имеется одна АО Error: Reference source not found, для p-подуровня – три АО, для d-подуровня пять АОError: Reference source not found, для f-подуровня семь АО.Error: Reference source not found словно АО обозначают в виде квадрата (квантовой ячейки) Error: Reference source not found. Соответственно для s-подуровня имеется одна АО Error: Reference source not found, для p-подуровня – три АО, для d-подуровня пять АОError: Reference source not found, для f-подуровня семь АО.Error: Reference source not foundТаким образом, электроны в атоме располагаются по энергетическим уровням, удаленность которых от ядра характеризуется значением главного квантового числа n; уровни состоят из подуровней, число которых для каждого уровня не превышает значение n; в свою очередь подуровень состоит из орбиталей, количество которых задается числом значений магнитного квантового числа ml. Квантовые числа n, l, ml характеризуют орбиталь. Кроме движения вокруг ядра, электрон вращается вокруг собственной оси. Это движение получило название «спин». Спиновое квантовое числоms характеризует два возможных направления вращения электрона вокруг собственной оси (по часовой стрелке или против). Спиновое квантовое число msпринимает два значения: +½ и –½. Электроны с разными спинами обычно обозначаются противоположно направленными стрелками ↓↑. Четыре квантовых числа n, l, ml, ms полностью характеризуют состояние электрона в атоме. Согласно принципу Паули в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел. Принцип Паули определяет максимальное число электронов на одной орбитали, уровне и подуровне. Так как АО характеризуется тремя квантовыми числами n, l, ml, электроны данной орбитали могут различаться только спиновым квантовым числом ms. Но ms может иметь только два значения +½ и –½. Следовательно, на одной орбитали может находиться не более двух электронов с противоположно направленными спинами Таблица 2.1. Максимальное число электронов на квантовых уровнях и подуровнях
Последовательность заполнения электронами орбиталей осуществляется в соответствии с принципом минимальной энергии, согласно которому электроны заполняют орбитали в порядке повышения уровня энергии орбиталей. Очередность орбиталей по энергии определяется правилом Клечковского: увеличение энергии и соответственно заполнение орбиталей происходит в порядке возрастания суммы (n+l), а при равной сумме (n+l) – в порядке возрастания n. Порядок распределения электронов по энергетическим уровням и подуровням в оболочке атома называется его электронной конфигурацией. При записи электронной конфигурации номер уровня (главное квантовое число) обозначают цифрами 1, 2, 3, 4…, подуровень (орбитальное квантовое число) – буквами s, p, d, f. Число электронов в подуровне обозначается цифрой, которая записывается вверху у символа подуровня. Например, электронная конфигурация атома серы имеет вид: 16S 1s22s22p63s23p4, а ванадия 23V 1s22s22p63s23p63d34s2. Химические свойства атомов определяются, в основном, строением наружных энергетических уровней, которые называются валентными. Полностью завершенные энергетические уровни в химическом взаимодействии не участвуют. Поэтому часто для краткости записи электронной конфигурации атома их обозначают символом предшествующего благородного газа. Так, для серы: [Ne]3s23p4; для ванадия: [Ar]3d34s2. Одновременно сокращенная запись наглядно выделяет валентные электроны, определяющие химические свойства атомов элемента. В зависимости от того, какой подуровень в атоме заполняется в последнюю очередь, все химические элементы делятся на 4 электронных семейства: s-, p-, d-, f-элементы. Элементы, у атомов которых в последнюю очередь заполняется s-подуровень внешнего уровня, называются s-элементами. У s-элементов валентными являются s-электроны внешнего энергетического уровня. У р-элементов последним заполняется р-подуровень внешнего уровня. У них валентные электроны расположены на p- и s-подуровнях внешнего уровня. У d-элементов в последнюю очередь заполняется d-подуровень предвнешнего уровня и валентными являются s-электроны внешнего и d-электроны предвнешнего энергетического уровней. У f-элементов последним заполняется f-подуровень третьего снаружи энергетического уровня. Электронная конфигурация атома может быть изображена также в виде схем размещения электронов в квантовых ячейках, которые являются графическим изображением атомной орбитали. В каждой квантовой ячейке может быть не более двух электронов с противоположно направленными спинами 16S 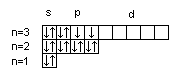 23V 23V 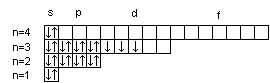 Суммарный спин р-электронов третьего энергетического уровня атома серы равен ms= ½ – ½ + ½ + ½ = 1; d-электронов атома ванадия – ms= ½ + ½ + ½ = 3/2. Часто изображают графически не всю электронную формулу, а лишь те подуровни, на которых находятся валентные электроны, например 16S…3s2 3p4 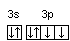 ; 23V…3d34s2 ; 23V…3d34s2 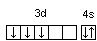 При графическом изображении электронной конфигурации атома в возбужденном состоянии наряду с заполненными изображают вакантные валентные орбитали. Например, в атоме фосфора на третьем энергетическом уровне имеется одна s-АО, три р-АО и пятьd-АО. И электронная конфигурация атома фосфора в основном состоянии имеет вид: 15Р… 3s2 3p3 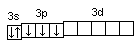 Валентность фосфора, определяемая числом неспаренных электронов, равна 3. При переходе атома в возбужденное состояние происходит распаривание электронов состояния 3s и один из электронов с s-подуровня может перейти на d-подуровень: Р*… 3s2 3p3 3d1 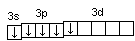 При этом валентность фосфора меняется с трех (РСl3) в основном состоянии до пяти (РCl5) в возбужденном состоянии. Примеры решения задачПример 2.1. Запишите электронную конфигурацию атома титана. Сколько свободных d-орбиталей содержится на предвнешнем энергетическом уровне Тi? Решение. Порядковый номер титана (Ti) в периодической системе 22. Следовательно, положительный заряд ядра равен +22 и столько же электронов в атоме титана. Поскольку титан находится в 4 периоде, электроны располагаются на 4-х энергетических уровнях следующим образом: 22Ti 2е, 8е, 10е, 2е. Запись электронной конфигурации атома титана по уровням и подуровням имеет вид: 1s22s22p63s23p63d24s2. В соответствии с правилом Хунда электроны на d-подуровне у атома титана располагаются следующим образом: Очевидно, что на предвнешнем энергетическом уровне атома титана содержится три свободные d-орбитали. Пример 2.2. Возможно ли наличие в атоме двух электронов с одинаковыми значениями трех квантовых чисел: l, ml, ms? Приведите примеры. Решение. Да, возможно, это не противоречит принципу Паули. Два электрона, характеризующиеся одинаковыми значениями трех квантовых чисел l, ml, ms, должны отличаться главным квантовым числом n. Например, в атоме фтора, электронная конфигурация которого 1s22s22p5, для электронов 1s1 и 2s1 квантовые числа будут иметь следующие значения: Для 1s1 n = 1, l = 0, ml = 0, ms = ½. Для 2s1 n = 2, l = 0, ml = 0, ms = ½. Пример 2.3. Какие орбитали атома заполняются электронами раньше 5d или 6s; 4f или 6p? Решение. Последовательность заполнения орбиталей осуществляется в соответствии с правилом Клечковского и определяется суммой (n+l). Для подуровня 5d сумма (n+l) равна (5+2) = 7, для подуровня 6s (6+0) = 6. В первую очередь заполняются орбитали с меньшей энергией, следовательно, вначале заполняется 6s, потом 5d. Для подуровней 4f и 6р сумма (n+l) одинакова (4+3) = 7 и (6+1) = 7. При одинаковом значении суммы (n+l) раньше заполняется подуровень с меньшим n, следовательно, 4f. Пример 2.4. Запишите электронную конфигурацию ионов Fe3+ и S2–. Решение. Электронная конфигурация атома железа 26Fe 1s22s22p63s23p63d64s2. Если атом железа отдаст три электрона, он превратится в ион: Fe0 – 3e → Fe3+. В первую очередь атом отдает электроны с более высокого энергетического уровня и подуровня. Электронная конфигурация ионов Fe3+ имеет вид 1s22s22p63s23p63d54s0. Электронная конфигурация атома серы 16S 1s22s22p63s2 3p4. Приняв два электрона S0 + 2e → S2–, атом серы превращается в ион S2–, электронная конфигурация которого 1s22s22p63s23p6. Пример 2.5. Охарактеризуйте квантовыми числами электроны состояния 3р3. Решение. Изобразим графически распределение электронов состояния 3р3: 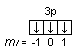 . Каждый электрон в атоме характеризуется набором четырех квантовых чисел: n, l, ml, ms. Главное квантовое число n обозначается арабской цифрой. Для указанных электронов главное квантовое число n равно 3. Электроны находятся на р-подуровне, следовательно, для всех трех электронов l=1. Три электрона находятся на разных орбиталях, которые ориентированы по трем разным направлениям. Ориентацию АО в пространстве определяет магнитное квантовое число ml, значение которого зависит от орбитального квантового числа l. Если l=1, ml принимает значение –1, 0, 1 (значение ml указано под каждой орбиталью). Спиновое квантовое число ms принимает значения +½ и –½. Таким образом, электроны состояния 3р3 характеризуются следующими квантовыми числами: . Каждый электрон в атоме характеризуется набором четырех квантовых чисел: n, l, ml, ms. Главное квантовое число n обозначается арабской цифрой. Для указанных электронов главное квантовое число n равно 3. Электроны находятся на р-подуровне, следовательно, для всех трех электронов l=1. Три электрона находятся на разных орбиталях, которые ориентированы по трем разным направлениям. Ориентацию АО в пространстве определяет магнитное квантовое число ml, значение которого зависит от орбитального квантового числа l. Если l=1, ml принимает значение –1, 0, 1 (значение ml указано под каждой орбиталью). Спиновое квантовое число ms принимает значения +½ и –½. Таким образом, электроны состояния 3р3 характеризуются следующими квантовыми числами:n= 3, l= 1, ml= –1, ms= ½ (или –½) n= 3, l= 1, ml= 0, ms= ½ (или –½) n= 3, l= 1, ml= 1, ms= ½ (или –½) | |||||||||||||||||||||||||||||||||||||||
