Химия методичка. Методические указания к написанию и оформлению контрольной работы по химии
 Скачать 0.91 Mb. Скачать 0.91 Mb.
|
При сгорании 1 л С2Н4 (н.у.) выделяется 59,06 кДж теплоты. Определите стандартную энтальпию образования этилена. (Ответ: 52,3 кДж/моль).63. Сожжены с образованием H2O(г) равные объемы водорода и ацетилена, взятых при одинаковых условиях. В каком случае выделится больше теплоты? Во сколько раз? (Ответ: 5,2).64. Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена, если продуктами сгорания являются диоксид углерода и пары воды. (Ответ: 9248,8 кДж). 65. Газообразный этиловый спирт С2H5OH можно получить при взаимодействии этилена С2Н4(г) и водяных паров. Вычислите тепловой эффект этой реакции и напишите термохимическое уравнение. Сколько теплоты выделится, если в реакции было израсходовано 100 л этилена (н.у.)? (Ответ: 45,8 кДж; 204,5 кДж). 66. Вычислите, какое количество теплоты выделилось при восстановлении Fe2O3 металлическим алюминием, если было получено 335,1 г железа. (Ответ: 2554,5 кДж). 67. При растворении 16 г СаС2 в воде выделяется 31,27 кДж теплоты. Определите стандартную энтальпию образования Са(ОН)2. (Ответ: –986,2 кДж/ моль). 68. При восстановлении 12,7 г оксида меди (II) углем (с образованием СО) поглощается 8,24 кДж. Определите стандартную энтальпию образования СuO. (Ответ: –162 кДж/моль). 69. Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений: FeO(к) + CO(г) = Fe(к) + СO2 (г), ∆Н0(1) = –19,2 кДж (1) СO(г) + ½O2 (г) = СO2 (г), ∆Н0(2)= –283 кДж (2) H2 (г) + ½O2 (г) = H2O(г), ∆Н0(3)= –241,8 кДж (3) (Ответ: 22 кДж) 70. Вычислите стандартную энтальпию образования NO из простых веществ, исходя из следующих термохимических уравнений: 4NH3(г) + 5О2(г) = 4NO (г) + 6 Н2О(ж), ∆Н0(1)= –1168,80 кДж (1) 4NH3(г) + 3О2(г) = 2N2 (г) + 6 Н2О(ж), ∆Н0(2) = –1530,28 кДж (2) (Ответ: 90,37 кДж) 71. Рассчитайте стандартную энтропию оксида железа (III), если известно изменение энтропии реакции 4FeO(к) + O2(г) = 2Fe2O3 (к), ∆S0х.р.= –260,4 кДж(Ответ: 89,9 Дж/моль К). 72. При какой температуре наступит равновесие в системе СО(г) + 2Н2(г) 73. Определите количество теплоты, выделившейся при взаимодействии 50 г фосфорного ангидрида с водой по реакции Р2О5(к) + H2O(ж) = 2HPO3(ж), если тепловые эффекты реакции равны 2Р(к) + 5½O2(г) = Р2О5(к), ∆Н0 = –1492 кДж 2Р(к) + H2(г) + 3O2(г) = 2HPO3(ж), ∆Н0 = –1964,8 кДж (Ответ: 65,8 кДж). 74. Вычислите ∆Н0х.р., ∆S0х.р. и ∆G0Т реакции, протекающей по уравнению Fe2O3(к) + 3Н2(г) = 2Fe(к) + 3Н2O(г). Возможна ли реакция восстановления Fe2O3 водородом при температурах 500 и 1500 К? Зависимостью ∆Н0х.р., ∆S0х.р от температуры пренебречь. (Ответ: +96,8 кДж; 138,8 Дж/К; 27,3 кДж; –111,7 кДж). 75. Определите стандартную энтальпию образования пентахлорида фосфора из простых веществ, исходя из следующих термохимических уравнений: 2Р + 3Сl2 = 2РСl3, ∆Н0(1)= –554,0 кДж (1) РСl3 + Сl2 = РСl5, ∆Н0(2) = –92,4 кДж (2) (Ответ: –369,4 кДж/моль) 76. Рассчитайте энергию Гиббса химических реакций, протекающих по уравнениям: CaO(к) + Н2О(г) = Са(ОН)2 (к) (1) Р2О5(к) + 3Н2О(г) = 2Н3РО4 (к) (2) и определите, какой из двух оксидов CaO или Р2О5 при стандартных условиях лучше поглощает водяные пары. (Ответ: –65,5 кДж; –205, 2кДж). 77. Вычислите значения ∆G0х.р. следующих реакций восстановления оксида железа (III) Fe2O3 (к) + 3Н2(г) = 2Fe(к) + 3Н2О(г) (1) 2Fe2O3 (к) + 3С(к) = 4Fe(к) + 3СО2(г) (2) Fe2O3 (к) + 3СO(г) = 2Fe(к) + 3СО2(г) (3) Протекание какой из этих реакций наиболее вероятно? (Ответ: +55 кДж; +298,4 кДж; –31,1 кДж). 78. Пользуясь значениями ∆Н0х.р., ∆S0х.р,вычислите∆G0реакции, протекающей по уравнению PbO2 + Pb = 2PbO. Определите, возможна ли эта реакция при 298 К?(Ответ: –158 кДж.). 79. Какой из двух процессов разложения нитрата аммония наиболее вероятен при 298 К? NH4NO3 (к) → N2O (г) + 2H2O(г) (1) NH4NO3 (к) → N2 (г) + ½O2 (г) + 2H2O(г) (2) Ответ обоснуйте, рассчитав ∆G0х.р.(Ответ: –169,1 кДж; –273,3 кДж.). 80. Вычислите стандартную энергию Гиббса образования NH3, исходя из значений энтальпии образования NH3 и изменения энтропии (∆S0) реакции N2 (г) + 3Н2(г) = 2NH3(г). (Ответ:–16,7кДж/моль). 5. Химическая кинетика и равновесие Химическая кинетика – раздел химии, изучающий скорость и механизм химических реакций. Скоростью химической реакции называют изменение количества вещества в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности раздела фаз (для гетерогенных реакций). Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры, присутствия катализаторов. Зависимость скорости реакции от концентрации выражается законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Для реакции nА + mВ = gАВ математическое выражение закона действия масс имеет вид v = САn СB m , где v – скорость химической реакции; СА и СВ – концентрации реагирующих веществ; n, m – коэффициенты в уравнении реакции; – константа скорости реакции. Значение константы скорости не зависит от концентрации реагирующих веществ, а зависит от их природы и температуры. В случае гетерогенных реакций концентрации веществ, находящихся в твердой фазе, обычно не изменяются в ходе реакции и поэтому не включаются в уравнение закона действия масс. Например, для реакции горения углерода С (к) + О2(г) = СО2(г) закон действия масс запишется так: v = При повышении температуры скорость химических реакций увеличивает-ся. Согласно правилу Вант-Гоффа: при повышении температуры на 10 градусов скорость реакции увеличивается в 2-4 раза где v2 и v1 – скорость реакции при температурах Т2 и Т1; γ – температурный коэффициент скорости реакции, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10 градусов. Химические реакции делятся на необратимые и обратимые. Необратимые реакции протекают только в прямом направлении – до полного израсходования одного из реагирующих веществ. Обратимые реакции протекают как в прямом, так и в обратном направлениях, при этом ни одно из реагирующих веществ не расходуется полностью. Состояние обратимого процесса, при котором скорости прямой и обратной реакции равны, называется химическим равновесием. Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными. Для обратимых процессов закон действия масс может быть сформулирован в следующем виде: отношение произведения концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам, является величиной постоянной при данной температуре. Эта величина называется константой равновесия. Равновесные концентрации принято обозначать не символом «С», а формулой вещества, помещенной в квадратные скобки, например, Если реакция протекает между газами, то вместо концентраций можно пользоваться парциальным давлением газов, и константа равновесия в этом случае обозначается символом КР. KР и КС связаны между собой соотношением КР = КС (RT)Δ, где R–универсальная газовая постоянная, равная 8,314 Дж/ мольК; Т– абсолютная температура; Δ – разность между числом молей газообразных веществ в правой и левой частях уравнения. Например, для реакции N2 + 3H2 = 2NH3 Δ = 2– 4 = –2 КР = КС (RT)–2 В реакциях, протекающих без изменения объема, КР = КС. Химическое равновесие остается неизменным до тех пор, пока условия равновесия, при которых оно установилось, сохраняются постоянными. При изменении условий равновесия прямая и обратная реакция начинают протекать с разными скоростями и равновесие нарушается. Через некоторое время скорости прямой и обратной реакции сравняются и в системе вновь наступит равновесие, но уже с новыми равновесными концентрациями всех веществ. Переход системы из одного равновесного состояния в другое называется смещением равновесия. Направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие смещается в направлении, которое ослабляет эффект внешнего воздействия. При увеличении концентрации исходных веществ или уменьшении концентрации продуктов реакции равновесие смещается в сторону продуктов реакции. При увеличении концентраций продуктов реакции или уменьшении концентраций исходных веществ равновесие смещается в сторону исходных веществ. Когда в реакциях участвуют газы, равновесие может нарушиться при изменении давления. При увеличении давления в системе равновесие смещается в сторону реакции, идущей с уменьшением числа молекул газа, т.е. в сторону понижения давления; при уменьшении давления равновесие смещается в сторону реакции, идущей с возрастанием числа молекул газов, т.е. в сторону увеличения давления. При повышении температуры равновесие смещается в направлении эндотермической, при понижении – в направлении экзотермической реакции. Примеры решения задач Пример 5.1. Реакция между веществами А и В выражается уравнением 2А + В = D. Начальные концентрации составляют: СА = 5 моль/л, СВ = 3,5 моль/л. Константа скорости равна 0,4. Вычислите скорость реакции в начальный момент и в тот момент, когда в реакционной смеси останется 60% вещества А. Решение. По закону действия масс v = Пример 5.2. При 323 К некоторая реакция заканчивается за 30 с. Определите, как изменится скорость реакции и время ее протекания при 283 К, если температурный коэффициент скорости реакции равен 2. Решение. По правилу Вант-Гоффа находим, во сколько раз изменится скорость реакции: Скорость реакции уменьшается в 16 раз. Скорость реакции и время ее протекания связаны обратно пропорциональной зависимостью. Следовательно, время протекания данной реакции увеличится в 16 раз и составит 30 16 = 480с = 8 мин. Пример 5.3. При некоторой температуре в системе N2(г) + 3Н2(г) равновесные концентрации составляли (моль/л): [N2]= 1,5; [H2] = 1,7; [NH3] = 2,6. Вычислите константу равновесия этой реакции и исходные концентрации азота и водорода. Решение. Константа равновесия данной реакции выражается уравнением 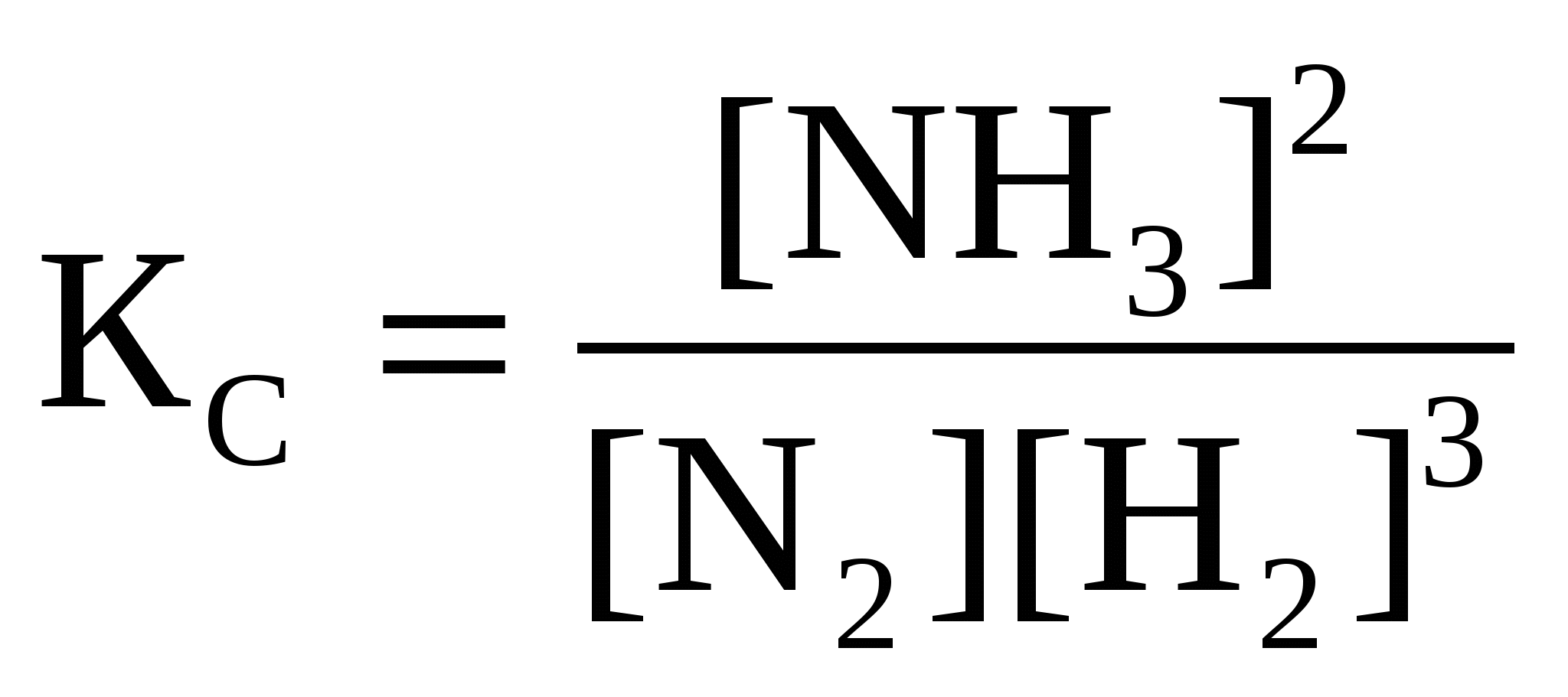 . Подставляя данные задачи, получаем . Подставляя данные задачи, получаем Исходные концентрации азота и водорода находим на основе уравнения реакции. Согласно уравнению реакции на образование 2 моль NH3 расходуется 1 моль N.2. По условию задачи образовалось 2,6 моль NH3, на что израсходовалось 1,3 моль N2. Учитывая равновесную концентрацию азота, находим его исходную концентрацию СN2 = 1,5 + 1,3 = 2,8 моль/л. По уравнению реакции на образование 2 моль NH3 необходимо 3 моль H2, а для получения 2,6 моль NH3 требуется 32,6 / 2 = 3,9 моль H2. Исходная концентрация водорода равна СН2 = 1,7 + 3,9 = 5,6 моль/л. Таким образом, КС = 0,92, исходные концентрации составляли СN2 = 2,8 моль/л, СH2 = 5,6 моль/л. Пример 5.4. Реакция протекает по уравнению А + В Решение. Так как все вещества в данной реакции реагируют в одинаковых соотношениях, обозначим изменение концентрации всех реагирующих веществ через x. К моменту установления равновесия образовалось х моль D и х моль F и соответственно [D] = x; [F] = x. По уравнению реакции на столько же уменьшились концентрации А и В, т. е. [A] = 2 – x; [B] = 1,2 – x. Подставим равновесные концентрации в выражение константы равновесия КС= Отсюда равновесные концентрации равны: [D] = 0,75 моль/л; [F] = 0,75 моль/л; [A] = 2 – 0,75 = 1,25 моль/л; [B] = 1,2 – 0,75 = 0,45 моль/л. Пример 5.5. Объемный состав реакционной газовой смеси в момент равновесия для реакции 2А Решение. Для реакции, протекающих между газами, при вычислении константы равновесия удобно пользоваться парциальными давлениями реагирующих веществ. Парциальным давлением газа в смеси называется давление, которое производил бы этот газ, занимая при тех же физических условиях объем всей газовой смеси. Общее давление смеси газов равно сумме парциальных давлений газов. Для данной реакции парциальные давления составляют РА=0,89105 Па, РВ=0,07105 Па, РD=0,04105 Па. Подставляем эти значения в выражение константы равновесия: 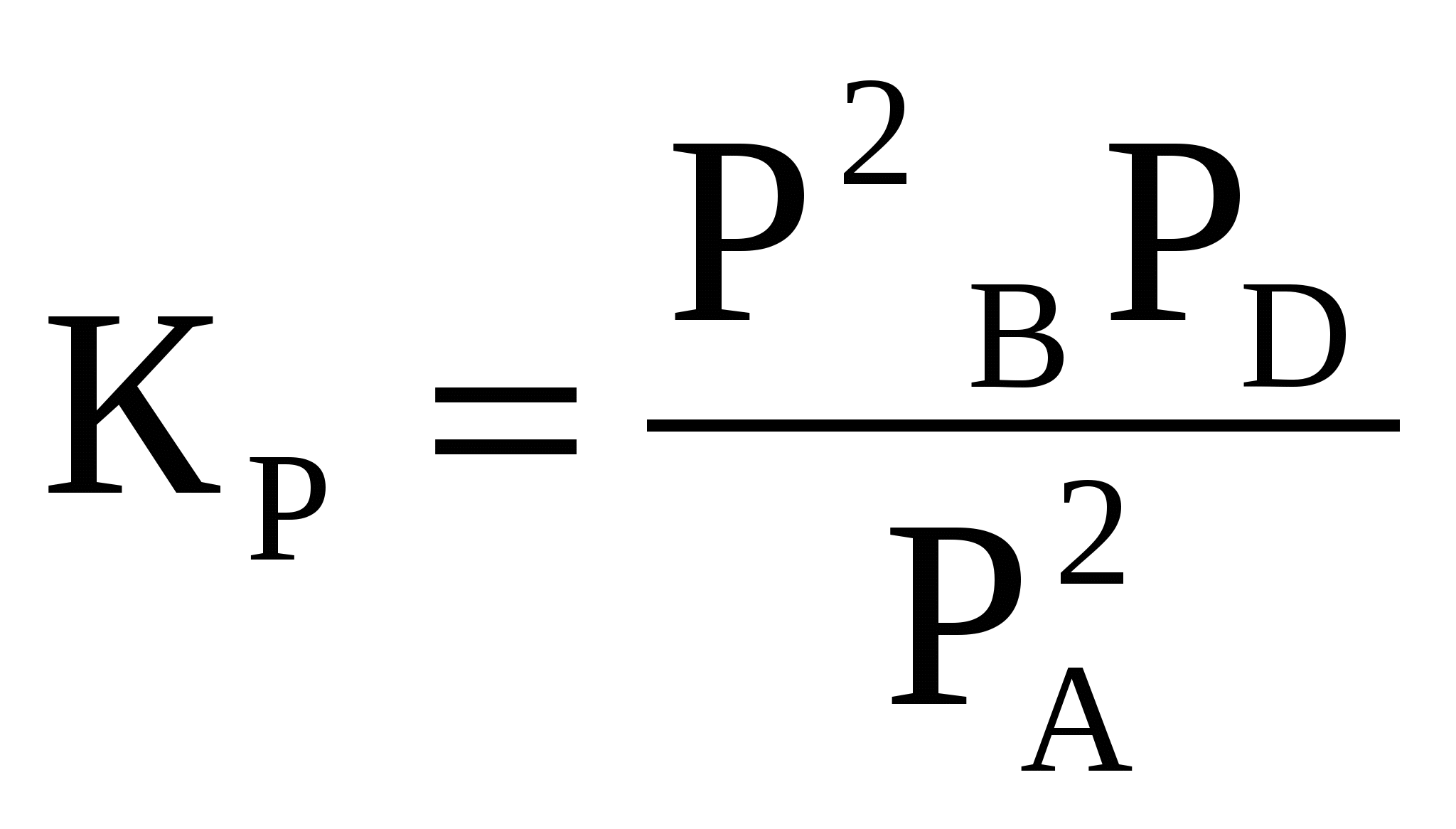 КС рассчитываем по уравнению: КР = КС(RT). Так как для данной реакции Δ = 3 – 2 = 1, то КС = |
