ПРАКТИЧЕСКИЕ ЗАНЯТИЙ (2). Методические указания к выполнению практических работ по по предмету металлургия редких металлов по направлениям бакалавриата
 Скачать 0.55 Mb. Скачать 0.55 Mb.
|
|
Практическая работа № 3. РАСЧЕТ ОБЖИГА МОЛИБДЕНОВОГО КОНЦЕНТРАТА Цель работы: Определение рационального состава фаз, взаимодействие, и приобретение навыков по расчету. Расчет процесса обжига При окислительном обжиге промпродукта в интервале температур 400-5000С молибденит взаимодействует с кислородом с образованием МоО3 минуя стадию образования двуокиси молибдена. Примеси сульфидных минералов меди, железа, цинка превращаются в окислы, частично в сульфаты. Окислы, сульфаты и карбонаты названных элементов в интервале температур 500-7000С активно реагируют с МоО3, образуя молибдаты. Состав огарка рассчитывается следующим образом: дисульфид молибдена при температурах выше 5000С интенсивно взаимодействует с кислородом по суммарной реакции: MoS2+3½O2→MoO3+2SO2. При обжиге в печах КС степень окисления молибденита превышает 95 %. Примем степень окисления молибденита 97 %, тогда: 97% 3% MoS2 + 3½O2 → (MoO3 + MoS2) + 2SO2 35 0,97 = 33,95 кг Мо окисляется до МоО3, 35 0,03 = 1,05 кг Мо недоокисленного в форме МоS2. 33,95 кг Мо – 66,6 % х – 100 % х = 51 - 5,8 – 0,53 – 1,152 – 1 = 42,518 В МоS2 - 60 % и 40 % S2 1,05 кг Мо – 60 % х – 100 % х = В 58,3 кг MoS2, сера 23,3 кг 23,3 – 0,7 = 22,6 кг сера в SО2 В SО2 50 % S2 и 50 % О2. (22,6 100) : 50 = 45,2 кг SО2 2) Примем степень окисления СuS 90 %. 90 % 10 % СuS + 1,5О2 → (СuO + CuS) + 2SO2 4,8 кг 0,9 = 4,32 кг Cu окисляется до СuO В СuO 79,8 % Сu и 20,2 % О2 4,32 кг Cu – 79,8 % х – 100 % х = 4,8 0,1 = 0,48 кг Сu недоокисляется и останется в форме СuS. В СuS 66,4 % Сu и 33,6 % S2. 0,48 кг Cu – 66,4 % х – 100 % х = В 7,3 кг СuS серы – 2,5 кг 2,5 - 0,22 – 2,28 кг серы в SO2 (50 : 50). (2,28 100) : 50 = 4,56 кг SO2. СuO вступает в реакцию с MoO3 в интервале температур 300-7000С. Так как в многоподовой печи температура не должна перевыщать 5900С, то примем, что из всего СuO с MoO3 вступает в реакцию 60 % СuO. 5,4 кг СuO – 100 % х кг СuO – 60 % х = 79,5 кг СuO – 144 кг MoO3 3,24 кг СuO – х % MoO3 х = СuMoO4 = 3,24 + 5,8 = 9,04 кг. 3) Принимаем степень окисления FeS2 90 %. 90 % 10 % 4FeS2 + 11O2 → 2(Fe2O3 + FeS2) + 8SO2. 5,7 0,9 = 5,13 кг Fe окисляется до Fe2O3. В Fe2O3 70 % Fe и 30 % O2. 5,13 кг Fe – 70 % х кг – 100 % х = 5,7 0,1 = 0,57 кг Fe недоокисляется и остается в форме FeS2. В FeS2 46,6 % Fe и 53,4 % S2. 0,57 кг Fe – 46,6 % х кг – 100 % х = В 12,32 кг FeS2 серы 6,62 кг. 6,62- 0,65 = 5,97 S2 в SО2 (5,97 100) : 50 = 11,94 кг SО2 Fe2О3 + 3МоO3 → Fe2(МоО4)3. Это реакция протекает при температуре выше 6000С, а эта температура не допустима в многоподовой печи. И поэтому примем, что реакция не будет протекать. 4) Принимаем степень окисления ZnS 90 %. 90 % 10 % ZnS + 1,5O2 → 2(ZnO + ZnS) + SO2. 0,68 0,9 = 0,612 кг Zn окисляется до ZnO. В ZnO 80,3 % Zn и 19,7 % O2. 0,612 кг Zn – 80,3 % х кг – 100 % х = 0,68 0,1 = 0,068 кг Zn остается в форме ZnS. В ZnS 6,7 % Zn и 33 % S2. 0,068 кг Zn – 67 % х кг – 100 % х = В 1,02 кг ZnS серы 0,34 кг. 0,34- 0,032 = 0,308 кг S2 в SО2, т.е. (50:50). (0,308 100) : 50 = 0,616 кг SО2 Это реакция интенсивно протекает в интервале температур 600-7000С. реакция наблюдается при температуре ниже 4000С. так как максимальная температура печи 5900С, примем, что из этого ZnО в реакцию вступает 40 % ZnО. ZnО + МоO3 → ZnМоО4. 0,762 кг ZnО – 100 % х кг – 40 % х = 0,762 – 0,3 = 0,462 кг ZnO. 81,3 кг ZnО – 144 кг МоО3 0,3 кг ZnO – х кг МоО3 х = ZnМоО4 → 0,3 + 0,53 = 0,83 кг. 5) 100 кг СаСO3 – 56 кг СаО 4 кг СаСO3 – х кг СаО х = 100 кг СаСO3 – 44 кг СO2 4 кг СаСO3 – х кг СO2 х = Эта реакция начинает протекать при температуре выше 5000С. Примем, что в реакцию вступит 20 % СаО. 2,24 кг СаO – 100 % х кг – 20 % х = 56 кг СаO – 144 кг МоO3 0,448 кг СаO – х кг МоO3 х = СаМоО4 = 0,448 + 1,152 = 1,6 кг. 6) 84,3 кг MgСO3 – 40,3 кг MgО 5,9 кг MgСO3 – х кг MgО х = 84,3 кг MgСO3 – 44 кг СO2 5,9 кг MgСO3 – х кг СO2 х = MgО реагирует с МоО3 при температуре 500-7000С. Примем, что в реакцию вступит 10 % MgО. 2,8 кг MgO – 100 % х кг – 10 % х = 2,8 – 0,28 = 2,52 кг MgО 40,3 кг MgO – 144 кг МоO3 0,28 кг MgO – х кг МоO3 х = MgМоО4 = 0,28 + 1 = 1,28 кг. 7) Кремнезем в реакцию в МоО3 не вступает. Результаты расчета сводим в табл. 2. Таблица 2. Химический состав огарка
Практическая работа №5. ГИДРОМЕТАЛЛУРГИЧЕСКОГО ПРОЦЕССА ПЕРЕДЕЛА УРАНОВОГО КОНЦЕНТРАТА I. Расчет экстрактора. Цель работы: Ознакомление студента процессами протекающими в экстракторе и технико-технологической характеристикой оборудования. Характеристика процесса Основной задачей экстракционного передела является очистка урана от примесей и максимальное его концентрирование. Для очистки урана от примесей применяется многоступенчатая экстракция с последующей реэкстракцией органической фазы раствором карбоната и бикарбоната аммония. Различают: Простое физическое распределение. К этой группе относится сравнительно редкие случаи, когда экстракция не сопровождается химические взаимодействием. В данном случае экстрагируются химические соединения, растворимость которых в органическом растворителе на порядок выше, чем в воде. Соединения металлов по этому механизму не экстрагируются. Катионообменная экстракция. Это экстракция катионов металла органическими кислотами. Механизм экстракции состоит в обмене экстрагируемого металла на катион экстрагента. Ди-2-этилгексилфосфорная кислота (Д2ЭГФК) – органическая производная ортофосфорной кислоты. Анионообменная экстракция. Это экстракция анионов металла органическими кислотами. Три-н-актиламин (ТАА) – третичный амин, соль амина. Экстракция нейтральными экстрагентами. Используются нейтральные фосфорорганические соединения: трибутилфосфат (ТБФ). Химизм процесса экстракции: Д2ЭГФК: 2NH4R2PO4 + H2SO4 = (NH4)2SO4 + 2HR2PO4 UO2SO4 + 2HR2PO4 = UO2(R2PO4)2 + H2SO4 ТАА: R3N + H2SO4 = (R3NH)2SO4 UO2SO4 + H2SO4 = H2[UO2(SO4)2] [UO2(SO4)2]2- + (R3NH)2SO4 = (R3NH)2[UO2(SO4)2] + H2SO4 ТБФ: 2(C4H9O)3PO + UO2SO4 = UO2SO4[(C4H9O)3PO]2 Наиболее распространенный ступенчатый экстрактор с механическим перемешиванием – смеситель – отстойник. Аппарат целесообразно применять при большом числе ступеней экстракции, реэкстракции и промывки, больших соотношениях потоков фаз (10-20:1). Они устойчиво работают даже при небольшом количестве твердых взвесей в фазах. Водная фаза засасывается снизу в турбину в смесительную камеру, в которую поступает органическая фаза. Так как равновесие между фазами устанавливается быстро (1-3 мин), а расслаивание за счет разности плотностей идет медленно (5 -15 мин), объем отстойника в 3 – 5 раз превышает объем смесительной камеры. Смеситель-отстойник ящичного типа с перемешиванием. Расчет основных размеров: Исходные данные: Число реальных ступеней n = 6-15 Расход легкой фазы QЛ = 250м3/сут; Расход тяжелой фазы QТ = 250м3/сут; (QЛ и QТ выбирают из баланса или задают в соответствии со значением 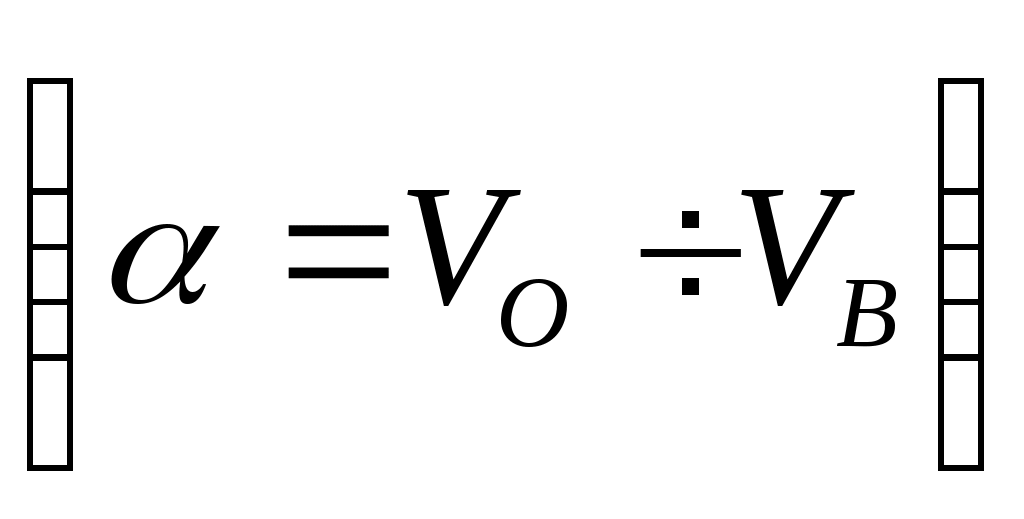 ); );Вязкость смеси фаз Плотность легкой фазы Плотность тяжелой фазы Длительность смешивания Длительность расслаивания 1. Объем смесительной камеры Принимаем VСМ = 1м3 (коэффиц иент заполнения 0,88). 2. Объем отстойной камеры Принимаем VОТ = 4м3 (коэффициент заполнения 0,88). 3. Объем аппарата из 6 ступеней V=(VСМ + VОТ) n = 30м3. (8.3) 4. Соотношение смесительной камеры принимаем l:b:h = 1:1:1.5 Тогда при VСМ = 1м3 l:b:h = 0,88:0,88:1,3м 5. Соотношение размеров отстойной камеры принимаем: L:B:H = 2.8:1:2; Тогда при VОТ = 4м3 L:B:H = 2,55:0,88:1,76м. Расчет мощности двигателя для вращения турбин. Критерий Рейнольдса где, n- число оборотов турбинки; d – диаметр турбинки; d = 0,3 l = 0.3 0.88 = 0.3m Обычно n=100-300 об/мин; принимаем n = 250 об/мин или n = 4,17с-1. Тогда 2. Критерий Эйлера: 1. Рабочая мощность одной турбинки 2. Мощность двигателя, приводящего во вращение 6 турбинок, с учетом двухкратного запаса на момент пуска и к.п.д. передачи ( NДВИГ = II. Смеситель – отстойник ящичного типа с пневматическим перемешиванием. Такие аппараты используют тогда, когда мешалки нельзя ставить из - за агрессивности среды. Жидкости движутся за счет перепада давлений между секциями. 1. Объем смесительной и отстойной камер определяют так же, как и в предыдущем случае. 2. Высота налива ННАЛ – уровень жидкости в отстойной камере связана с Vот и площадью отстойной камеры соотношением 3. Обычно соотношение сторон смесительной камеры принимается 1:1. С точки зрения энергозатрат оптимальным является 1,5 4. Длина отстойной камеры 5. Длина предкамеры 6. Тогда общая длина одной ячейки 7. Общая высота НОБЩ находится из соотношения ННАЛ = 0,8 НОБЩ. (8.12) Задание: Произвести расчет основных показателей смеситель-отстойник ящичного типа. Таблица 13.
Практическая работа №6. РАСЧЕТ ТРЕБУЕМОГО КОЛИЧЕСТВА ХИМИЧЕСКИХ РЕАГЕНТОВ В ПРОЦЕССЕ ДЕСОРБЦИИ УРАНА Цель работы: Цель работы: Ознакомление студента с расчетами технологического отстойника продуктивных растворов. В основе регенерации ионообменных материалов лежит химическая реакция обмена вытесняющих ионов и ионов, химически связанных с функциональными группами смолы. Поэтому во всех случаях, за исключением процесса десорбции, т.е. удаление необменно поглощенных ионитом веществ за счет физической адсорбции, имеет место химическая реакция с обязательным присутствием вытесняющих ионов. Эти ионы могут быть введены в процесс с различными химическими реагентами (азотной кислотой или серная кислота, аммиачная селитра и аммиачная вода). Такой тип регенерации называется реагентной регенерацией. Химическая регенерация занимает основное место в ионообменной регенерации. Она позволяет получить любую необходимую степень регенерации, провести процесс регенерации в требуемом временном диапазоне, довести концентрацию извлекаемого иона в регенерате до нужного уровня. Вещество, применяемое для десорбции урана, называется десорбентом, раствор, в который перешел уран из молекул ионита – десорбатом. По типу применяемого десорбента различают сернокислотную и нитратную десорбцию. При сернокислотной десорбции реакция описывается уравнением: (R4 N)4 [UO2 (SO4)3]4- + 2 SO4 2- → 2(R4 N)4SO4 2- + [UO2(SO4)3]4- Обычно десорбцию проводят раствором серной кислоты 15- % концентрации. Нитратный способ также относится к классу вытеснительных способов десорбции. В отличие от сернокислотного способа, после окончания десорбции урана нитратами требуется перевод анионита в рабочую ионную форму. Химизм десорбции урана описывается следующими уравнениями реакций: (R4N)2 [UO2(SO4)2] + 2NO3- → 2R4N – NO3 + [UO2(SO4)2]2- (R4N)4 [UO2(SO4)3] + 4NO3- → 4R4N - NO3 + [UO2(SO4)3]4-. Минимальный расход элюента (исходного раствора) достигается обычно при некоторой оптимальной концентрации. Расчет требуемого количества химических реагентов в процессе десорбции урана: расхода азотной или серной кислоты, аммиачной селитры и аммиачной воды. ХАРАКТЕРИСТИКА ТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА 1. Состав десорбирующего раствора: концентрация HNO3 – 30-50г/л; концентрация NO3 - 70-110 г/л; емкости смолы 35-45 кг/т по урану. 2. Объемное соотношение на регенерации смолы к раствору (десорбатом): Vсм х Vр-р = 1: 2. 3. Количество маточников фильтрации равное количеству товарного регенерата, подаваемого на осаждение- 50-100л. 4. Количество маточников фильтрации, направляемых для пассивации (снижения активности сернокислых растворов на денитрации)- 25-50л. 5. Содержание нитратов в маточниках фильтрации-10-25г/л. 6. Объемное соотношение на денитрации смолы к раствору: Vсм: Vр-р = 1: 0,9. 7.Концентрация урана в регенерате составляет 5-20 г/л. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
