Ещё про холеру. Еще про холеру. Методические указания методы контроля. Биологические и микробиологические факторы
 Скачать 1.24 Mb. Скачать 1.24 Mb.
|
|
5.4. Учет анализов, оформление направлений и выдача результатов Ответ о положительном результате может быть предварительным и окончательным. Предварительный положительный ответ выдают по результатам ускоренного исследования нативного материала и после подращивания его в пептонной воде с помощью иммунофлюоресцентного метода, специфической иммобилизации, РНГА, а также по слайд-агглютинации сыворотками О1 и О139 подозрительных на холерный вибрион колоний. При наличии возможности на этом этапе может быть использована ПЦР со специфическими праймерами. Предварительный ответ, в случаях проведения срочных анализов, сообщают устно и только при совпадении результатов не менее двух методов. В условиях эпидемии холеры при проведении массовых исследований после идентификации первых культур такой ответ дает право на проведение противоэпидемических мероприятий. Окончательный положительный ответ выдают по результатам сокращенной или полной идентификации выделенной культуры в течение 36-48 ч. При проведении массовых исследований в очаге заболеваний холерой, когда первые культуры холерных вибрионов уже были идентифицированы по полной схеме, положительные результаты тестирования в слайд-агглютинации с холерными сыворотками О1 или 0139 серогрупп в сочетании с морфологией и подвижностью клеток культур, выделенных от больных диареями или при обследовании на вибриононосительство, следует считать окончательными для решения вопросов о проведении противоэпидемических мероприятий. Достоверность таких результатов повышается при использовании ускоренных методов диагностики: иммунофлюоресцентного, иммобилизации соответствующими сыворотками, ПЦР и др. Для полной идентификации выделенные культуры передают в назначенную для этих целей группу или лабораторию, специалисты которой при необходимости вносят в ответ соответствующие коррективы и дополнения, касающиеся определения антибиотикограммы, эпидемической значимости и токсигенности. Отрицательный ответ может быть дан только по окончании исследования по полной схеме через 36-48 ч; при осуществлении эпиднадзора в условиях односменной работы лаборатории, допускающей использование теллурита калия, продолжительность анализа увеличивается до 3-4 суток. Не допускается выдавать отрицательные ответы по результатам ускоренного исследования (МФА, РИВ, РНГА, и др.) до окончания анализа как в условиях эпидемии холеры, так и при проведении эпидемиологического надзора. Схему выдачи ответов см. на рис.3. 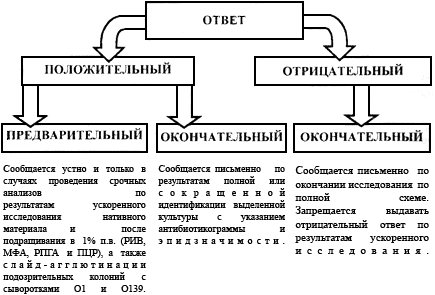 Рис.3. Схема выдачи результатов исследований на холеру При осуществлении эпидемиологического надзора направление к анализу, а соответственно и ответ на него, оформляют индивидуально на каждого больного. При проведении большого объема исследований в очаге холеры направления к анализам и ответы на них оформляют списком. При обследовании здоровых людей на вибриононосительство и исследовании на холеру объектов окружающей среды групповые формы направления и ответов допускаются как при эпиднадзоре, так и в очаге холеры. Учет анализов и культур ведут по установленным формам (прилож.6, 7). Обязательным является ведение рабочих записей идентификации исследования подозрительных культур (прилож.8), регистрация выделенных культур (прилож.9), составление паспорта штамма (прилож.10). При работе в очаге холеры используют упрощенные формы регистрации анализов, учитывая, что более подробные сведения имеются в бланках направлений, находящихся в лаборатории до ликвидации очага. Для удобства работы направления за каждый день подшивают отдельно. 6. Методы изучения свойств холерных вибрионов 6.1. Серологические методы Принадлежность холерных вибрионов к О1 или О139 серогруппе определяют в слайд-агглютинации или развернутой реакции агглютинации с холерными агглютинирующими сыворотками О1, Инаба, Огава, РО и с холерной сывороткой О139 серогруппы в соответствии с инструкциями по применению препаратов, а также в других реакциях с иммуноглобулиновыми препаратами, предназначенными для ускоренной диагностики холеры и идентификации возбудителя. Слайд-агглютинацию ставят на обезжиренном стекле, помещенном в чашку Петри или на дне самой чашки, используя подозрительную на холерный вибрион колонию и (или) агаровую 12-18-часовую культуру и сыворотки О1 серогруппы в разведении 1:50-1:100. Сыворотку О139 разводят в соответствии с указанием на этикетке. Реакцию обязательно сопровождают контролями культуры в 0,9%-м растворе хлорида натрия. Развернутую реакцию агглютинации ставят и учитывают по общепринятой методике в соответствии с инструкцией по применению диагностических сывороток. Для исключения спонтанной агглютинации рекомендуется ставить развернутую реакцию в 0,3%-м растворе NaCl. Диагностические сыворотки двукратно разводят 0,3%-м раствором натрия хлорида в объеме 0,5 мл соответственно величине диагностического титра. Суспензию изучаемой культуры готовят в этом же растворе концентрацией 3х10 Флюоресцентно-серологический метод (МФА - метод флюоресцирующих антител) Метод дает возможность ускоренно идентифицировать выделенную культуру, а также выявить возбудителя холеры О1 и О139 серогрупп при содержании его в исследуемом материале не менее чем 10 Порядок приготовления мазков, обработка их флюоресцирующими иммуноглобулинами, микроскопия и оценка результатов, являющиеся общими для всех бактерий, описаны в "Наставлениях по применению иммуноглобулинов диагностических флюоресцирующих холерных адсорбированных лошадиных сухих". Положительный результат может быть получен через 1,5-2,0 ч от начала исследования. При просмотре мазков, обработанных иммуноглобулином холерным флюоресцирующим, особое внимание следует обращать на морфологию светящихся микробов, т.к. в отдельных случаях в мазках из испражнений здоровых людей может наблюдаться свечение микроорганизмов, отличающихся по морфологии от вибрионов (грубые крупные палочки, кокки). Для устранения неспецифического свечения целесообразно использовать в качестве "гасителя" бычий альбумин, меченый родамином. Методика его использования описана в "Инструкции по применению альбумина бычьего, меченого родамином, сухого". Реакция иммобилизации вибрионов под влиянием специфических холерных сывороток О1 и О139 серогрупп (РИВ) Метод дает возможность обнаружить возбудителя в течение нескольких минут при концентрации его в исследуемом материале не менее 10 При наличии в исследуемом образце холерных вибрионов в первой капле наблюдают характерную подвижность, во второй - иммобилизацию отдельных микробных клеток и образование неподвижных микроагглютинатов немедленно или в течение 1-2 мин. В случае неспецифического взаимодействия с диагностическими сыворотками наблюдается образование мелких подвижных конгломератов при активной подвижности отдельных клеток. Реакция иммобилизации специфична и позволяет дать первый сигнальный ответ через 15-20 мин от начала исследования нативного материала. При отрицательном результате исследование повторяют после подращивания в 1%-й пептонной воде. В случае отрицательного результата необходимо провести аналогичное исследование с холерной сывороткой О139 серогруппы, которую разводят 1:5. Реакция непрямой гемагглютинации (РНГА) с использованием диагностикума эритроцитарного холерного иммуноглобулинового Порядок подготовки материала, ингредиентов, постановки реакции и ее учет изложены в "Инструкции по применению диагностикума эритроцитарного холерного антительного иммуноглобулинового", прилагаемой к препарату. 6.2. Биохимические свойства Биохимическую активность холерного вибриона изучают, используя коммерческие среды и тест-наборы или среды лабораторного приготовления, рецептура которых изложена в разделе 7. Определение индофенолоксидазы а) С помощью реактивов. Реактивы: 1%-е водные растворы диметил-пара-фенилендиамина, тетраметил-пара-фенилендиамина (гидрохлорида), этилоксиэтил-пара-фенилендиамина серно-кислого (из набора для обработки бумаги "фотоцвет") и пара-аминодиметиланилина (гидрохлорида или оксалата) в сочетании с 1%-м спиртовым раствором Реактивы должны быть бесцветными, их следует хранить во флаконах из темно-коричневого стекла со стеклянной пробкой без доступа света в холодильнике. В случае помещения реактива во флаконы из светлого стекла их следует обернуть алюминиевой фольгой или темной бумагой. Постановка пробы: на поверхность 18-часовой агаровой культуры, подозрительной колонии или полусливного роста на щелочном агаре наносят 1 каплю 1%-го водного раствора одного из указанных реактивов. Положительная реакция на индофенолоксидазу - ярко красная окраска культуры через 20-30 с. При использовании двухкомпонентной реакции (в сочетании с б) Для постановки пробы на оксидазу можно использовать тест-систему ОКСИ-тест или специальные бумажки из набора СИБ, MTC-V или пропитать помещенную в чашку Петри полоску фильтровальной бумаги 2-3 каплями 1%-го водного раствора одного из реактивов. Культуру наносят на полоску смоченной реактивом бумаги платиновой петлей (но не хромникелевой), стеклянной или деревянной палочкой и размазывают в виде небольшого пятнышка. Через 10-30 с появляется пурпурно-красное окрашивание, свидетельствующее о положительной реакции. Из грамотрицательных бактерий положительную пробу на индофенолоксидазу дают вибрионы, аэромонады, псевдомонады, плезиомонады, а отрицательную - все энтеробактерии. Не следует ставить пробу на оксидазу с культурами на полиуглеводных средах, а также с колониями на элективных средах (СЭДХ и TCBS). Учитывая возможную нестойкость реактивов и различную способность вибрионов к образованию оксидазы на различных питательных средах, пробу обязательно сопровождают положительными и отрицательными контролями соответственно с культурами вибрионов или псевдомонад и энтеробактерий, выращенными на используемом в лаборатории питательном агаре. Определение типа расщепления глюкозы (тест Хью-Лейфсона) В две пробирки со средой Хью-Лейфсона засевают уколом в столбик изучаемую культуру. Поверхность среды в одной из пробирок покрывают 0,5-1,0 мл стерильного вазелинового масла. Посевы инкубируют от 1 до 4 суток при температуре (37,0±0,5) °С. Окисление определяют по желтой окраске среды только в аэробных, ферментацию - в аэробных и анаэробных условиях роста. Вибрионы расщепляют глюкозу по ферментативному типу. Определение декарбоксилазной и дигидролазной активности В пробирки со средами, содержащими лизин, орнитин, аргинин и контрольную среду без аминокислот, засевают по полной петле 18-часовой культуры и заливают 0,5-1,0 мл стерильного вазелинового масла. Инкубируют посевы при температуре (37,0±0,5) °С. Учет результатов ведется ежедневно, при сомнительном результате - наблюдение до 4 суток. В результате ферментации глюкозы вначале происходит сдвиг рН в кислую сторону, а в дальнейшем при гидролизе аминокислот накапливаются амины, и происходит защелачивание среды. Ферментацию углеводов и многоатомных спиртов (глюкоза, лактоза, манноза, сахароза, арабиноза, маннит, салицин, дульцит, инозит, крахмал и др.) определяют в жидких или полужидких средах Гисса с индикатором бромтимоловым синим, Андреде, ВР. Для посева используют культуру, выращенную в течение 12-20 ч на плотной питательной среде или в течение 3-4 ч - в жидкой питательной среде. Посевы на средах с углеводами и спиртами инкубируют при (37,0±0,5) °С и учитывают через 6-18 ч. Для определения диастатической активности кроме среды Гисса с крахмалом может быть использована и среда Кодама. Культуру засевают в среду и также инкубируют при (37,0±0,5) °С. Через 18 ч в пробирку со средой Кодама добавляют 2-3 капли раствора Люголя. При разложении крахмала среда не окрашивается. Определение протеолитических свойств В столбик желатины уколом засевают 18-часовую культуру и инкубируют в течение 2-3 суток при температуре (22±0,5) °С или при (37,0±0,5) °С в течение 18 ч. Перед учетом результатов пробирки помещают в холодильник на 20 мин. При положительном результате желатина остается жидкой, а при отрицательном (и в контрольной пробирке) - затвердевает. Определение образования индола Холерные вибрионы при выращивании в средах, содержащих триптофан (пептонная вода, мясо-пептонный бульон, бульон Хоттингера и др.), расщепляют его с образованием индола, что выявляется с помощью индикаторных бумажек или реактива Эрлиха после инкубирования при температуре (37,0±0,5) °С в течение 18 ч. Определение образования сероводорода Холерные вибрионы не продуцируют фермент тиосульфатредуктазу, т.е. не способны расщеплять неорганические серосодержащие соединения, присутствующие в среде Клиглера и маннозо-сахарозной среде - это является дифференциальным признаком. Однако они так же, как некоторые другие энтеробактерии, продуцируют фермент цистиндесульфогидролазу, за счет которого способны образовывать сероводород из серосодержащих аминокислот, присутствующих в достаточном количестве в бульоне Хоттингера, мясо-пептонном бульоне, но отсутствующих или содержащихся в незначительном количестве в 1%-й пептонной воде. Поэтому для постановки этого теста культуры выращивают в 1%-й пептонной воде при температуре (37,0±0,5) °С в течение 18-20 ч. Образование сероводорода регистрируют с помощью индикаторных бумажек. Использование микротест-систем и СИБ Для определения оксидазы, образования индола и сероводорода, декарбоксилаз лизина, орнитина, дигидролазы аргинина, ферментации углеводов и многоатомных спиртов при идентификации вибрионов можно также использовать Систему индикаторную бумажную (СИБ) и микротест-ситемы для биохимической идентификации вибрионов. 6.3. Выявление способности к биолюминесценции Изучаемые штаммы засевают в 1%-ю пептонную воду или на пластинки щелочного агара, инкубируют при температуре (37,0±0,5) °С в течение 18 ч. Выросшие культуры просматривают в темной комнате. Свечение наблюдают после 5-10-минутной адаптации в темноте. 6.4. Тесты дифференциации биоваров холерных вибрионов О1 Определение чувствительности к диагностическим холерным фагам В лабораторной диагностике холеры используют бактериофаги диагностические холерные классический и эльтор. При оценке результатов проб с фагами необходимо ориентироваться на диагностический рабочий титр (ДРТ), который обычно обозначают на этикетках. Определение чувствительности к фагам проводят как с цельными препаратами, так и с их 10-кратными разведениями до ДРТ в мясо-пептонном бульоне. Дифференциальный рабочий титр не ниже 1х10 Для постановки реакции в чашки разливают щелочной агар. После застывания агара и подсушивания его в течение 30 мин при температуре 37 °С дно чашек делят на квадраты по количеству образцов фагов и 10-кратных разведений фага. В пробирку с 5 мл 0,5-0,7%-го питательного агара, расплавленного и охлажденного до 45 °С, добавляют 0,1-0,2 мл 3-4-часовой бульонной культуры, тщательно смешивают и выливают на поверхность агара. Чашки оставляют при комнатной температуре с приоткрытыми крышками на 30 мин. В центр квадратов наносят штампом-репликатором, стандартной петлей или тонко оттянутой пастеровской пипеткой по капле фагов в соответствующих разведениях. После подсыхания капель чашки переворачивают вверх дном и помещают в термостат при температуре (37,0±0,5) °С. Результаты учитывают через 3-4 и 18-20 ч. Наличие лизиса в виде одного "стерильного" пятна или группы мелких негативных колоний оценивается как положительный результат. |
