Методические указания по общей, неорганической и аналитической химии для студентов и аспирантов технологических и технических специальностей вузов
 Скачать 326.11 Kb. Скачать 326.11 Kb.
|
|
РАСЧЕТЫ РАСТВОРИМОСТИ СОЛЕЙ, ГИДРОКСИДОВ И ОКСИДОВ В ВОДНЫХ СРЕДАХМетодические указания  Санкт-Петербург 2006 Министерство образования и науки Российской ФедерацииФедеральное агентство по образованию САНКТ-ПЕТЕРБУРГСКАЯ ГОСУДАРСТВЕННАЯ ЛЕСОТЕХНИЧЕСКАЯАКАДЕМИЯ  РАСЧЕТЫ РАСТВОРИМОСТИ СОЛЕЙ, ГИДРОКСИДОВ И ОКСИДОВ В ВОДНЫХ СРЕДАХМетодические указания по общей, неорганической и аналитической химии для студентов и аспирантов технологических и технических специальностей вузов Санкт-Петербург2006 Рассмотрены и рекомендованы к изданиюметодической комиссией химико-технологического факультета Санкт-Петербургской государственной лесотехнической академии19 апреля 2006 г. С о с т а в и т е л ьдоктор химических наук, профессор Е.В. Школьников Р е ц е н з е н ткафедра неорганической и аналитической химии СПбГЛТА Методические указания составлены с целью оказать помощь при выполнении расчетов термодинамических параметров растворимости твердых электролитов в воде и водных средах. Обоснование расчетов и 19 примеров решения задач на растворимость неорганических соединений могут быть использованы студентами и аспирантами в учебной и научной работе. 1. РАСТВОРИМОСТЬ ТВЕРДЫХ ЭЛЕКТРОЛИТОВ В ВОДЕ Мерой растворимости вещества при данных условиях является концентрация его насыщенного раствора (моль/л, г/л, массовые и объемные проценты). Коэффициентом растворимости называют число массовых частей безводного вещества, насыщающего при данных условиях 100 массовых частей растворителя. Растворимость различных веществ в воде изменяется в широких пределах. Если в 100 г воды растворяется более 10 г вещества, такое вещество принято называть хорошо растворимым; если растворяется менее 1 г вещества – малорастворимым и если менее 0,01 г вещества – практически нерастворимым. Однако абсолютно нерастворимые вещества не существуют. Растворение электролитов (кислот, оснований, солей) в воде и других полярных растворителях сопровождается диссоциацией растворенного вещества с образованием ионов. Для электролитов не предложено общей теории, предсказывающей растворимость, но известен ряд эмпирических правил. Ионные кристаллы лучше растворяются в полярных растворителях, причем растворимость многих электролитов возрастает пропорционально кубу диэлектрической проницаемости растворителя. Обычно более растворимы твердые электролиты с большей энергией гидратации (сольватации). Чем больше молекул воды в формуле кристаллогидрата, тем эндотермичнее процесс растворения и меньше растворимость [1]. Кроме химического состава и структуры, на растворимость твердых тел в воде влияют другие факторы. Растворение большинства твердых тел сопровождается поглощением энергии (Hs > 0), так как энергия, затраченная на разрушение кристаллической решетки, обычно не полностью компенсируется выделяющейся энергией гидратации. Растворимость таких кристаллов в воде возрастает при нагревании (нитраты калия, серебра и свинца, хлориды аммония и калия, йодид калия, сульфаты калия, свинца и др.) в соответствии с принципом Ле Шателье. Однако существуют твердые электролиты, растворимость которых при нагревании уменьшается, так как Hs < 0, например CaCO3, Ca(OH)2, и такие, растворимость которых при нагревании проходит через максимум (CaSO4 2H2O) [1, 2]. Влияние давления на растворимость твердых электролитов в воде незначительно, так как при их растворении объем системы изменяется мало. Существенное или сильное влияние на водорастворимость твердых электролитов оказывает химический состав водной среды (посторонние сильные электролиты, общие ионы, рН раствора, гидролиз ионов осадка и их комплексообразование) [1–4]. При составлении настоящего методического пособия использованы работы [1–4] и научные публикации автора [5–7]. Значения констант растворимости и ионизации электролитов, а также общих констант устойчивости комплексов взяты из справочника [2]. 2. ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ При равенстве скоростей растворения и осаждения между твердой фазой (осадком) и водным раствором установится гетерогенное химическое равновесие MmAn(т) s ms ns характеризуемое константой равновесия, которую называют произведением растворимости ПР = [Mn+]m [Am–]n = const, (2) или концентрационной (реальной) константой растворимости. Таким образом, в насыщенном растворе малорастворимого электролита произведение молярных концентраций его ионов в степени стехиометрических коэффициентов является постоянной величиной при данной температуре. Из понятия ПР следуют условия образования и растворения осадков (правило ПР). Осадок может образоваться, когда произведение молярных концентраций его ионов (ИПК) достигает или превосходит величину ПР: ИПК = [Mn+]m [Am–]n ПР. (3) Растворение осадка происходит тогда, когда ИПК < ПР. Зная величину ПР или рПР = –lg ПР, можно вычислить растворимость малорастворимого электролита MmAn в чистой воде 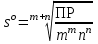 , моль / л (4) , моль / л (4)или Mso (г / л), где М – молярная масса электролита. Равновесные молярности катионов Mn+ и анионов Am– в насыщенном водном растворе будут равны соответственно mso и nso (моль / л). Величина произведения растворимости ПР может быть вычислена по известной растворимости so (г / л) твердого электролита MmAn. Для этого сначала находят молярную величину растворимости so (моль / л) = so (г / л) / М, а затем вычисляют ПР по формуле ПР = (mso)m (nso)n. (5) Приведем примеры расчета so и ПР. Пример 1. Вычислить растворимость (моль / л, г / л) Ва3(РО4)2 в чистой воде, если ПР этой соли при 25С равно 6 10–39. Решение. Для гетерогенного химического равновесия в насыщенном водном растворе Ва3(РО4)2 (к) 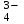 (р) (р)so 3so 2so ПР = [Ba2+]3 [РО 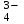 ]2 = (3so)3(2so)2 = 108 (so)5; ]2 = (3so)3(2so)2 = 108 (so)5;откуда находим растворимость so = 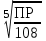 = 8,9 10–9 моль / л, = 8,9 10–9 моль / л,или 5,4 10–6 г / л. Пример 2. Вычислить произведение растворимости карбоната кальция, если его растворимость в чистой воде равна 6,16 10–3 г/л при 25С. Решение. Для равновесия в водном растворе СаСО3 (к)  (р) (р)so so so имеем [Са2+] [СО  ] = (so)2 = ПР. Находим молярную величину растворимости so = 6,16 10–3 / 100 = 6,16 10–5 моль / л, где М = 100 г/моль – молярная масса СаСО3, и вычисляем ПР (СаСО3) = (6,16 10–5)2 = 3,8 10–9. ] = (so)2 = ПР. Находим молярную величину растворимости so = 6,16 10–3 / 100 = 6,16 10–5 моль / л, где М = 100 г/моль – молярная масса СаСО3, и вычисляем ПР (СаСО3) = (6,16 10–5)2 = 3,8 10–9.Пример 3. Может ли образоваться осадок MgF2 (ПР = 6,5 10–9) при смешении 100 мл 0,02 н. раствора MgSO4 и 25 мл 0,01 н. раствора NaF? Ионную силу раствора не учитывать. Решение. Напишем уравнение реакции MgSO4 + 2NaF = MgF2 + Na2SO4 или Mg2+ + 2F– = MgF2 и условие образования осадка MgF2 [Mg2+] [F–]2 ПР (MgF2). Находим молярности ионов после смешения растворов [Mg2+] = 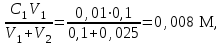 [F–] = 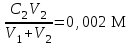 и произведение концентраций ионов [Mg2+] [F–]2 = 3,2 10–8 > ПР (MgF2). Следовательно, осадок MgF2 может образоваться. 3. СПОСОБЫ ВЫРАЖЕНИЯ ПРОИЗВЕДЕНИЯ РАСТВОРИМОСТИ Для гетерогенного равновесия (1) растворения-осаждения малорастворимого твердого электролита MmAn (т) в справочниках обычно указывают термодинамическую константу растворимости К  = ПРт = а = ПРт = а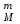 а а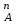 , (6) , (6)где ПРт < 1 – величина, зависящая от температуры, давления, природы растворяемого вещества и растворителя, при ионной силе раствора I = CiZ 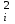 0; aM и аА – равновесные активности ионов Mn+ и Аm– в насыщенном растворе, определяемые произведением молярности иона на его коэффициент активности f, зависящий от величины I и заряда иона Z. 0; aM и аА – равновесные активности ионов Mn+ и Аm– в насыщенном растворе, определяемые произведением молярности иона на его коэффициент активности f, зависящий от величины I и заряда иона Z.Константа растворимости, определяемая выражением (2) через равновесные молярности ионов, называется реальным произведением растворимости ПРр[3]. В отличие от ПРт величина ПРр учитывает электростатическое взаимодействие ионов и зависит от ионной силы раствора. Термодинамическое и реальное произведения растворимости связаны соотношением ПРр = [Mn+]m [Am–]n = 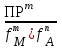 > ПРт . (7) > ПРт . (7)Если ионы осадка в растворе вступают в конкурирующие реакции (кислотно-основные, комплексообразования), то равновесие между осадком и раствором характеризуется условным произведением растворимости ПРу = С 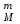 С С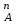 = = 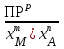 > ПРр , (8) > ПРр , (8)выраженным через общие молярности CМ и СА, учитывающие соответственно свободные ионы Mn+ и их комплексы, свободные анионы Am– и их протонированные формы. В выражении (8) xМ и xA определяют мольные (молярные) доли свободных катионов Mn+ и анионов Am–. Величина ПРу зависит от условий протекания конкурирующих реакций и является константой только при постоянстве этих условий (I, pH, T). Располагая величинами ПРт, ПРр и ПРу, можно вычислить молярную растворимость твердого соединения MmAn в заданных условиях по формуле (4) с использованием соответствующего ПР. Численная величина ПРт зависит от способа стандартизации активностей ионов и растворителя (воды). Для водных и водно-органических растворов принята стандартизация, согласно которой в предельно разбавленном растворе для ионов растворенного вещества lim fi = 1, (9) xw 1 а для воды lim aw = 1. xw 1 Значения ПР неразрывно связаны с выбранным видом гетерогенного равновесия реакции растворения – осаждения в термодинамической форме (с указанием агрегатного и фазового состояния). Разность уравнений любых двух реакций растворения одного и того же соединения, например: М (ОН)2 (т) М (ОН)2 (т) – это уравнение гомогенной реакции, характеризующей равновесие между продуктами растворения, а именно М2+ (р) + ОН– (р) Если гетерогенное равновесие устанавливается достаточно быстро, то не существует обоснованных доводов в пользу правильности одного вида уравнения реакции растворения (I) и неправильности другого (II). Расчет ПР для одного вида реакции растворения по известному ПР для другого вида осуществляется с помощью константы гомогенного равновесия между продуктами растворения. В нашем примере  , ПР (II) = [MOH+] [OH–] = ПР (I) MOH+, где MOH+ – константа устойчивости комплекса МОН+. Распространено мнение в учебной литературе, что понятие ПР пригодно только для малорастворимых электролитов, т.е. когда ПР < 1, хотя на свободную энергию растворения G  , связанную с ПРт взаимно однозначным соотношением , связанную с ПРт взаимно однозначным соотношением G  = –RT ln ПРт , (10) = –RT ln ПРт , (10)это ограничение не накладывается. При корректном учете неидеальности растворов понятие ПР можно использовать и для хорошо растворимых веществ, когда ПР > 1 [1]. 4. РАСТВОРИМОСТЬ ОСАДКОВ В ПРИСУТСТВИИ ОБЩИХ ИОНОВ В чистой воде равновесные концентрации катиона и аниона определяются молярной величиной растворимости соединения MmAn (т) и стехиометрией равновесия (1): [M] = mso и [A] = nso. Если в насыщенный раствор введено избыточное количество осадителя, например аниона с концентрацией СА, то равновесие сместится в сторону образования осадка и новые равновесные концентрации ионов будут равны [M] = ms и [A] = ns + С. Подставляя эти значения в выражение константы (2) ПР = (ms)m (ns + CA)n, (11) можно вычислить растворимость осадка MmAn по известным величинам ПР и СА. Если СА >> ns, то выражение (11) упрощается: ПР = (ms)m С 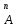 (12) (12)и 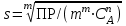 . (13) . (13)Уравнения (11) – (13) позволяют рассчитать растворимость осадка в присутствии избытка осадителя или вычислить необходимую избыточную концентрацию осадителя, обеспечивающую требуемое значение растворимости осадка. При увеличении избыточной концентрации осадителя без комплексообразования растворимость осадка значительно или сильно уменьшается. Это используют в аналитической химии для понижения потерь осадка вследствие растворения при его промывании. Пример 4. Как изменится при 25С молярная растворимость Ва3(РО4)2 при добавлении 0,01 моль Na3PO4 к 1 литру насыщенного водного раствора? Ионную силу раствора не учитывать. Решение. После добавления сильного электролита Na3PO4 равновесие Ва3(РО4)2 (к) 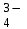 (р) (р)s 3s 2s + 0,01 0,01 М сместится влево с увеличением массы осадка и уменьшением концентрации Ва2+ в растворе: ПР = (3s)3 0,012 = 2,7 10–3s3 = 6 10–39, 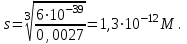 Уменьшение растворимости по сравнению с чистой водой (см. пример 1) составит so / s = 6,9 103. Гораздо сильнее растворимость фосфата бария понизится (в 2,3 108 раз) при добавлении 0,01 моль ВаCl2 к 1 л насыщенного раствора фосфата бария в чистой воде. |
