Методические указания по общей, неорганической и аналитической химии для студентов и аспирантов технологических и технических специальностей вузов
 Скачать 326.11 Kb. Скачать 326.11 Kb.
|
Расчет растворимости проводится по формулеs = 0,5 [PO 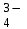 ] = ] = 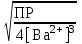 = 3,9 10–17 М. = 3,9 10–17 М.Правило ПР позволяет предсказать, что для малорастворимого соединения несимметричного типа избыток общего иона с меньшим зарядом (Ва2+) вызывает более резкое уменьшение растворимости соединения (Ва3(РО4)2), нежели избыток другого иона (PO 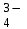 ). Это используется в химическом анализе для выбора и расчета условий практически полного осаждения (С 10–6 М) определяемого иона. ). Это используется в химическом анализе для выбора и расчета условий практически полного осаждения (С 10–6 М) определяемого иона.5. РАСТВОРИМОСТЬ ОСАДКОВ С УЧЕТОМ ВЛИЯНИЯ ИОННОЙ СИЛЫ РАСТВОРА При более точных расчетах растворимости следует учитывать ионную силу раствора (I 5 10–4 M) и использовать уравнение (7) для определения ПРр при отсутствии конкурирующих реакций протонирования и комплексообразования ионов осадка. В присутствии сильного растворимого электролита, не имеющего общих ионов с осадком, увеличивается ионная сила раствора, уменьшаются (при I < 0,1 М) коэффициенты активности ионов осадка, реальное ПРр превышает справочную величину ПРт в соответствии с уравнением (7) и, как следствие, заметно увеличивается растворимость осадка по сравнению с чистой водой (солевой эффект). В присутствии сильного электролита, имеющего общий ион с осадком, незначительный солевой эффект компенсируется более сильным отрицательным влиянием общих ионов на растворимость осадка, в результате чего s < so и с учетом положительного солевого эффекта. Пример 5. Вычислить растворимость CaSO4 (к) в его насыщенном водном растворе с учетом влияния ионной силы раствора, если при 25С ПРт (CaSO4) = 2,5 10–5. Решение. Сначала оценим растворимость осадка без учета солевого эффекта: CaSO4 (к) 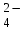 (р), (р),s s s so = 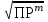 = 5,0 10–3 М. = 5,0 10–3 М.Расчет ионной силы раствора по формуле I = (0,005 22 + 0,005 22) / 2 = = 0,02 М позволяет затем найти величину коэффициента активности двухзарядного иона из справочных таблиц или вычислить по уравнению Дебая-Хюккеля lg fi = –0,51 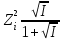 при I 0,1. (14) при I 0,1. (14)Расчет дает f (Ca2+) = f(SO 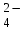 ) = 0,56, ПРр = ПРт / f ) = 0,56, ПРр = ПРт / f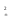 = 8,0 10–5 и s1 = = 8,9 10–3 М, что в 1,8 раза больше значения so, вычисленного без учета ионной силы раствора. = 8,0 10–5 и s1 = = 8,9 10–3 М, что в 1,8 раза больше значения so, вычисленного без учета ионной силы раствора.Таким образом, при ПРт > 10–6 при расчете растворимости осадков следует учитывать солевой эффект. Пример 6. Решить задачу в примере 4 с учетом ионной силы раствора. Решение. Ионную силу раствора вычисляем с учетом ионов добавленного сильного электролита Na3PO4 3Na+ + PO 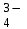 по формуле I = 1/2 (0,03 12 + 0,01 32) = 0,06 М, а коэффициенты активности ионов Ва2+ и PO 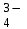 по уравнению (14): по уравнению (14):f (Ba2+) = 0,65, f (PO 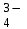 ) = 0,38. ) = 0,38.Тогда реальное произведение растворимости ПРр = ПРт / (f 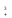 f f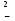 ) = ) == 1,5 10–37 = (3s1)3 0,012, а уточненная растворимость s1 составит 3,8 10–12 М, что в 3 раза превышает значение s, найденное в примере 4 без учета солевого эффекта.  6. ВЛИЯНИЕ КОНКУРИРУЮЩИХ РАВНОВЕСИЙ ПРОТОНИРОВАНИЯ И КОМПЛЕКСООБРАЗОВАНИЯ НА РАСТВОРИМОСТЬ ОСАДКОВ В реальных условиях на равновесие растворения-осаждения могут оказывать существенное или сильное влияние конкурирующие равновесия протонирования и комплексообразования. В результате связывания ионов малорастворимого соединения в виде недиссоциированных форм слабого электролита (кислоты, основания, комплексов) растворимость осадков возрастает. 6.1. Влияние рН кислой водной среды Если малорастворимое соединение (соль, гидроксид) содержит ионы с выраженными протолитическими свойствами, его растворимость зависит от водородного показателя (рН) кислой водной среды. Растворимость солей, образованных анионами сильных кислот, возрастает несущественно при понижении рН среды от 7 до 1 благодаря солевому эффекту. Растворимость кристаллических галогенидов серебра и таллия (I) в воде и кислотах-неокислителях возрастает с увеличением степени ионности галогенидов (15 70%) в ряду I Br Cl F [5]. Для расчета условного произведения растворимости по уравнению (8) необходимые значения мольной доли xA свободных анионов An– слабой кислоты HnA определяют по обобщенному уравнению хA = 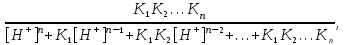 (15) (15)где К1, К2,…Кn – ступенчатые константы диссоциации слабой кислоты. Для гетерогенного равновесия в кислоте-неокислителе MАn(т) + nH+ (p) термодинамическая константа которого равна К = К  , МАn / К , МАn / К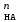 , кислотостойкость солей МАn (A– – F–, CN–, OCN–, NO , кислотостойкость солей МАn (A– – F–, CN–, OCN–, NO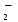 , N , N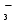 и др.) рассчитывается по уравнению и др.) рассчитывается по уравнениюsn+1 = 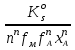 (16) (16)с использованием выражения xA– = 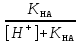 , (15,а) , (15,а)а при рН < 3, когда [H+] > KHA, по приближенной формуле sn+1 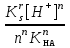 , (17) , (17)где 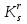 – реальная константа растворимости соли МАn . – реальная константа растворимости соли МАn .Пример 7. Вычислить растворимость (моль / л, г / л) кристалла фторида лантана (мембраны фторид-селективного электрода) в чистой воде и в кислоте-неокислителе при рН = 1, если KHF = 6,2 10–4, рК  (LaF3) = (LaF3) == 18,40 при 25С [5]. Решение. Для гетерогенного равновесия в чистой воде LaF3 (к) so so 3so растворимость so находим по формуле (4): so = 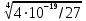 = 1,1 10–5 моль / л, или после умножения на молярную массу LаF3 so = 2,2 10–3 г / л. В сильной кислоте (HCl, HClO4) при рН = 1 ионная сила раствора равна 0,1 М, f(La3+) = 0,18 и f (F–) = 0,755 [2], реальное произведение растворимости составит 5,2 10–18 (см. формулу 7). = 1,1 10–5 моль / л, или после умножения на молярную массу LаF3 so = 2,2 10–3 г / л. В сильной кислоте (HCl, HClO4) при рН = 1 ионная сила раствора равна 0,1 М, f(La3+) = 0,18 и f (F–) = 0,755 [2], реальное произведение растворимости составит 5,2 10–18 (см. формулу 7).В условиях кислой среды LaF3 (к) + 3H+ (p) при рH = 1, когда [H+] > KHF, растворимость LаF3 вычисляем по формуле (17): s = 9,5 10–4 моль / л, или 0,18 г / л. Полученный результат указывает на невозможность длительного использования мембраны LаF3 в сильнокислой среде. |
