Кк. 4 курс КОНТРОЛЬ 1И 2 .Лабораторная работа. Методические указания по выполнению лабораторных работ, учебные фармакопейных статьи гф 13, а также варианты индивидуальных заданий для студентов
 Скачать 4.45 Mb. Скачать 4.45 Mb.
|
|
Тема занятия: Контроль качества неорганических лекарственных средств элементов VI группы периодической системы Д.И. Менделеева. Соединения кислорода с водородом. Сера и ее соединения. Цель занятий : 1.Провести анализ готовых лекарственных форм: раствор перекиси водорода 3 %, раствора для инъекций 30 % натрия тиосульфат. 2. Проанализировать формы выпуска, серию, срок годности, указать производителя лекарственной формы. Применение. Иследуемые препараты: Раствор перекиси водорода 3 %, 30% р-р., Натрия тиосульфат. 1.РАСТВОР ПЕРЕКИСИ ВОДОРОДА. SOLUTIO HYDROGENII PEROXYDI DULITA   ФС.2.2.0005.15 Водорода пероксид Н2О2 М.м. 34,01 Подтверждение подлинности. Определение окислительной способности Реакция с раствором бихромата калия Реактивы, оборудование Раствор перекиси водорода 20 мл Цилиндр вместимостью 250 мл Серная кислота, разведенная 1 » с притертой пробкой 1 шт Петролейный эфир 50 » Цилиндр вместимостью 100 » 1 » Бихромат калия, 5 % раствор 1 » Пипетка вместимостью 3 » с грушей 1 Пипетка глазная 1 » В цилиндр с притертой пробкой помещают 20 мл раствора перекиси водорода, добавляют 1 мл разведенной серной кислоты, 10 мл дистиллированной воды и перемешивают. Затем вливают 50 мл эфира и 5 капель раствора бихромата калия. Водный слой окрашивается в темно-синий цвет. Цилинд закрывают и несколько раз встряхивают. После разделения слоев наблюдают окрашивание эфирного слоя в синий цвет. Демонстрируют на белом экране или в проходящем свете. Подтверждекние доброкачественности. 1.Около 1,0 г (точная навеска) субстанции (точная навеска) помещают в мерную колбу вместимостью 100 мл, доводят объем раствора водой до метки и перемешивают. К 10,0 мл полученного раствора прибавляют 5 мл серной кислоты разведенной 16 % и титруют 0,02 М раствором калия перманганата до слабо розового окрашивания. 2.Параллельно проводят контрольный опыт. 1 мл 0,02 М раствора калия перманганата соответствует 1,701 мг Н2О2. 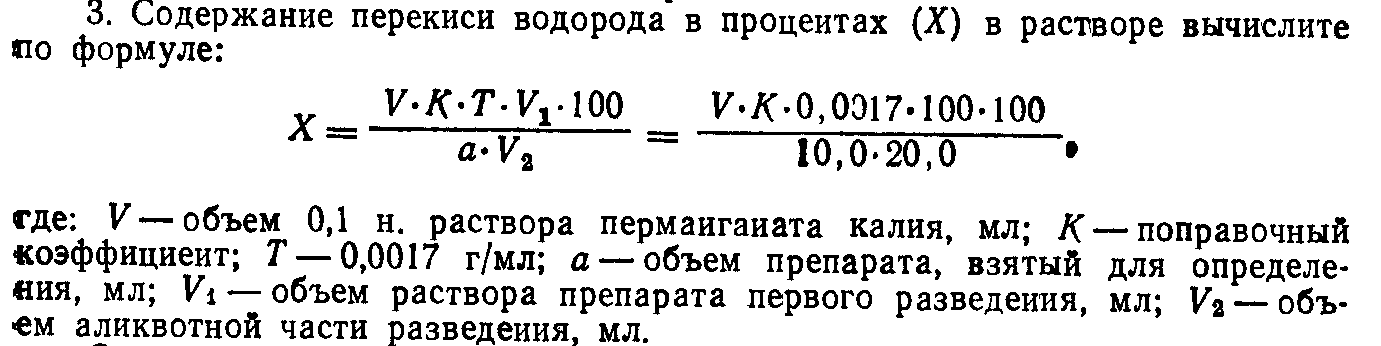 ОФОРМИТЬ В ТЕТРАДЬ ПРОТОКОЛ ИСПЫТАНИЯ ПРИЛОЖЕНИЕ 1. 2. НАТРИЯ ТИОСУЛЬФАТ. NATRII THIOSULFAS 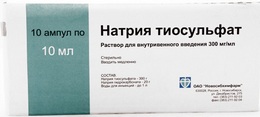 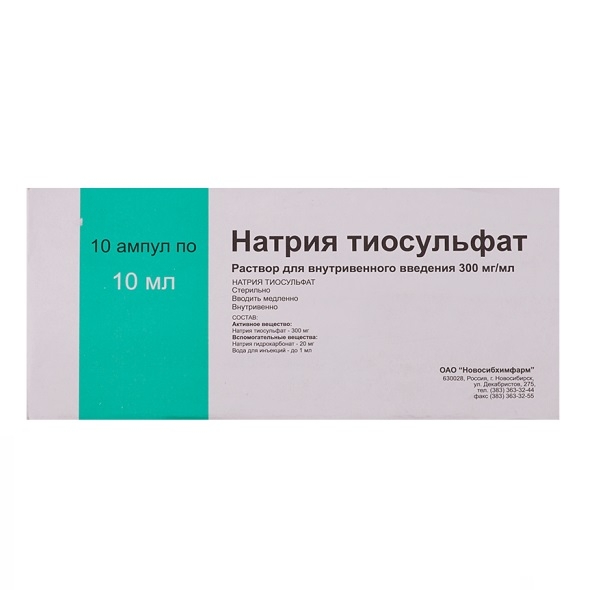 ГФ Х,ст.442. Na2S2O3*5H2O М.м. 248,17 Подтверждение подлинности. 1.Обнаружение иона S2O32- Реакция с соляной кислотой [Na2S2O3 + 2H2O → 2NaCl + SO↑ + S↓ + H2O Реактивы, оборудование Натрия тиосульфат, 30 % раствор 25 мл Цилиндр вместимостью 500 мл 1 шт Соляной кислоты 10 » » » 25 » 1 » » » 10 » 1 » Помещают 25 мл раствора нитрата тиосульфата в цилиндр вместимостью 500 мл, разбавляют дистиллированной водой до 250 мл и постепенно приливают 10 мл соляной кислоты. Выпадает осадок желтоватого цвета. Демонстрируют на черном или белом экране.  Реакция с раствором нитрата серебра Na2S2O3 + 2AgNO3 → Ag2S2O3↓ + 2NaNO3 Ag2S2O3 → Ag2SO2 + S↓ Ag2SO3 + S + H2O → Ag2S↓ + H2SO4 Реактивы, оборудование Натрия тиосульфат, 30% раствор 7 мл Цилиндр вместимостью 500 мл 1 шт Нитрат серебра, 2 % раствор 100 » » » 100 » 1 » » » 10 » 1 » Помещают 100 мл нитрата серебра в цилиндр вместимостью 500 мл, разбавляют дистиллированной водой до 300 мл и перемешивают. Постепенно прибавляют 7 мл раствора натрия тиосульфата. Тотчас же выпадает обильный осадок, цвет которого быстро переходит из белого в желтый, бурый и, наконец, в церный. Подтверждекние доброкачественности. 1.10 мл препарата пипеткой переносят в мерную колбу емкостью 250 мл, доводят объем раствора свежепрокипяченной и охлажденной водой до метки. 25 мл полученного раствора титруют 0,1 н. раствором йода (индикатор - крахмал). 2.1 мл 0,1 н. раствора йода соответствует 0,02482 г Na2S203 * 5H20, которого в 1 мл препарата должно быть 0,291-0,309 г.  Контрольные вопросы и задания . 1. Укажите предпосылки применения перекисных соединений в медицине. Приведите известные Вам препараты водорода пероксида. 2. Приведите химические свойства водорода пероксида с указанием их использования в анализе качества его препаратов. 3. Приведите химические основы стабилизации растворов водорода пероксида и условия их хранения. 4. Приведите физические и химические свойства натрия тиосульфата и их использование в анализе качества данного лекарственного вещества (подлинность, чистота, количественное определение). 5.Условия стабилизации растворов натрия тиосульфата для инъекций. Хранение. 6. На каких свойствах натрия тиосульфата основано его использование в качестве противоядия при отравлении тяжелыми металлами и при чесотке. ОФОРМИТЬ В ТЕТРАДЬ ПРОТОКОЛ ИСПЫТАНИЯ ПРИЛОЖЕНИЕ 1. Лабораторная работа № 3 Тема занятия :Контроль качества неорганических лекарственных средств элементов II и I группы периодической системы Д.И. Менделеева. Соединения магния ,кальция. Цель занятий : 1.Провести анализ готовых лекарственных форм: раствор для инъекций 25 % магния сульфата, порошок магния сульфата; раствора для инъекций 10 % кальция хлорида; раствор натрия гидрокарбоната, препарат «Бикарбон», таблетки от кашля. 2. Проанализировать формы выпуска, серию, срок годности, указать производителя лекарственной формы. Применение. 3. Установить подлинность препаратов магния на выбор. 1.МАГНИЯ СУЛЬФАТ. MAGNESII SULFAS    ФС.2.2.0010.15 Магния сульфат Магния сульфат Взамен ГФ Х, ст. 383; Magnesii sulfas взамен ГФ XII, ч.1, ФС 42-0253-07 MgSO4*7H2O М.м. 246, 47 Подтверждение подлинности. 1.Обнаружения иона Mg2+ Реакция с растворм моногидрофосфата натрия Реактивы, оборудование Магния сульфат, 25 % раствор 1 мл Цилиндр Хлорид аммония, 10 % раствор 1 » » 50 » 1 » Моногидрофосфат натрия, 5% раствор 2 » » 10 » 2 » Аммиак, 10 % раствор 2 » » 5 » 1 » Помещают 1 мл раствора магния сульфата в цилинд вместимостью 50 мл, разбавляют дистиллированной водой до 50 мл, перемешивают, последовательно приливают 1 мл раствора хлорида аммония, 2 мл раствора аммика и 2 мл раствора моногидрофосфата натрия. Выпадает белый осадок. Демонстрируют на черной экране.  2.Обнаружение иона SO42- Реакция с раствором хлорида бария Реактивы, оборудование. Магния сульфат,2 5 % раствор 5 мл Цилиндр Хлорид бария, 5 % раствор 2 » » 100 » 1 » Соляная кислота 2 » 50 » 1 » 10 « 2 » Пипетка местимостью 5 мл с грушей « 2 » Помещают 5 мл раствора магния сульфата в цилиндр вместимостью 50 мл, подкисляют 2 мл соляной кислоты, разбовляют дистиллированной водой до 50 мл, перемешивают и по каплям приливают 2 мл раствора хлорида бария. Выделяется мелкокристаллический осадок. Демонстрируют на черном экране. Раствор с осадком взбалтывают и 50 мл переносят в цилиндр вместимостью 100 мл. К этому раствору с осадком постепенно приливают 2 мл соляной кислоты. Растворение осадка не наблюдается.  Подтверждение доброкачественности. 5 мл препарата помещают в мерную колбу емкостью 250 мл и доводят объем раствора водой до метки. В 50 мл этого раствора проводят определение, как указано в статье «Magnesii sulfas», прибавляют 5 мл аммиачного буферного раствора и титруют при энергичном перемешивании 0,05 М раствором натрия эдетата до появления синего окрашивания (индикатор – кислотный хром черный специальный). 1 мл 0,05 М раствора натрия эдетата соответствует 12,32 мг магния сульфата MgSO4 . 7H2O(1 мл 0,05 мол раствора трилона Б соответствует 0,01232 г MgS04 * 7Н20, которого в 1 мл препарата соответственно должно быть 0,194-0,206 г или 0,242-0,258 г)( 99 %- 102 %). ОФОРМИТЬ В ТЕТРАДЬ ПРОТОКОЛ ИСПЫТАНИЯ ПРИЛОЖЕНИЕ 1. 2.КАЛЬЦИЯ ХЛОРИД. CALCII CHLORIDUM    (ГФ Х, ст. 119) CaCl2*6H2O М.м. 219, 08 Подтверждение подлинности 1.Обнаружение иона Са2+ Реакция с раствором оксалата аммония. Реактивы, оборудование Кальция хлорид, 10 % раствор 5 мл Цилиндр вместимостью 50 мл 1 шт Оксалат аммония, 4 % раствор 2 » » » 10 » 3 » Уксусная кислота разведенная 2 » » » 5 » 2 » Аммиак, 10 % раствор 2 » » » Соляная кислота 1 » Пипетка 2 мл 1 шт Помещают 1 мл раствора кальция хлорида в цилиндр вместимостью 50 мл, разбавляют дистиллированной водой до 30 мл, перемешивают и по каплям добавляют 1 мл раствора оксалата аммония. Выпадает белый кристаллический осадок. Раствор с осадком взбплтывают и по 10 мл переносят в 3 цилиндра вместимостью 50 мл. К содержимому одного цилиндра при помешивании постепенно приливают разведенную уксусную кислоту – осадок не растворяется. К содержимому 2 цилиндра при помешивании постепенно приливают раствор аммиака – осадок не растворяется. К содержимому 3 цилиндра при помешивании приливают постепенно соляную кислоту. Наблюдается растворение осадка. Демонтстрируют на черном экране. 2.Обнаружение ионов Cl- Реакция с раствором нитрата серебра. Реактивы, оборудование. Кальция хлорид, 10 % раствор 10 мл Цилиндр вместимостью 50 мл 1 шт Нитрат серебра, 2 % раствор 1 » » » 10 » 2 » Азотная кислота 1 » » 5 » 4 » Аммиак, 10 % раствор 1 » Карбонат аммония, раствор 2 » Помещают 5 мл раствора кальция хлорида в цилиндр вместимостью 50 мл, разбавляют дистиллированной водой до 30 мл, подкисляют 1 мл разведенной азотной кислоты и перемешивают, затем по каплям добавляют 1 мл раствора нитрата серебра. Выпадает белый творожитсый осадок. Раствор с осадком взбалтывают и переносят по 1 мл в два цилиндра вместимостью 10 мл. В первый цилиндр приливают 1 мл раствора аммиака. При перемешивании наблюдается быстрое растворение осадка. Во второй цилиндр приливают 1 мл раствора карбоната аммония. При перемешивании наблюдается медленное растворение осадка. Демонстрируют на черном экране. Подтверждение доброкачественности. 1.Около 0,8 г препарата (точная навеска), отвешенные в закрытом бюксе, растворяют в воде, переносят в мерную колбу емкостью 100 мл, доводят объем раствора водой до метки и тщательно перемешивают. 2.К 25 мл приготовленного раствора прибавляют 5 мл аммиачного буферного раствора, 0,1 г индикаторной смеси или 7 капель раствора кислотного хром темно-синего и титруют 0,05 мол раствором трилона Б до сине-фиолетового окрашивания. 3.1 мл 0,05 мол раствора трилона Б соответствует 0,01095 г СаCl2 * 6Н20, которого в препарате должно быть не менее 98,0%.  ОФОРМИТЬ В ТЕТРАДЬ ПРОТОКОЛ ИСПЫТАНИЯ ПРИЛОЖЕНИЕ 1. 3.НАТРИЯ ГИДРОКАРБОНАТ. NATRII HYDROCARBONAS   Натрия гидрокарбонат ФС.2.2.0011.15 Натрия гидрокарбонат Natrii hydrocarbonas Взамен ГФ X, ст. 430 NaHCO3 М.м. 83,99 Подтверждение подлинности. Обнаружение иона СО22- Реакция с соляной кислотой. NaHCO3 + HCl → NaCl + CO2↑ + H2O Реактивы, оборудование Натрий гидрокарбонат, 5 % раствор 10 мл Цилиндр вместимостью 50 мл 1 шт Соляная кислота разведенная 5 » » » 10 » 1 » Помещают 10 мл раствора натрия гидрокарбоната в цилиндр вместимостью 50 мл, добовлют 1 мл разведеной соляной кислоты. Обильно выделяются пукзырьки газа. При взбалтывании раствора выделение газа усиливается. Демонстрируют в проходящем свете. Подтверждение доброкачественности. Около 0,2 г (точная навеска) субстанции растворяют в 20 мл воды, свободной от углерода диоксида, и титруют 0,1 М раствором хлористоводородной кислоты (индикатор – 0,1 мл 0,1 % спиртового раствора метилового оранжевого). 1 мл 0,1 М раствора хлористоводородной кислоты соответствует 8,401 мг натрия гидрокарбоната NaHCO3. ОФОРМИТЬ В ТЕТРАДЬ ПРОТОКОЛ ИСПЫТАНИЯ ПРИЛОЖЕНИЕ 1. Контрольные вопросы и задания . 1. Напишите формулы лекарственных веществ производных солей кислоты угольной – натрия гидрокарбоната . Опишите внешний вид, дайте характеристику растворимости данных лекарственных веществ.Укажите причины изменения состава натрия гидрокарбоната при неправильном хранении. 2. Опишите химические свойства натрия гидрокарбоната .Приведите общую реакцию на гидрокарбоанат- и карбонат-ионы, а также реакции, позволяющие отличать эти ионы друг от друга. 3. Укажите способ определения примеси карбонатов в натрия гидрокарбонате.Приведите методы количественного определения натрия гидрокарбоната и лития карбоната. Напишите уравнения соответствующих реакций и расчетные формулы. 4. Опишите свойства бария сульфата для рентгеноскопии (внешний вид, растворимость в воде и других средах).Как проводят анализ подлинности, чистоты и количественного определения препарата. Укажите условия хранения препарата. 5. Дайте характеристику свойств (внешний вид, растворимость) лекарственных веществ группы магния (магния окись, магния сульфат). Напишите общие и частные реакции, характеризующие подлинность данных препаратов. 6. Напишите формулы и дайте характеристику физико-химических свойств препаратов группы кальция (кальция сульфат, кальция хлорид). Какие изменения внешнего вида возможны для указанных препаратов при неправильном хранении. 7. Приведите общие и частные реакции, характеризующие подлинность кальция хлорида и кальция сульфата. Анализ чистоты данных лекарственных веществ. 8. Дайте характеристику внешнего вида и растворимости кислоты борной и натрия тетрабората. Укажите возможные изменения внешнего вида натрия тетрабората при хранении. 9.Какими способами можно отличить натрия тетраборат от кислоты борной? Лабораторная работа № 4 Тема занятия :Контроль качества неорганических лекарственных средств элементов VIII группы периодической системы Д.И. Менделеева. Соединения железа. Цель занятий : 1.Провести анализ готовых лекарственных форм: сироп и таблетки Ферум Лек, таблетки Сорбифер Дурулес, капсулы Фенюльс, раствор для приема внутрь Ферлатум. 2. Проанализировать формы выпуска, серию, срок годности , указать производителя лекарственной формы. Применение. |
