Кк. 4 курс КОНТРОЛЬ 1И 2 .Лабораторная работа. Методические указания по выполнению лабораторных работ, учебные фармакопейных статьи гф 13, а также варианты индивидуальных заданий для студентов
 Скачать 4.45 Mb. Скачать 4.45 Mb.
|
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего образования «КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ» (ФГБОУ ВО «КубГУ») Институт среднего профессионального образования СБОРНИК ЛАБОРАТОРНЫХ РАБОТ (для студентов 4 курса очного обучения, 7 семестр) ПО МДК.02.02. КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ 4 КУРС (48 ч) Часть 1 ( Контроль качества неорганических лекарственных средств) Специальность 33.02.01 Фармация(очная),квалификация Фармацевт    Краснодар 2018 Сборник разработан в соответствии с рабочей программой ПМ.02.01. по МДК 02.02. Контроль качества лекарственных средств для студентов 4 курса очной формы обучения (7 семестр). Содержит методические указания по выполнению лабораторных работ, учебные фармакопейных статьи ГФ 13, а также варианты индивидуальных заданий для студентов. Составитель преподаватель ИНСПО Е.Н Сухенко____________ СОДЕРЖАНИЕ Лабораторная работа № 1…………………………………………………….4 Лабораторная работа № 2…………………………………………………….15 Лабораторная работа № 3…………………………………………………….19 Лабораторная работа № 4…………………………………………………….25 ПРИЛОЖЕНИЕ 1……………………………………………………………..27 ПРИЛОЖЕНИЕ 2……………………………………………………………..28 СПИСОК ЛИТЕРАТУРЫ…………………………………………………………………..43 Лабораторная работа № 1 Тема занятия: Контроль качества неорганических лекарственных средств элементов VII группы периодической системы Д.И. Менделеева. Галогены и их соединения. Цель занятий: 1.Провести анализ готовых лекарственных форм : 0,9 % раствор Натрия хлорида, 4 % раствор Калия хлорида, Пананги , Аспаркам. 2. Провести анализ готовых лекарственных форм: таблетки Йодомарин и Калия йодид . 3. Проанализировать формы выпуска, серию, срок годности, указать производителя лекарственной формы. Применение.  1.НАТРИЯ ХЛОРИД. NATRII CHLORIDUM   В 1 л раствора содержится в качестве активного вещества: натрия хлорида 9,00 г, вспомогательные вещества- натр едкий, хлористоводородная кислота, вода для инъекций; что соответствует: натрия (Na+) - 154 ммоль, хлорида (Cl-) - 154 ммоль. ФС.2.2.0014.15 Натрия хлорид NaCl M.м. 58, 44 Подтверждение подлинности. 1.Обнаружение иона Na+ Окрашивание пламени Реактивы, оборудование : Натрия хлорид 0.9% р-р Грифель или платиновая проволока Соль натрия, внесённая, внесённая на грифеле или в ушке платиновой проволоки в бесцветное пламя, окрашивает его в ярко-жёлтый цвет.  2.Обнаружение иона СL- Реакция с раствором нитрата серебра NaCl + AgNO3 → AgCl↓ + NaNO3 AgCl + 2NH4OH → [Ag(NH3)2]Cl + H2O AgCl + (NH4)2CO3 → [Ag(NH3)2]Cl + CO2 + H2O Реактивы, оборудование: Натрия хлорид, 0,9% раствор 10 мл Цилинд вместимостью 50 мл 1 шт. Азотная кислота разведённая 10 » » » 10 » 2 » Нитрат серебра, 2% раствор 5 » » » 25 » 1 » Аммиак, 10% раствор 10 » » » 10 » 3 » Карбонат аммония, раствор 25 » Пипетка вместимостью 6 мл с грушей 1 » Помещают 1 мл раствора натрия хлорида в цилиндр вместимостью 50 мл, разбавляют дистиллированной водой до 50 мл, подкисляют 1 мл разведенной азотной кислоты и перемешивают, затем по каплям добавляют 0,5 мл раствора нитрата серебра. Выпадает белый творожитсый осадок.  Раствор с осадком взбалтывают и переносят по 1 мл в два цилиндра вместимостью 10 мл. В первый цилиндр приливают 1 мл раствора аммиака. При перемешивании наблюдается быстрое растворение осадка. Во второй цилиндр приливают 2,5 мл раствора карбоната аммония. При перемешивании наблюдается медленное растворение осадка. Демонстрируют на черном экране. Подтверждение доброкачественности. Количественное определение. 10 мл препарата титруют 0,1 н. раствором нитрата серебра до оранжево-желтого окрашивания (индикатор - хромат калия). 1 мл 0,1 н. раствора нитрата серебра соответствует 0,005844 г NaCl, которого в 1 мл препарата должно быть 0,0087-0,0093 г. ОФОРМИТЬ В ТЕТРАДЬ ПРОТОКОЛ ИСПЫТАНИЯ ПРИЛОЖЕНИЕ 1. 2.КАЛИЯ ХЛОРИД. KALII CHLORIDUM   ФС.2.2.0009.15 Калия хлорид KCl М. м. 74, 56 Подтверждение подлинности. 1. Обнаружение иона К+ Окрашивание пламени Реактивы, оборудование Калия хлорид 0,4% р-р Грифель или платиновая проволока Калия хлорид, внесённый на грифеле или в ушаке платиновой проволоки в бесцветное пламя, окрашивает его в фиолетовый цвет.  Реакция с винокаменной кислотой H H HO – C – COOH HO – C – COOK KCl + ǀ → ǀ ↓ + HCl HO – C – COOH HO – C - COOH H H HCl + CH3COONa → CH3COOH + NaCl H H HO – C – COOK HO – C – COOH HCl + ǀ → ǀ + KCl HO – C – COOH HO – C – COOH H H H H HO – C – COOK HO – C – COOK NaOH + ǀ → ǀ + H2O HO – C – COOH HO – C ̶ COONa H H Реактивы, оборудование Калия хлорид, 0.4 %раствор 80 мл Цилиндр вместимостью 50 мл 1 шт. Винокаменная кислота 20 % раствор 100 » » » 20 » 2 » Ацетат натрия, 10 % раствор 70 » » » 100 » 2  Соляная кислота 35 » » » 50 » 3 » Едкий натр, 50 » Колба коническая вместимостью 100 » 2 » Стеклянная палочка длиной 35 см 1 » Баня со льдом 2 » В одну из колб помещают 1 мл раствора калия хлорида, добавляют 10 мл дистиллированной воды. Во вторую колбу помещают 10 мл раствора винокаменной кислоты. Оба раствора охлаждают в банях со льдом примерно до + 10°. Охлаждённые растворы сливают в цилинд вместимостью 50 мл, перемешивают, приливают 7 мл раствора ацетата натрия. Вновь перемешивают, потирают стеклянной палочкой о стенки цилиндра. Выпадает мелкокристаллический осадок белого цвета. Раствор с осадком взбалтывают. Переносят по 10 мл полученной суспензии в два цилиндра вместимостью 50 мл. В один цилиндр приливают при перемешивании 1,5 мл соляной кислоты. Наблюдается растворение осадка. Во второй цилиндр приливают при перемешивании 1,5 мл раствора едкого натра. Осадок также растворяется, но медленнее, чем в первом случае. Демонстрируется на черном экране или в проходящем свете.  2.Обнаружение иона Cl – Реакция с раствором нитрата серебра AgNO3 + KCl → AgCl↓ + KNO3 AgCl + 2NH4OH → [Ag(NH3)2]Cl + 2H2O AgCl + (NH4)2CO3 → [Ag(NH3)2]Cl + CO2 + H2O Реактивы, оборудование Калия хлорид, 0.4 % раствор 2 мл Цилинд вместимостью 500 мл 1 шт. Азотная кислота разведённая 10 » » » 200 » 2 » Нитрат серебра, 2 % раствор 5 » » » 50 » 1 » Аммиак, 10 % раствор 10 » » » 25 » 1 » Карбонат аммония, раствор 25 » Пипетка с грушей вместимостью 6 » 1 » Пипетка вместимостью 1 » 1 » Помещают 1 мл раствора натрия хлорида в цилиндр вместимостью 50 мл, разбавляют дистиллированной водой до 50 мл, подкисляют 1 мл разведенной азотной кислоты и перемешивают, затем по каплям добавляют 0,5 мл раствора нитрата серебра. Выпадает белый творожитсый осадок.  Раствор с осадком взбалтывают и переносят по 1 мл в два цилиндра вместимостью 10 мл. В первый цилиндр приливают 1 мл раствора аммиака. При перемешивании наблюдается быстрое растворение осадка. Во второй цилиндр приливают 2,5 мл раствора карбоната аммония. При перемешивании наблюдается медленное растворение осадка. Демонстрируют на черном экране. Подтверждение доброкачественности. Около 0,05 г (точная навеска) субстанции растворяют в 50 мл (при потенциометрическом титровании) или 20 мл воды (при определении конечной точки титрования с помощью индикатора) и титруют 0,1 M раствором серебра нитрата потенциометрически или до оранжево-желтого окрашивания (индикатор – 5 % раствор калия хромата). Параллельно проводят контрольный опыт. 1 мл 0,1 М раствора серебра нитрата соответствует 7,455 мг калия хорида KCl. ОФОРМИТЬ В ТЕТРАДЬ ПРОТОКОЛ ИСПЫТАНИЯ ПРИЛОЖЕНИЕ 1. 3. Панангин® (Panangin). Аспаркам (Asparcam).    Подтверждение подлинности. 1. Обнаружение иона К+ Окрашивание пламени Реактивы, оборудование Панангин , аспаркам Грифель или платиновая проволока ЛП , внесённый на грифеле или в ушаке платиновой проволоки в бесцветное пламя, окрашивает его в фиолетовый цвет.  Реакция с винокаменной кислотой H H HO – C – COOH HO – C – COOK KCl + ǀ → ǀ ↓ + HCl HO – C – COOH HO – C - COOH H H HCl + CH3COONa → CH3COOH + NaCl H H HO – C – COOK HO – C – COOH HCl + ǀ → ǀ + KCl HO – C – COOH HO – C – COOH H H H H HO – C – COOK HO – C – COOK NaOH + ǀ → ǀ + H2O HO – C – COOH HO – C ̶ COONa H H Реактивы, оборудование Панангин, аспарка, 0.4 %раствор 80 мл Цилиндр вместимостью 50 мл 1 шт. Винокаменная кислота 20 % раствор 100 » » » 20 » 2 » Ацетат натрия, 10 % раствор 70 » » » 100 » 2 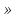 Соляная кислота 35 » » » 50 » 3 » Едкий натр, 50 » Колба коническая вместимостью 100 » 2 » Стеклянная палочка длиной 35 см 1 » Баня со льдом 2 » В одну из колб помещают 1 мл раствора ЛП, добавляют 10 мл дистиллированной воды. Во вторую колбу помещают 10 мл раствора винокаменной кислоты. Оба раствора охлаждают в банях со льдом примерно до + 10°. Охлаждённые растворы сливают в цилинд вместимостью 50 мл, перемешивают, приливают 7 мл раствора ацетата натрия. Вновь перемешивают, потирают стеклянной палочкой о стенки цилиндра. Выпадает мелкокристаллический осадок белого цвета. Раствор с осадком взбалтывают. Переносят по 10 мл полученной суспензии в два цилиндра вместимостью 50 мл. В один цилиндр приливают при перемешивании 1,5 мл соляной кислоты. Наблюдается растворение осадка. Во второй цилиндр приливают при перемешивании 1,5 мл раствора едкого натра. Осадок также растворяется, но медленнее, чем в первом случае. Демонстрируется на черном экране или в проходящем свете.  ОФОРМИТЬ В ТЕТРАДЬ ПРОТОКОЛ ИСПЫТАНИЯ ПРИЛОЖЕНИЕ 1. 4. КАЛИЯ ЙОДИД. KALII IODIDUM  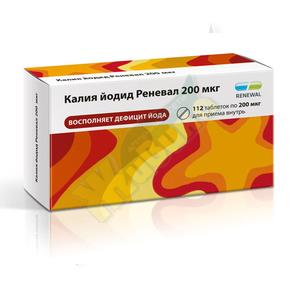 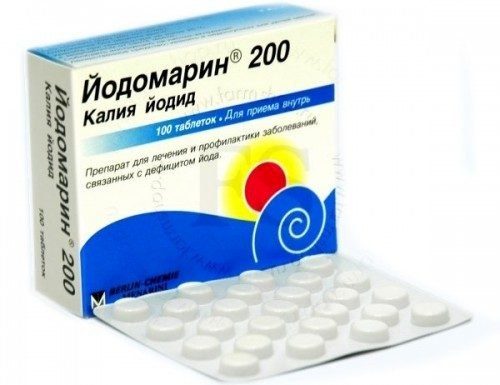 Йодомарин и Калия йодид относятся к йодсодержащим средствам. Это нетрудно понять из их названия. Но фактически – это одно и то же средство. Просто Йодомарин – это патентованное средство, выпускаемое германской фирмой Берлин-Хеми в виде таблеток массой 100 и 200 мкг. ФС.2.2.0008.15 Калия йодид KI М.м.166,01 Подтверждение подлинности. 1.Обнаружение иона К+ Окрашивание пламени Реактивы, оборудование Калия йодид( йодомарин,йодактив)кристаллический 1 г Грифель или платиновая проволока Соляная кислота развед 10 мл  Реакция с винокаменной кислотой H H HO – C – COOH HO – C – COOK KCl + ǀ → ǀ ↓ + HCl HO – C – COOH HO – C - COOH H H HCl + CH3COONa → CH3COOH + NaCl H H HO – C – COOK HO – C – COOH HCl + ǀ → ǀ + KCl HO – C – COOH HO – C – COOH H H H H HO – C – COOK HO – C – COOK NaOH + ǀ → ǀ + H2O HO – C – COOH HO – C ̶ COONa H H Реактивы, оборудование Калия иодид, 0.4 %раствор 80 мл Цилиндр вместимостью 50 мл 1 шт. Винокаменная кислота 20 % раствор 100 » » » 20 » 2 » Ацетат натрия, 10 % раствор 70 » » » 100 » 2  Соляная кислота 35 » » » 50 » 3 » Едкий натр, 50 » Колба коническая вместимостью 100 » 2 » Стеклянная палочка длиной 35 см 1 » Баня со льдом 2 » В одну из колб помещают 1 мл раствора ЛП, добавляют 10 мл дистиллированной воды. Во вторую колбу помещают 10 мл раствора винокаменной кислоты. Оба раствора охлаждают в банях со льдом примерно до + 10°. Охлаждённые растворы сливают в цилинд вместимостью 50 мл, перемешивают, приливают 7 мл раствора ацетата натрия. Вновь перемешивают, потирают стеклянной палочкой о стенки цилиндра. Выпадает мелкокристаллический осадок белого цвета. Раствор с осадком взбалтывают. Переносят по 10 мл полученной суспензии в два цилиндра вместимостью 50 мл. В один цилиндр приливают при перемешивании 1,5 мл соляной кислоты. Наблюдается растворение осадка. Во второй цилиндр приливают при перемешивании 1,5 мл раствора едкого натра. Осадок также растворяется, но медленнее, чем в первом случае. Демонстрируется на черном экране или в проходящем свете. Обнаружение иона I ̶ Реакция с окислителем 2KI + 2FeCl3 → I2 + 2FeCl2 + 2KCl Реактивы, оборудование Калия йодид, 5 % раствор 10 мл Цилиндр вместимостью 250 мл Соляная кислота разведённая 5 » с притертой пробкой 1 шт. Хлорид железа (III), 3 % раствор 2 » Цилиндр вместимостью 50 мл 1 » Хлороформ 50 » Пипетка с грушей, вместимостью 6 мл 1 » Пипетка с грушей, вместимостью 2 мл 1 » В цилиндр с притёртой пробкой помещают 10 мл раствора калия йодида, разбавляют дистиллированной водой до 100 мл, подкисляют 5 мл разведённой соляной кислоты и перемешивают. После добавления 50 мл хлороформа быстро приливают 2 мл раствора хлорида железа (III). Цилиндр закрывают и несколько раз энергично встряхивают. После раслоения жидкостей нижний, хлороформный, слой окрашивается в фиолетовый цвет. Верхний слой остается бесцветным. Демонстрируют в проходящем свете.  Реакция с раствором нитрата серебра HNO3 NaI + AgNO3 → AgI↓ + NaNO3 Реактивы, оборудование Калия йодит, 5 % раствор 0,2 мл Цилиндр вместимостью 500 мл 1 шт. Азатная кмслота, разведённая 10 » » » 200 » 2 » Нитрат серебра, 2 % раствор 5 » » » 50 » 2 » Аммиак, 10 % раствор 50 » » » 10 » 1 » Карбонат аммония, раствор 50 » Пипетка с грушей, вместимостью 6 » 1 » Пипетка с грушей, вместимостью 1 » 1 » Помещают 0,2 мл раствора калия йодида в цилиндр вместимостью 500 мл, разбавляют дистиллированной водой до 300 мл, подкисляют 10 мл разведённой азотной кислоты и перемешивают. Затем по каплям добавляют 5 мл раствора нитрата серебра. Наблюдаются выпадение аморфного осадка коричневато-желтого цвета. Демонстрируют на белом экране. Раствор с осадком взбалтывают и полученную взвесь переносят по 50 мл в два цилиндра вместимостью 200 мл. В первый цилиндр приливают 50 мл раствора аммиака при помешивании. Растворения осадка не наблюдается. Во второй цилиндр приливают 50 мл раствора карбоната аммония при перемешивании. Растворение осадка также не наблюдается. Подтверждение доброкачественности. 1.Около 0,3 г (точная навеска) субстанции, предварительно высушенной при температуре от 100 до 105 °С в течение 4 ч, растворяют в 30 мл воды, прибавляют 1,5 мл уксусной кислоты разведенной 30 % и титруют 0,1 М раствором серебра нитрата до перехода окраски осадка от желтой к розовой (индикатор – 0,3 мл 0,1 % раствора эозина Н). 2.Параллельно проводят контрольный опыт. 1 мл 0,1 М раствора серебра нитрата соответствует 16,60 мг калия йодида KI.  ОФОРМИТЬ В ТЕТРАДЬ ПРОТОКОЛ ИСПЫТАНИЯ ПРИЛОЖЕНИЕ 1. Контрольные вопросы и задания . 1.Дайте сравнительную характеристуку препаратам натрия хлорид, с учетом их производителя. Методы идентификации и количественного определения. Формы выпуска, хранение. Применение. 2. Дайте сравнительную характеристуку препаратам калия хлорид, с учетом их производителя. Методы идентификации и количественного определения. Формы выпуска, хранение. Применение. 3. Дайте сравнительную характеристуку препарату Панангин в жидкой и твердой лекарственной форме. 4. Оцените и охарактеризуйте препараты Аспаркам и Панангин . Методы идентификации и количественного определения. Формы выпуска, хранение. Применение. Контрольные вопросы и задания для семинарских занятий.  Лабораторная работа № 2 |
