Методическое пособие _Решение задач по теме _Растворы_. Методическое пособие Решение задач по теме Растворы
 Скачать 444 Kb. Скачать 444 Kb.
|
|
Реши самостоятельно: 1. Какие объемы 37 % раствора НСl (ρ=1,19 г/см3) и воды нужны для приготовления 1 л 10 % раствора (ρ=1,049 г/см3). 2.Какие объёмы 95% раствора серной кислоты (ρ=1835 г/л) и воды нужно для приготовления 1 л 25% раствора (ρ=1180 г/л). 3.Сколько 65% -ного раствора азотной кислоты и воды нужно взять для приготовления 500г 15%-ного раствора этой кислоты? 4.Какие объемы 30% ортофосфорной кислоты (ρ=1,18 г/см3) и воды нужны для приготовления 100 л 8% раствора (ρ=1,04 г/см3). 5.Сколько 22 н. раствора плавиковой кислоты (ρ=1123 г/л) и 10 н. раствора плавиковой кислоты (ρ=1036 г/л) потребуется для приготовления 20 н. раствора? 2.7. Способы вычисления при смешивании растворов. Метод «креста», диагональная схема, правило смешивания, «Андреевский крест». Используется для решения задач для двух компонентов смеси при условии, что свойство компонентов поддаются аддитивному сложению. А- m, масса, объем или количество первого компонента; В - m, масса, объем или количество второго компонента; А+В , m, масса, объем или количество смеси; Х1- свойство первого компонента; Х2- свойство второго компонента; Х – свойство смеси. Свойства: плотность твердого вещества, относительная плотность, относительно атомная масса, относительно молекулярная масса, молярная масса, концентрации (С%, Сн, См, Сm), стехиометрический множитель. 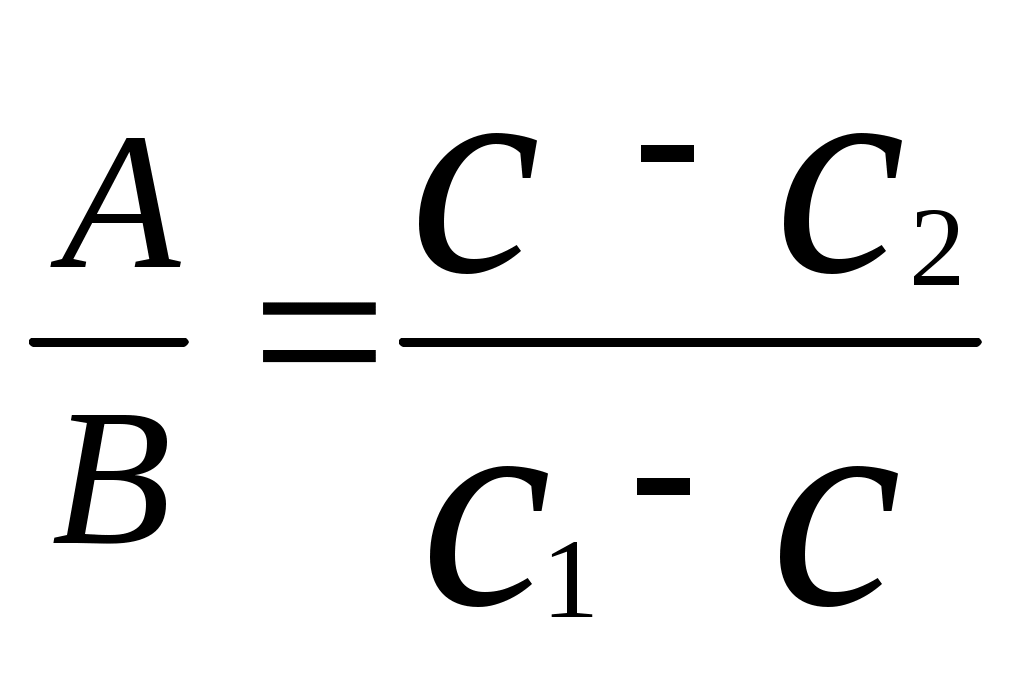 , , отношение компонентов обратно пропорционально разности величин свойств (концентраций) компонентов и смеси диагональная схема   х1 х-х2 х1 х-х2Х   х2 х1-х х2 х1-хПравило смешения не применимо к расчету объемов растворов, концентрация которых выражается через отношение к объему (кроме, слабо разбавленных). Пример: В каком отношении должны быть взяты объемы 0,5 н. раствора и 0,1 раствора, чтобы получить 0,2 н. раствор?
Реши самостоятельно: Вычислите массовую долю раствора полученного смешиванием 1000 т 60% раствора с 250 т 96% раствора. Сколько грамм воды и 87% раствора серной кислоты необходимо взять для приготовления 600 г 55% раствора? Сколько граммов 8% и 75% растворов необходимо взять для приготовления 400 г 42 % раствора? Уксусная эссенция – 80% раствор уксусной кислоты (СН3СООН). Сколько граммов этой эссенции и воды необходимо взять для приготовления 200 мл 3 % раствора уксуса применяемого как приправа к пище? Плотность эссенции можно принять равной 1 г/см3. Сколько грамм нужно взять 20% и 32,1 % растворов соляной кислоты, чтобы приготовить 242 г 26,7% раствора соляной кислоты? 2.8. Расчет массы воды, которая прибавляется к раствору для разбавления его.  , или , или , где , где С1 – исходная концентрация, С – получившаяся концентрация, m – масса раствора, V – объем раствора. Преобразованная формула нахождения концентрации C= 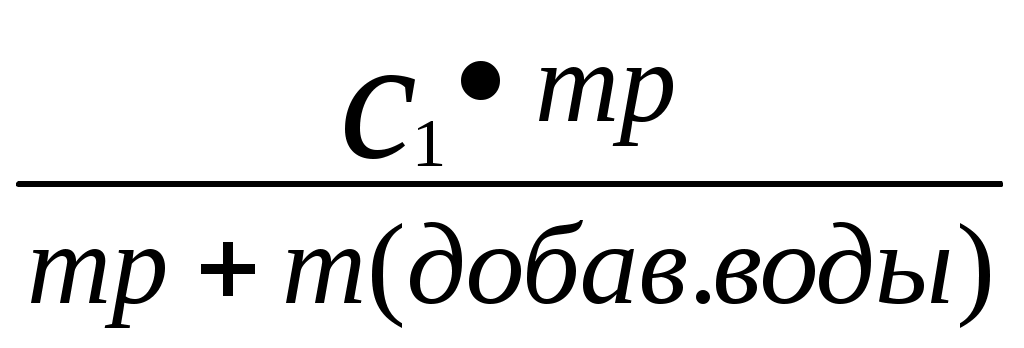 Расчет концентрации раствора при добавлении к раствору вещества.  Пример: К 327,5 г 50% – ного раствора вещества добавили 140 г воды. Массовая доля вещества в конечном растворе равна?
Реши самостоятельно: К 400 г раствора, массовая доля гидроксида калия в котором 0,45, добавлено 100 г воды. Какова массовая доля щелочи в получившемся растворе? В 200 г 2%-ного раствора поваренной соли растворили 20 г хлорида натрия. Какова массовая доля хлорида натрия в полученном растворе? К 450 г 15 %-ного раствора гидроксида кальция добавили 60 г того же вещества. Массовая доля в конечном растворе равна? Какую массу воды надо добавить к 200 г 70%-ного раствора уксусной кислоты, чтобы получить 9%-ный раствор? К 300 г 10%-ного раствора сахарозы добавили 150 мл воды. Какова массовая доля сахарозы в полученном растворе? 2.9. Упаривание раствора. Задача № 1. Вычислите массу воды, которую надо выпарить из 1 кг 3%- ного раствора сульфата меди для получения 5% - ного раствора. Решение: для решения данной задачи так же возможно применение рассмотренного выше способа. Проанализировав условие, составим схему: 0,03 0 0,05 1 кг х кг 1 кг - х кг - = исходный вода полученный раствор раствор Составим и решим уравнение: 1· 0,03 – х · 0 = (1 – х) · 0,05 0,03 = 0,05 – 0,5х 0,05х = 0,02 х = 0,4 Ответ: масса воды составит 0,4 кг или 400 г. Задача № 2. Вычислите массовую долю хлорида натрия в растворе, если из 30г 10 % раствора соли при нагревании испаряется 10 мл воды. Решение: определим массу испарившейся воды, зная, что плотность воды равна 1г/мл. m (H2 O) = 10 мл · 1г/мл = 10г Составим схему к задаче: 0,1 0 х 30 г 30г – 10 г 10 г - = исходный вода полученный раствор раствор На основании схемы составим уравнение: 30 · 0,1 – 10 · 0 = ( 30 -10) · х 3 = 20 х х = 0,15 = 15% Ответ: массовая доля соли в полученном растворе 15% Задача № 3. Раствор соли объемом 80 мл, имевший плотность 1,1 г/мл выпарили, получив 12 г сухого остатка. Определите массовую долю соли в исходном растворе. Решение: определим массу исходного раствора по формуле m = V·ρ m (раствора) = 80 мл · 1,1г/мл = 88 г Составим схему к задаче: х 0 1% 88 г 12 г - = исходный вода сухой раствор остаток Составим уравнение: 88 · х = 12 · 1 88х = 12 х = 12 : 88 х = 0,136 = 13,6% Ответ: массовая доля соли в исходном растворе составляла 13,6 % Реши самостоятельно: 1. Из 170 г 9% раствора выпарили 50 г растворителя. Определите массовую долю соли в полученном растворе. 2. Определите массу воды, которую нужно выпарить из 340 г раствора хлорида цинка с массовой долей соли 4% чтобы массовая доля соли в полученном растворе увеличилась на 1,5%. 3. Раствор соли объемом 60 мл, имевший плотность 1,3 г/мл, с массовой долей соли 3% нагрели. В результате испарилось 10 мл воды. Определите массовую долю соли в полученном растворе. 4. Вычислите массовую долю хлорида натрия в растворе, если из 50г 10 % раствора соли при нагревании испаряется 20 мл воды. 5. Вычислите массу воды, которую надо выпарить из 2 кг 5%- ного раствора сульфата натрия для получения 7% - ного раствора. 2.10. Смешивание растворов разных концентраций. Задача № 1. Вычислить массовую долю гидроксида натрия в растворе, полученном при сливании 10 мл 40% раствора (плотность 1, 52 г/ мл) и 10 мл 10% раствора (плотность 1,1 г/мл). Решение: определим массы исходных растворов. m1 = 10· 1,52 г/мл =15,2 г m2 = 10 · 1,1 г/ мл = 11 г Согласно условию задачи составим схему: 15,2 г 0,4 0,1 х 11 г 15,2г + 11 г + = раствор 1 раствор 2 полученный раствор Составим уравнение: 15,2 · 0,4 + 11 · 0,1 = (15,2 + 11) · х 6,08 + 1,10 = 26,2 х 7,18 = 26,2х х = 7,18 : 26,2 х = 0,274 = 27,4% Ответ: массовая доля гидроксида натрия в полученном растворе составляет 27,4%. Задача № 2. Смешали два раствора: один массой 90 г и с массовой долей соли 5%, другой массой 125 г и с массовой долей этой же соли 4%. Вычислите массу соли в образовавшемся растворе. Решение: определим массовую долю соли в получившемся растворе. Для этого составим схему: 90 г 0,05 0,04 х 125 г 90 г + 125 г + = раствор 1 раствор 2 полученный раствор Используя данную схему, составим уравнение: 90 · 0,05 + 125 · 0,04 = (90 + 125) · х 4,5 + 5 = 215х 9,5 = 215х х = 9,5 : 215 х =0,044 = 4,4% Далее, применив формулу для вычисления массовой доли вещества в растворе, рассчитаем массу соли. m (соли) = 4,4% · 215г : 100% = 9,46 г Ответ: масса соли составляет 9,46 г Задача № 3. Сколько граммов 75% раствора кислоты надо добавить к 30 г 15% раствора кислоты, чтобы получить 50% раствор? Решение: составим схему 0,75 0,15 0,5 х г х г + 30г 30 г + = На основании данной схемы составим и решим уравнение: 0,75 · х + 30 · 0,15 = (х + 30) ·0,5 0,75х + 4,5 = 0,5 х + 15 0,25х = 10,50 х = 10,50 : 0,25 х = 42 г Ответ: необходимо добавить 42 г 75% раствора кислоты. Задача № 4. Какой объем раствора с массовой долей серной кислоты 60% (плотность 1,5 г/мл) и раствора с массовой долей серной кислоты 30% (плотность 1,2 г/мл) надо взять для приготовления раствора массой 240 г с массовой долей кислоты 50%? Решение: Обозначим массу 1-го раствора – х г, тогда масса 2-го раствора – (240 – х) г. На основании этих данных составим схему: 0,6 0,3 0,5 х г 240г - х г 240г + = Составим уравнение: 0,6 · х + (240 – х) · 0,3 = 240 · 0,5 0,6х + 72 – 0,3х = 120 0,3х = 120 – 72 0,3х = 48 х = 160г – масса 1-го раствора масса 2-го раствора = 240 – 160 = 80 г Найдем объем растворов: V1 = m / ρ = 160 : 1,5 = 106,7 мл V2 = m / ρ = 80 : 1,2 = 66,7 мл Ответ Объемы растворов равны 106,7 мл и 66,7 мл Задача № 5. В лаборатории имеется 2 кг раствора кислоты одной концентрации и 6кг раствора кислоты другой концентрации. Если растворы смешать, то получится раствор, концентрация которого составляет 36%. Если же смешать равные массы этих растворов, то получится раствор, содержащий 32% кислоты. Какова концентрация каждого из двух имеющихся растворов? Составим схемы. Схема №1: х у 0,36 2кг 2 кг + 6 кг 6кг + = Схема № 2 m кг х у 0,32 m кг (m +m) кг + = Составим и решим систему уравнений: 2  х + 6у = 8 · 0,36 х + 6у = 8 · 0,36mх + mу = 0,64m 2 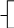 х + 6у = 2,88 х + 6у = 2,88х + у = 0,64 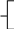 2х + 6у = 2,88 х = 0,64 – у 2 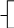 · (0,64 – у) + 6у = 2,88 · (0,64 – у) + 6у = 2,88х = 0,64 – у 1 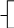 ,28 – 2у + 6у = 2,88 ,28 – 2у + 6у = 2,88х = 0,64 – у   4у= 1,6 у= 0,4 = 40% х = 0, 64 - у ; х = 0,24 = 24% Ответ: концентрации растворов 24% и 40% Задачи для закрепления: 1. В лаборатории имеются растворы с массовой долей хлорида натрия 10 и 20%. Какую массу каждого раствора надо взять для получения раствора с массовой долей соли 12% массой 300 г? 2. Смешали 250 г 10% и 750 г 15% растворов глюкозы. Вычислите массовую долю глюкозы в полученном растворе. 3. Какова будет массовая доля азотной кислоты в растворе, если к 40 мл 96% раствора HNO3 (плотность 1,5 г/мл) прилить 30 мл 48% раствора HNO3 (плотность 1,3 г/мл)? 4. Смешали 30% раствор соляной кислоты с 10% и получили 600 г 15% раствора. Сколько граммов каждого раствора было взято? 5. Кусок сплава меди и цинка массой 36 кг содержит 45% меди. Какую массу меди нужно добавить к этому куску, чтобы полученный новый сплав содержал 60% меди? 2.11. Приготовление растворов из навески кристаллогидрата. Задача № 1. Сколько граммов кристаллогидрата Na2SO4 · 10 H2O необходимо добавить к 50 мл 8% раствора сульфата натрия (плотность 1,07 г/ мл), чтобы увеличить массовую долю вещества в растворе в 3 раза? Решение: решая данную задачу, учтем, что кристаллогидрат это вещество, в кристаллической решетке которого содержатся молекулы воды. Поэтому вычислим массовую долю безводной соли в составе данного кристаллогидрата. Мr (Na2SO4 · 10 H2O) = Аr (Na) · 2 + Аr (S) · 1 + Аr (О) · 4 + Мr (H2O) · 10 = 23 · 2 + 32 · 1 + 16 · 4 + 10 · 1 · 2 + 10 · 16 = 322 Мr (Na2SO4) = 142 w (Na2SO4) = 142 : 322 = 0,44 2. Вычислим массу раствора сульфата натрия: m = V· ρ = 50 · 1, 07 = 53,5 г 3. Составим схему к задаче: 0,08 0, 44 0,08 · 3 53,5г х г 53,5 г + х г + = раствор Na2SO4 · 10 H2O полученный раствор Na2SO4 Используя данную схему, составим и решим уравнение: 53,5 · 0,08 + х · 0,44 = (53,5 + х) · 0,24 4,28 + 0,44 х = 12,84 + 0,24 х 0,2 х = 8,56 х = 42,8 г Ответ: масса Na2SO4 · 10 H2O составит 42,8 г Реши самостоятельно: 1. Сколько граммов кристаллогидрата Na2SO4 · 10 H2O необходимо добавить к 100 мл 8% раствора сульфата натрия (плотность 1,07 г/ мл), чтобы удвоить массовую долю вещества в растворе? 2. Кристаллогидрат сульфата меди (кристаллизуется с 5 молекулами воды) массой 5г растворили в воде количеством 5 моль. Рассчитайте массовую долю соли в полученном растворе. 3. Какую массу медного купороса CuSO4 · 5H2O необходимо взять для приготовления 40 кг 2 % раствора сульфата меди? 4. Из 500 г 40% раствора сульфата железа (II) при охлаждении выпало 100 г его кристаллогидрата (кристаллизуется с 7 молекулами воды). Какова массовая доля вещества в оставшемся растворе? 5. Вычислите массу MgSO4 · 7H2O и воды необходимых для приготовления 120 мл раствора сульфата магния (плотность 1,0623 г /мл) с массовой долей соли 6,2%. 2.12. Концентрирование растворов. Задача № 1. Какую массу сухой соли нужно добавить к 15г 5% раствора хлорида натрия, чтобы получить 8% раствор соли. Решение: При решении подобных задач необходимо учесть, что к раствору добавляется чистое вещество, а значит, его массовая доля составляет 100% или 1. Используя данные условия, составим схему: 0,05 1 0,08 15г х г 15г + х г + = исходный NaCl полученный раствор раствор По схеме составим уравнение: 15 · 0,05 + х · 1 = (15 + х) · 0,08 0,75 + х = 1,2 + 0,08 х 0,08 х = 1,2 – 0,75 0,08 х = 0,45 х = 0,45 : 0,08 х = 5,62 г Ответ: масса сухой соли составляет 5,62 г Реши самостоятельно: 1. К раствору хлорида бария массой 120 г с массовой долей соли 2% добавили 1,6 г этой же соли. Вычислите массовую долю соли в полученном растворе. 2. Через 1 л раствора аммиака с массовой долей, равной 10% (плотность 0,96 г/мл), пропустили 10 л аммиака (н.у.). Вычислите массовую долю аммиака в образовавшемся растворе. 3. К 15 мл 48 % раствора азотной кислоты (плотность 1,3 г/мл), добавили 5 мл концентрированной кислоты (плотность 1,5 г/мл). Определите массовую долю кислоты в полученном растворе. 4. Вычислите массу хлорида натрия, которую необходимо добавить к 15 г 3% раствора для увеличения массовой доли соли в 2 раза. Литература: 1. Хомченко Г.П., Хомченко И.Г. «Сборник задач по химии для поступающих в ВУЗы» Москва. Новая волна – 2008г. 2. И.Г. Хомченко «Сборник задач и упражнений по химии для средней школы» Москва. Новая волна – 2008г. 3. Н. Кузьменко, В. Еремин, В. Попков «Химия для школьников старших классов и поступающих в ВУЗы» Дрофа 1999г. 4. И.М. Акилова, С.Г. Самохвалова, Д.Г. Шевко « Математика. Методические указания к решению задач по математике для учащихся вечернего лицея и слушателей подготовительных курсов» Благовещенск АМГУ 2007 г. 5. ЕГЭ – Химия 2011 под редакцией А.А. Ковериной. Москва Национальное образование 2011 г. |

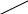
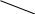 ,5 0,2-0,1
,5 0,2-0,1