Химия. Практическая 4Алюминий В-12. Минерала и его масса известны
 Скачать 33.48 Kb. Скачать 33.48 Kb.
|
|
Алюминий В-12 1.Оцените массу алюминия, который теоретически можно получить из минерального сырья при полном его извлечении, если название минерала и его масса известны Дано: Решение: Ортоклаз (K(AlSi₃O₈))= 40 кг Молярная масса ортоклаза Найти: М(K(AlSi₃O₈)) = 278 г/моль m(Al) - ? молярную массу ортоклаза возьмем за 100% и найдем % Al 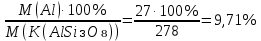 Зная процент Al в минерале, рассчитаем его массу m(Al) = 40 · 0,0971 = 3,884 кг Ответ: m(Al) = 3,884 кг 2. Силумины - это сплавы алюминия с кремнием, содержащие от 4 до 22 масс. % кремния. При химическом анализе сплава навеску силумина растворили в избытке концентрированной соляной кислоты и измерили объём выделившегося в результате реакции газа при н.у. Определите массу взятой навески при растворении, если состав сплава и результат химического анализа известен (содержится в таблице): 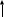 Дано: Решение: Дано: Решение:V(H2) = 650 мл 2 Al + 6 HCl = 2 AlCl3 + 3 H2 или 0,65 л n(H2) = 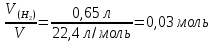 ω(Si) = 15,5 % по уравнению n(Al) : n(H2) = 2:3 Найти: n(Al) = 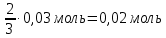 m(Si-Al)-? m(Al) = n · M = 0,02 моль · 27 г/моль = 0,54 г ω(Al) = 100% - ω(Si) = 100% - 15,5% = 84,5 % или 0,845 m(Si-Al) =  Ответ: m(Si-Al) = 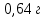 Задача 3 4/3Al + O2 → 2/3Al2O3; ΔG° = -1125273 + 216,77∙T, Дж. Как видим, химическое сродство зависит от температуры. Для металла в Вашем варианте уравнение реакции с кислородом и температурная зависимость ΔG° содержатся в табл. 3. Вычислите и сравните химическое сродство Вашего металла и алюминия к кислороду при указанной в варианте температуре. Составьте уравнение алюминотермического восстановления оксида в Вашем варианте алюминием. Рассчитайте массу алюминия, который потребуется для восстановления известной массы оксида m. Дано: Решение: Т=1750 К 3/2Fe+O2→1/2Fe3O4 m(Fe3O4) = 80 кг ΔG° = -552804 + 153,65∙T Найти: ΔG°(Fe) = -552804 + 153,65∙1750= – 283916,5 Дж m(Al)-? 4/3Al + O2 → 2/3Al2O3 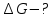 ΔG° = -1125273 + 216,77∙T, Дж ΔG° = -1125273 + 216,77∙T, ДжΔG°(Al) = -1125273 + 216,77∙1750 = – 745925,5 Дж ΔG°(Fe) > ΔG°(Al) 3 Fe3O4+ 8 Al = 9 Fe + 4 Al2O3 n(Fe3O4) = 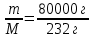  n(Fe3O4) : n(Al) = 3:8 => n(Al) =  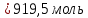 m(Al)= n·M =  · 27г/моль = 24826 г ≈ 25 кг · 27г/моль = 24826 г ≈ 25 кгОтвет: ΔG°(Fe) > ΔG°(Al) ; m(Al) ≈ 25 кг |
