Морфология повреждения
 Скачать 154 Kb. Скачать 154 Kb.
|
|
Лекция 3 МОРФОЛОГИЯ ПОВРЕЖДЕНИЯ Повреждение органов начинается на молекулярном или клеточном уровне, поэтому изучение патологии начинается с познания причин и молекулярных механизмов структурных изменений, возникающих в клетках при их повреждении. Структура нормальной клетки генетически направлена на осуществление определенного метаболизма, дифференцировку и 18 специализацию. В ответ на воздействие различных факторов в клетках развивается процесс адаптации. В результате этого процесса клетки могут достигать нового устойчивого состояния, позволяющего им приспособиться к подобным воздействиям. Если лимиты адаптивного ответа клетки исчерпаны, а адаптация невозможна, то возникает повреждение клетки, до определенного предела обратимое. Однако, если неблагоприятный фактор действует постоянно или его интенсивность очень велика, развивается необратимое повреждение, или смерть, клетки. Смерть клетки — конечный результат ее повреждения, главное следствие ишемии, инфекции, интоксикации, иммунных реакций. Кроме того, это естественное событие в процессе нормального эмбриогенеза, развития лимфоидной ткани, инволюции органа под действием гормонов, а также желаемый результат радио- и химиотерапии при раке. Существует два типа клеточной смерти — некроз и апоптоз. Некроз — наиболее распространенный тип смерти клетки. Он проявляется ее резким набуханием и разрывом клеточной мембраны, денатурацией и коагуляцией цитоплазматических белков, разрушением клеточных органелл. Апоптоз необходим для нормальной элиминации ненужных клеточных популяций в процессе эмбриогенеза и при различных физиологических процессах. Апоптоз встречается и при патологических процессах; в этом случае он сопровождается некрозом. ПРИЧИНЫ ПОВРЕЖДЕНИЯ КЛЕТОК Различают следующие причины повреждения клеток.
19 концентрациях могут вызвать повреждение клеток непосредственно или путем нарушения их электролитного гомеостаза. Кислород в высоких концентрациях очень токсичен. Следовые количества веществ, известных как яды (мышьяк, цианиды, соли ртути), могут разрушить достаточно большое количество клеток в течение минут и часов. Разрушительным действием обладают также многие факторы окружающей среды: пыль, инсектициды и гербициды; промышленные и природные факторы, например уголь и асбест; социальные факторы: алкоголь, курение и наркотики; высокие дозы лекарств.
МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ КЛЕТОК Молекулярные механизмы повреждения клеток, приводящие к их смерти, очень сложны. Существуют четыре наиболее чувствительные внутриклеточные системы: - поддержание целости клеточных мембр'ан, от которой зави сит ионный и осмотический гомеостаз клетки и ее органелл; - аэробное дыхание, связанное с окислительным фосфорили-рованием и образованием аденозинтрифосфата (АТФ);
20 Морфологические изменения становятся очевидными только после того, как нарушения биологической системы клетки проходят некий критический уровень, причем развитие морфологических признаков смертельного повреждения клетки занимает больше времени, чем появление обратимых изменений. Например, набухание клетки обратимо и может развиться в течение нескольких минут, а достоверные светооптические признаки смерти клетки в миокарде выявляются лишь спустя 10—12 ч после тотальной ишемии, хотя известно, что необратимые повреждения наступают уже через 20—60 мин. Естественно, ультраструктурные повреждения будут видны раньше, чем светооптические. Реакция клеток на повреждающие воздействия зависит от типа, продолжительности действия и тяжести повреждающего фактора. Например, малые дозы токсинов или непродолжительная ишемия могут вызвать обратимые изменения, тогда как большие дозы того же токсина и продолжительная ишемия способны привести к немедленной гибели клетки или медленному необратимому повреждению, вызывающему клеточную смерть. Тип, состояние и приспособляемость клетки также определяют последствия ее повреждения. Для ответа клетки на повреждение важны ее гормональный статус, характер питания и метаболические потребности. Механизмы действия многих повреждающих агентов хорошо известны. Так, многие токсины вызывают повреждение клеток, воздействуя на эндогенные субстраты или ферменты. Особенно чувствительны к действию токсинов гликолиз, цикл лимонной кислоты и окислительное фосфорилирование на внутренних мембранах митохондрий. Например, цианид инактивирует цито-хромоксидазу, а флуороацетат препятствует реализации цикла лимонной кислоты, что в результате приводит к недостаточности АТФ. Некоторые анаэробные бактерии, например Clostridium perfringens, высвобождают фосфолипиды, которые атакуют фос-фолипиды клеточных мембран, повреждая их. Наиболее важными для развития повреждения и смерти клетки считают следующие четыре механизма.
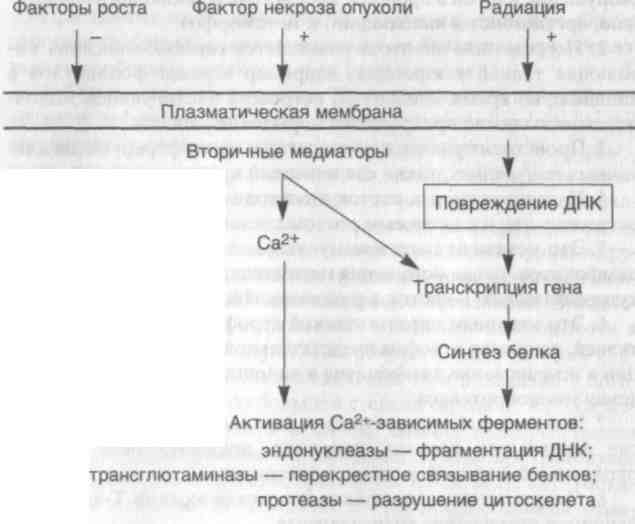
21 кальция в клетке ведет к активации ряда ферментов, повреждающих клетку: фосфолипаз (повреждение клеточной мембраны), протеаз (разрушение мембраны и белков цитоскелета), АТФаз (истощение запасов АТФ) и эндонуклеаз (фрагментация хроматина).
ОСНОВНЫЕ ФОРМЫ ПОВРЕЖДЕНИЯ КЛЕТОК Различают три формы повреждения клеток: 1) ишемическое и гипоксическое повреждение; 2) повреждение, вызванное свободными радикалами, включая активированный кислород; 3) токсическое повреждение. 1. Ишемическое и гипоксическое повреждение. Чаще всего оно обусловлено окклюзией артерий. При этом изначально гипоксия воздействует на аэробное дыхание клетки — окислительное фосфорилирование в митохондриях. В связи с тем что напряжение кислорода в клетке снижается, прекращается окислительное фосфорилирование, а образование АТФ уменьшается или останавливается. Исчезновение АТФ ведет к быстрому набуханию (отеку) клетки — одному из ранних проявлений ишемического повреждения. Отек клетки обусловлен нарушением регуляции объема клетки плазматической мембраной. Баланс между содержимым клетки и окружающей ее средой обеспечивается энергетически зависимым натриевым насосом, который поддерживает концент- 22 рацию калия внутри клетки значительно более высокой, чем внеклеточная. Наблюдается отделение рибосом от мембран гранулярной эндоплазматической сети и диссоциация полисом в моносомы. На поверхности клеток могут образовываться "волдыри", а клетки, имеющие на поверхности микроворсинки, их утрачивают (эпителий проксимальных канальцев почек). В цитоплазме и вне клеток появляются "миелиновые фигуры", образующиеся из цитоплазмы и мембран органелл. Митохондрии набухают, а эн-доплазматическая сеть остается расширенной. Необратимые изменения морфологически ассоциируются с выраженной вакуолизацией митохондрий, повреждением плазматических мембран и набуханием лизосом. Вслед за гибелью клетки ее компоненты прогрессивно разрушаются, и происходит выброс ферментов клетки во внеклеточное пространство. Умершие клетки образуют массы, состоящие из фосфолипидов в виде "миелиновых фигур", которые подвергаются фагоцитозу и разрушаются до жирных кислот. Проникновение ферментов сквозь поврежденную клеточную мембрану, а затем в сыворотку крови позволяет клинически определять параметры смерти клетки. Например, сердечная мышца содержит трансаминазы, лактатдегидрогеназу и креатинкина-зу. Повышение содержания этих ферментов в сыворотке крови является клиническим критерием инфаркта миокарда (смерти кардиомиоцитов). ■ Таким образом, основными признаками необратимости повреждения клетки служат невосстановимые повреждения митохондрий, приводящие к потере АТФ, а также развитие глубоких повреждений плазматических мембран, в основе которых лежит ряд биохимических механизмов. Во-первых, в некоторых ишемизированных тканях, например печени, необратимое ишемическое повреждение сопровождается заметным уменьшением содержания фосфолипидов в клеточной мембране, которое происходит под действием кальцийзависимых фосфолипаз. Во-вторых, активация протеаз, обусловленная повышением концентрации кальция в цитозоле, ведет к повреждению цито-скелета, выполняющего роль якоря между плазматической мембраной и внутренним содержимым клетки. В результате во время набухания клетки происходит отслойка клеточной мембраны от цитоскелета, что делает мембрану более податливой к растяжению и разрыву. В-третьих, при ишемии появляется небольшое количество высокотоксичных свободных радикалов кислорода. Итак, основными механизмами гибели клетки при гипоксии являются нарушение окислительного фосфорилирования, приводящее к недостаточности АТФ, повреждение мембран клетки, а важнейшим медиатором необратимых биохимических и морфологических изменений является кальций (схема 1). 23 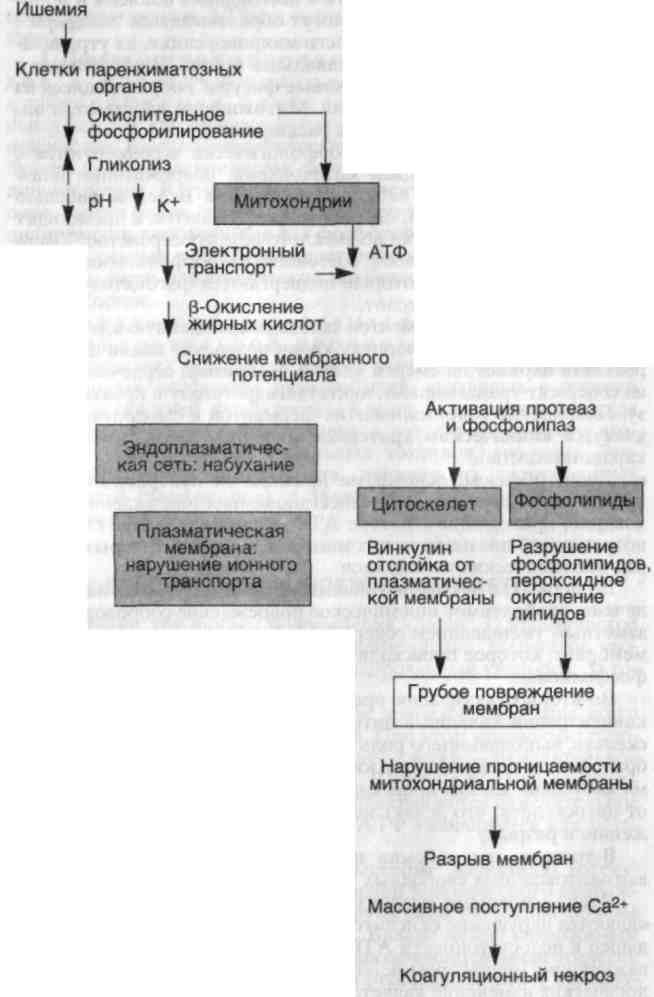 24 Схема 1. Механизм ишемического гипоксического повреждения клеток 2. Повреждение клетки, вызванное свободными радикалами кислорода. Чаще всего такое повреждение возникает под воздействием химических веществ, лучистой энергии, кислорода и других газов, а также при старении клеток, разрушении опухолей макрофагами и в некоторых иных случаях. Свободные радикалы представляют собой молекулы кислорода, имеющие один непарный электрон на внешней орбите. В таком состоянии радикал исключительно активен и нестабилен и вступает в реакции с неорганическими и органическими соединениями — белками, липидами и углеводами. Для повреждения клетки наибольшее значение имеют три реакции, в которые вступают свободные радикалы.
Свободные радикалы могут разрушаться спонтанно. Например, супероксидный анион-радикал является нестабильным соединением и спонтанно разрушается с образованием кислорода и пероксида водорода. Однако имеется несколько ферментных и неферментных систем, которые способствуют окончанию или инактивации свободнорадикальных реакций. Эндогенными или экзогенными антиоксидантами являются витамин Е; сульфгид-рилсодержащие соединения — цистеин и глютатион; белки сыворотки — альбумин, церулоплазмин и трансферрин. Полагают, что трансферрин действует как антиоксидант, связывая свободное железо, которое, как известно, может играть роль катализатора образования свободных радикалов. Среди ферментов выделяют супероксиддисмутазу, способную превращать супероксидный анион-радикал в пероксид водорода. 25 Каталаза, сосредоточенная в пероксисомах, разрушает пероксид водорода до кислорода и воды. При многих патологических процессах конечный результат действия свободных радикалов зависит от баланса между образованием свободных радикалов и их разрушением. 3. Токсическое повреждение. Примером такого повреждения является действие химических веществ, вызывающих повреждение клетки посредством одного из двух механизмов. Во-первых, часть водорастворимых соединений может действовать непосредственно, связываясь с некоторыми молекулами или органел-лами. Например, при попадании в организм хлорида ртути ртуть связывает сульфгидрильные группы клеточной мембраны и других белков, вызывая повышение проницаемости клеточной мембраны и торможение АТФаза-зависимого транспорта. В подобных случаях наиболее выраженные изменения наблюдаются в клетках, которые используют, абсорбируют, выделяют или концентрируют эти химические соединения. При попадании в организм хлорида ртути в наибольшей степени страдают клетки желудочно-кишечного тракта и почек. Цианид непосредственно воздействует на ферменты митохондрий. Многие противоопухолевые химиотерапевтические препараты, в том числе антибиотики, также вызывают повреждение клеток посредством цитоток-сического действия. Во-вторых, некоторые другие химические соединения, особенно жирорастворимые токсины, биологически неактивны и вначале превращаются в токсичные метаболиты, которые затем действуют на клетки-мишени. Хотя эти метаболиты могут вызывать повреждение мембран и клеток путем прямого ковалентно-го связывания с мембранными белками и липидами, наиболее важный механизм повреждения мембран включает образование реактивных свободных радикалов и последующее СПОЛ. МОРФОЛОГИЯ ПОВРЕЖДЕНИЯ КЛЕТОК В классической морфологии нелетальное повреждение клеток называется дистрофией (см. лекции 4—7). В большинстве случаев она относится к обратимым повреждениям. Некроз наряду с апоптозом является одним из двух морфологических выражений смерти клетки (см. лекцию 8). Апоптоз ответствен за многочисленные физиологические и патологические процессы, происходящие в организме. 26
10. Клеточная смерть, вызванная различными слабыми повреждающими воздействиями, которые в больших дозах приводят к гибели клетки (радиация, высокие или низкие температуры, ци-тотоксические противоопухолевые препараты и, возможно, гипоксия), также представляет собой апоптоз. Механизмы апоптоза. Апоптоз начинается скорее всего в результате действия гормонов и других трофических факторов и является регулятором плотности клеточной популяции. Кроме того, апоптоз может быть одним из механизмов удаления аномальных клеток или клеток, поврежденных токсинами, радиацией и другими воздействиями. Механизмы возникновения апоптоза различны и зависят от характера воздействия и типа клеток, однако последовательность событий, которые приводят к конечному результату, до конца не выяснена. Вместе с тем ряд механизмов уже установлен (схема 2). 27
дельта3- 28 интегрин, который обеспечивает фагоцитоз апоптозных нейтро-филов.
Апоптоз может быть также индуцирован под воздействием патологических стимулов. Некоторые из уже известных эффек-торных механизмов включают активацию эндонуклеазы, вызванную содержащимся в цитозоле кальцием и приводящую к фрагментации ДНК. Активация трансглютаминазы частично влияет на изменение формы и размеров клеток. Апоптоз заканчивается рецепторнозависимым фагоцитозом апоптозных телец. В некоторых случаях в индукции апоптоза участвуют транскрипция генов и синтез белка, а процесс апоптоза регулируется группой генов, которые участвуют в нормальном росте и дифферен-цировке клеток. СУБКЛЕТОЧНЫЕ ИЗМЕНЕНИЯ ПРИ ПОВРЕЖДЕНИИ КЛЕТОК Лизосомы содержат различные гидролитические ферменты — кислую фосфатазу, глюкуронидазу, сульфатазу, рибонук-леазу, коллагеназу и др. Эти ферменты синтезируются в гранулярной (шероховатой) эндоплазматической сети и затем "упаковываются" в пластинчатом комплексе (аппарат Гольджи). На этой стадии их называют первичными лизосомами; они сливаются с окруженными мембраной вакуолями, которые содержат продукты переваривания, и образуют фаголизосомы. Лизосомы участвуют в утилизации фагоцитированного материала посредством гетеро- и аутофагии. 29 Гетерофагия — феномен, посредством которого материал извне захватывается клеткой с помощью эндоцитоза. Поглощение частиц называется фагоцитозом, а растворенных мелких макромолекул — пиноцитозом. Гетерофагия характерна для фагоцитирующих клеток, таких как нейтрофилы и макрофаги. В качестве примеров гетерофагоцитоза можно привести поглощение бактерий нейтрофильными лейкоцитами и удаление апоп-тозных клеток и телец макрофагами. Слияние фагоцитозной вакуоли с лизосомой заканчивается растворением захваченного материала. Аутофагия характеризуется тем, что при ней внутриклеточные органеллы и порции цитозоля вначале отделяются от цитоплазмы в аутофагические вакуоли, образованные из свободных от рибосом мембран гранулярной эндоплазматической сети, которые затем сливаются с первичными лизосомами или элементами пластинчатого комплекса, образуя аутофаголизосому. Аутофагия — распространенный феномен, направленный на удаление разрушенных органелл поврежденной клетки. Он особенно выражен в клетках, атрофирующихся в результате недостаточного питания или гормональной инволюции. Ферменты лизосом способны разрушать большинство белков и углеводов, но некоторые липиды все равно остаются непереваренными. Лизосомы с непереваренными остатками встречаются в клетках в виде остаточных телец. Например, гранулы пигмента липофусцина представляют собой непереваренный материал, который образовался после внутриклеточного СПОЛ. Некоторые нерастворимые пигменты, такие как частицы угля, попадающие из атмосферы, или пигмент, вводимый при татуировке, могут находиться в фаголизосомах макрофагов десятилетиями. В лизосомах накапливаются также вещества, которые клетки не могут адекватно метаболизировать. При врожденных лизо-сомных болезнях накопления, для которых характерен дефицит ферментов, разрушающих различные макромолекулы, происходит ненормальное накопление этих веществ в лизосомах клеток всего тела, особенно в нейронах, приводя к тяжелым аномалиям. Дисфункция митохондрий играет важную роль при остром повреждении клетки. Различные изменения количества, размеров и формы митохондрий отмечаются в патологических условиях. Например, при гипертрофии и атрофии наблюдается соответственно увеличение и уменьшение количества митохондрий в клетках. Митохондрии могут быть очень крупными и принимать различную форму (мегамитохондрии), например, в случае алкогольной болезни печени. При некоторых врожденных метаболических заболеваниях скелетных мышц — митохон-дриальных миопатиях — дефекты метаболизма митохондрий со- 30 четаются с увеличением их количества, причем митохондрии часто бывают необычно крупными, имеют аномальные кристы и содержат кристаллоиды. Кроме того, некоторые опухоли (слюнных желез, щитовидной и околощитовидных желез, почки) состоят из клеток с множеством вытянутых митохондрий. Аномалии цитоскелета встречаются при различных патологических состояниях. Эти аномалии делятся на дефекты функций клетки (локомоторная и движение внутриклеточных органелл) и накопление фибриллярного материала внутри клетки. Функционирующие миофиламенты и микротрубочки необходимы для различных стадий миграции лейкоцитов и фагоцитоза. Поэтому именно недостаточностью цитоскелета обусловлены некоторые дефекты движения лейкоцитов в ответ на повреждающие стимулы или неспособность таких клеток осуществлять адекватный фагоцитоз. Например, дефект полимеризации микротрубочек при синдроме Чедиака — Хигаси вызывает замедленное слияние лизосом с фагосомами в лейкоцитах, нарушая таким образом фагоцитоз бактерий; в цитоплазме лейкоцитов появляются крупные аномальные лизосомы. Некоторые лекарственные препараты, такие как цитохалазин В, тормозят функцию миофиламентов и таким образом нарушают фагоцитоз. Дефекты в организации микротрубочек могут тормозить подвижность сперматозоидов, вызывая стерильность у мужчин, а также приводить к неподвижности ресничек дыхательного эпителия, что препятствует очищению дыхательных путей от бактерий и способствует развитию бронхоэктазов. При некоторых типах повреждений клеток наблюдается накопление промежуточных филаментов. Например, тельца Мал-лори, или алкогольный гиалин, представляют собой эозинофиль-ные интрацитоплазматические включения в клетках печени, которые характерны для алкогольной болезни. Эти включения состоят главным образом из промежуточных филаментов. Нейро-фибриллярные включения в мозге при болезни Альцгеймера содержат белки и нейрофиламенты из микротрубочек и отражают повреждение цитоскелета нейронов. СТАРЕНИЕ КЛЕТОК Несмотря на универсальность, процессу старения трудно дать четкое определение. С возрастом происходят физиологические и структурные изменения почти во всех системах органов. При старении имеют большое значение генетические и социальные факторы, характер питания, а также связанные с возрастом болезни — атеросклероз, сахарный диабет, остеоартроз. Повреждения 31 клеток, обусловленные возрастом, также являются важным компонентом старения организма. С возрастом прогрессивно страдает ряд функций клеток. Снижается активность окислительного фосфорилирования в митохондриях, синтеза ферментов и рецепторов клеток. Стареющие клетки обладают сниженной способностью к поглощению питательных веществ и восстановлению хромосомных повреждений. К морфологическим изменениям в стареющих клетках относятся неправильные и дольчатые ядра, полиморфные вакуолизирован-ные митохондрии, уменьшение эндоплазматической сети и деформация пластинчатого комплекса. Одновременно происходит накопление пигмента липофусцина. Старение клеток является многофакторным процессом. Он включает эндогенные молекулярные программы клеточного старения, а также экзогенные влияния, приводящие к прогрессирующему вторжению в процессы выживаемости клеток. Феномен клеточного старения интенсивно изучается в опытах in vitro. Показано, что в стареющих клетках происходит активация специфических для старения генов, повреждаются гены — регуляторы роста, стимулируются ингибиторы роста, а также включаются и другие генетические механизмы. Предполагают, что генные дефекты могут быть обусловлены телометрическим укорочением хромосом. Теломеры играют важную роль в стабилизации терминальных порций хромосом и прикреплении их к ядерному матриксу. Например, длина теломе-ров уменьшается в последних пассажах культуры клеток и в культуре клеток людей старческого возраста. Обнаружена связь между длиной теломера и активностью теломеразы. Приобретенные повреждения клеток при старении возникают под действием свободных радикалов. Причинами этих повреждений может быть воздействие ионизирующей радиации или прогрессирующее снижение активности антиоксидантных механизмов защиты, например витамина Е, пероксидазы глютатиона. Повреждение клетки свободными радикалами сопровождается накоплением липофусцина, однако сам по себе пигмент не токсичен для клетки. Кроме того, СПОЛ и свободные радикалы вызывают повреждение нуклеиновых кислот как в ядре, так и митохондриях. Мутации и уничтожение митохондриальной ДНК с возрастом становятся просто драматическими. Свободные радикалы кислорода катализируют также образование модификаций белков, включая ферменты, делая их чувствительными к повреждающему действию нейтральных и щелочных протеаз, содержащихся в цитозоле, что ведет к дальнейшему нарушению функций клетки. Посттрансляционные изменения внутриклеточных и внеклеточных белков также возникают с возрастом. Одна из разновид- 32 ностей таких изменений — неферментное гликозилирование белков. Например, связанное с возрастом гликозилирование белков хрусталика лежит в основе старческой катаракты. Наконец, имеются данные о нарушении образования стрес-сорных белков in vitro у экспериментальных животных при старении. Образование стрессорных белков — важнейший механизм защиты от различных стрессов. |