Навчальнометодичний посібник з дисципліни Біологічна хімія
 Скачать 1.66 Mb. Скачать 1.66 Mb.
|
|
Гормони підшлункової залози Основна маса (60-70 %) острівкової тканини підшлункової залози - це β-клітини, які продукують інсулін. В α-клітинах утворюється глюкагон; d-клітини секретують соматостатин (регулює вивільнення інсуліну і глюкагону), секретин (стимулює екзокринну функцію підшлункової залози) та інші. Інсулін Інсулін - це дволанцюговий поліпептид, який складається з 51 амінокислотного залишку і має молекулярну масу 6 кДа. Короткий ланцюг А містить 21 залишок амінокислот, ланцюг В - 30 залишків. Ці ланцюги з’єднані двома дисульфідними містками. Інсулін синтезується у вигляді препрогормону - препроінсуліну. У результаті відщеплення від препроінсуліну N-кінцевої сигнальної послідовності утворюється проінсулін, який має таку будову:    А-ланцюг С-пептид1 В-ланцюг Далі в результаті ферментативних перетворень вирізається С-пептид і утворюється біологічно активна молекула інсуліну, в якій В- і А-ланцюги з’єднані двома S-S-зв’язками. Інсулін секретується у кров, де його період напівжиття становить 3-5 хв. Процеси біосинтезу і секреції - це енергозалежні процеси. Крім того, в стимуляції біосинтезу бере участь цАМФ, який утворюється з АТФ у β-клітинах. Аденілатциклаза, яка каталізує цю реакцію, є важливою в системі відповіді β-клітин на підвищення концентрації глюкози в крові. Крім глюкози секрецію інсуліну стимулюють фруктоза, маноза, рибоза, амінокислоти (лейцин, аргінін, лізин), вільні жирні кислоти, кетонові тіла, глюкагон, секретин; навпаки, адреналін і норадреналін блокують його секрецію. Метаболічні перетворення інсуліну відбуваються в печінці, нирках і плаценті. Основний фермент, який інактивує інсулін - інсуліназа. Залежність від інсуліну різних тканин неоднакова. ЦНС, наднирники, гонади, око - це інсуліннезалежні - вони поглинають глюкозу з крові незалежно від концентрації інсуліну. М’язи, адипоцити, сполучна тканина, клітини крові, імунної системи - інсулінзалежні. Печінка, нирки, серце і деякі інші органи мають середнє значення інсулінзалежності. Біологічна дія інсуліну Інсулін задіяний в регуляції практично всіх видів обміну - метаболізму вуглеводів, ліпідів і білків. Вплив на обмін вуглеводів Регуляторна дія інсуліну призводить до зниження концентрації глюкози в крові - це гіпоглікемічний гормон. Механізмів, які беруть участь в зниженні рівня глюкози, декілька: 1. Інсулін стимулює поглинання глюкози тканинами (жировою тканиною, м’язами тощо). Виключенням є печінка: інсулін не має прямої дії на проникнення глюкози в гепатоцити. Стимуляція транспорту глюкози через мембрани відбувається за рахунок підвищення кількості білків-переносників для глюкози (під дією інсуліну відбувається їх перенесення з цитозолю, де вони неактивні, на поверхню клітини). Це посилює процес полегшеної дифузії глюкози. У гепатоцитах інсулін не стимулює полегшеної дифузії глюкози, але її потік підсилюється непрямим шляхом. Інсулін індукує синтез глюкокінази. Цей фермент каталізує фосфорилювання глюкози:   Глюкоза Глюкоза-6-фосфат Глюкоза Глюкоза-6-фосфатАТФ АДФ Таким чином, концентрація вільної глюкози в гепатоцитах дуже низька, що забезпечує проникнення глюкози шляхом простої дифузії по градієнту концентрації. 2. Інсулін стимулює внутрішньоклітинну утилізацію глюкози. Існує декілька шляхів: інсулін підсилює гліколіз за рахунок підвищення активності і кількості ключових ферментів цього процесу - глюкокінази/гексокінази, фосфофруктокінази, піруваткінази; інсулін бере участь в активації ферментів аеробного катаболізму глюкози - піруватдегідрогеназного і α-кетоглутаратдегідрогеназного комплексів. Це призводить до підсилення продукції АТФ; під дією інсуліну гальмується активність глюкозо-6-фосфатази - ферменту, який каталізує перетворення глюкозо-6-фосфату у вільну глюкозу. Цей фермент присутній у печінці (але не в м’язах). Таким чином глюкоза утримується в печінці (плазматична мембрана є непроникливою для глюкозо-6-фосфату); в жировій тканині інсулін стимулює аеробний катаболізм глюкози і пентозофосфатний шлях, які постачають субстрати для ліпогенезу (ацетил-КоА, НАДФН·Н+, АТФ, гліцерол-3-фосфат); у м’язах і печінці інсулін стимулює синтез глікогену шляхом активації глікогенсинтази. Паралельно гормон інгібує активність глікогенфосфорилази, яка є основним ферментом глікогенолізу. Активація глікогенезу і інгібування глікогенолізу забезпечується дією інсуліну на активність фосфодіестерази. Цей фермент каталізує розщеплення цАМФ. При зниженні концентрації цАМФ процес розпаду глікогену гальмується, а синтез глікогену активується; під дією інсуліну пригнічується глюконеогенез. Це відбувається за рахунок інгібування фосфоенолпіруваткарбоксикінази (ФЕПКК), яка каталізує перетворення оксалоацетату в фосфоенолпіруват. Інсулін інгібує транскрипцію гена, який кодує мРНК для ФЕПКК. Таким чином, вплив інсуліну на метаболізм глюкози полягає в стимуляції процесів, які направлені на зниження концентрації глюкози в крові (транспорт через плазматичні мембрани, катаболізм глюкози, глікогенез) і інгібування метаболічних шляхів, які продукують глюкозу (глікогеноліз, глюконеогенез). У результаті реалізується гіпоглікемічна дія інсуліну. Збільшення глюкози в крові  Звільнення інсуліну   Інсулін зв’язується з Інсулін зв’язується з рецептором клітин печінки рецепторами адипоцитів   Екзоцитоз і активація глікогенсинтази Збільшується активність  переносника глюкози переносника глюкози  Видалення глюкози з крові і  перетворення її в глікоген Збільшення використання глюкози перетворення її в глікоген Збільшення використання глюкозиРис. 12. Регуляція рівня глюкози в крові інсуліном Вплив на обмін ліпідів Інсулін має анаболічну дію на метаболізм ліпідів, що проявляється в стимуляції ліпогенезу і інгібуванні ліполізу. У жировій тканині активація ліпогенезу під впливом інсуліну зв’язана з стимуляцією катаболізму глюкози. Під впливом інсуліну в адипоцитах активуються аеробний катаболізм глюкози, який постачає ацетил-КоА, АТФ і діацилгліцерол (який перетворюється в гліцерол-3-фосфат) для синтезу ТАГ. Крім того, інсулін активує ключові ферменти ПФШ і, таким чином, продукцію НАДФН·Н+ для ліпогенезу. Інсулін також бере участь в активації ключового ферменту синтезу жирних - ацетил-КоА-карбоксилази. Поряд із стимуляцією ліпогенезу, інсулін є потужним інгібітором ліполізу в жировій тканині і печінці. Пригнічення гідролізу ТАГ відбувається в двох напрямках: активується фосфодіестераза, яка знижує концентрацію цАМФ (цАМФ запускає каскад ліполізу); активуються фосфатази, які дефосфорилюють гормончутливу ліпазу і цАМФ-залежну протеїнкіназу. У результаті ці ферменти переводяться в неактивний стан (ліполіз гальмується). Крім того, інсулін активує ліпопротеїнліпазу, яка каталізує гідроліз ТАГ в складі ЛПДНЩ з переходом жирних кислот в адипоцити. Така дія інсуліну призводить до зниження вмісту вільних жирних кислот в крові. Вплив на обмін білків Інсулін має анаболічну дію на обмін білків. Його ефекти в цьому виді обміну полягають в такому: стимулює поглинання міоцитами нейтральних амінокислот; впливає на синтез білків на рівні трансляції (насамперед, через синтез рРНК). Відомо, що інсулін впливає на кількість і активність близько 50 білків у різних тканинах. Як було вже зазначено, під дією інсуліну пригнічується або підсилюється синтез ключових ферментів низки метаболічних процесів. Так, під дією інсуліну знижується швидкість синтезу мРНК для ФЕПКК. Це не єдиний приклад. Інсулін впливає на синтез багатьох специфічних мРНК (у печінці, жировій тканині і в м’язах). Доведений вплив інсуліну на транскрипцію генів альбуміну. Механізм дії інсуліну Дія інсуліну починається з його зв’язування з специфічним глікопротеїновим рецептором на плазматичній мембрані (кількість рецепторів досягає 20000 на клітину). Після цього ефекти гормону можуть проявлятися або через декілька хвилин (вплив на транспорт субстратів, активність ферментів), або через декілька годин (вплив на синтез білка і нуклеїнових кислот). При функціонуванні рецепторів інсуліну існує цікавий ефект, який має назву інтерналізація. Вважають, що вона необхідна для регуляції кількості рецепторів на поверхні клітини. Інтерналізація відбувається після зв’язування інсуліну з рецептором і полягає в проникненні інсулін-рецепторного комплексу в клітину шляхом ендоцитозу. В умовах високого вмісту інсуліну в плазмі, наприклад при ожирінні, за рахунок саме інтерналізації кількість інсулінових рецепторів знижується і чутливість тканин-“мішеней” до інсуліну зменшується. Така “знижуюча” регуляція частково пояснює інсулінорезистентність при ожирінні і цукровому діабеті ІІ типу. Незважаючи на те, що механізми дії інсуліну вивчаються понад 60 років, природа внутрішньоклітинного сигналу, залишається невідомою. Вивчення сигнального механізму дії гормону привела до гіпотези про ключову роль аденілатциклазної системи в реалізації дії інсуліну. Сигнальний ланцюг має таку структуру: Рецептор → тирозинкіназа → Gi-білок → фосфатидилінозитол-3-кіназа → протеїнкіназа С → протеїнкіназа А За цією гіпотезою рецептор інсуліну поєднує властивості рецепторів і ферментів - тирозинкіназ. Домен рецептора, який знаходиться на поверхні клітини зв’язує гормон. Рецепторний домен через гідрофобний трансмембранний домен поєднаний з внутрішньоклітинною ділянкою рецептора. Внутрішньоклітинний домен є протеїнкіназою, яка забезпечує фосфорилювання білків за залишками тирозину - це тирозинкіназа. Аналогічну структуру мають рецептори пептидних факторів росту (ФРЕ - фактор росту епідермісу, ФРФ - фактор росту фібробластів, ТФР - тромбоцитарного фактора росту). Особливістю структури всіх цих рецепторів є наявність не менш як одного залишку Тир, який може аутофосфорилюватися, що є важливим в регуляції активності каталітичного домену. У ланцюгу, що був зображений вище і який ілюструє можливий механізм дії, важливим етапом є фосфорилювання фосфорилази С, яка запускає фосфоінозитидну систему вторинних посередників. Але остаточно питання про вторинні месенджери для інсуліну не з’ясовано. Існує точка зору, що рістстимулюючий ефект інсуліну реалізується через цАМФ таким чином. цАМФ, який утворюється, активує цАМФ-залежну протеїнкіназу. Активований фермент транспортується в ядро, де здійснює фосфорилювання і таким чином активацію фактора транскрипції GREB. Цей фактор індукує експресію цАМФ-залежних генів, що в результаті сприяє клітинній проліферації. Вважають, що цей механізм запускається через рецептор тирозинового типу. У інсулінчутливих клітинах є потужна антисигнальна система, яка здатна блокувати або зменшувати наслідки взаємодії інсуліну з рецептором. До неї належить білок, який синтезується в адипоцитах і клітинах імунної системи - кахексин. Цей білок знижує активність тирозинкінази в першу чергу в міо- і ліпоцитах. Деякі біохімічні аспекти цукрового діабету Цукровий діабет (ЦД) - це клінічний синдром, який зумовлений абсолютною або відносною інсуліновою недостатністю (інсулінзалежний цукровий діабет (ІЗД) - діабет І типу і інсуліннезалежний цукровий діабет (ІНЗД) - діабет ІІ типу). Особливості метаболізму у хворих на обидві форми ЦД мають значну кількість спільних рис тому, що зумовлені недостатньою дією інсуліну на клітини-“мішені”. Обмін вуглеводів при цукровому діабеті: Знижується кількість білка - переносника глюкози GluT4 на поверхні клітин - гальмується поглинання глюкози тканинами. У печінці, м’язах і жировій тканині знижується активність гексокінази (глюкокінази), що призводить до зниження концентрації глюкозо-6-фосфату. Це є одним з факторів пригнічення гліколізу і ПФШ. Гальмується активність ключових ферментів гліколізу і ПФШ. Підсилюється глікогеноліз і гальмується глікогенез, утворюється вільна глюкоза, яка надходить у кров. Активуються ферменти глюконеогенезу, що також сприяє підвищенню рівня глікемії. Знижується аеробний катаболізм глюкози. Результатом всіх вищевказаних змін є розвиток гіперглікемії. При підвищенні концентрації глюкози в крові до 8-10 ммоль/л (нирковий поріг) починається глюкозурія. Це викликає осмотичний діурез - у хворого розвивається поліурія (до 8-12 л/добу). Ліпідний обмін при діабеті При ЦД підсилюється ліполіз в жировій тканині, що є результатом переважної дії контрінсулярних гормонів. Вільні жирні кислоти (ВЖК) виходять в кров, де їх вміст вищий за норму. Надмірна кількість ВЖК надходить у печінку, тому при ЦД всіх типів це призводить до розвитку стеатозу (жирової інфільтрації печінки). При ЦД зменшується кількість антиатерогенних ЛПВЩ. У крові також знижується активність ліпопротеїнліпази, що може стати причиною розвитку гіперліпопротеїнемії І типу (гіперхіломікронемія) і гіперліпопротеїнемії V типу. Вторинні гіперліпопротеїнемії здатні прискорити розвиток атеросклерозу і панкреатиту. Зміни в ліпідному обміні сприяють підсиленню кетогенезу і зниженню утилізації кетонових тіл у позапечінкових тканинах. У результаті спостерігається розвиток кетонемії, кетонурії і кетоацидозу. Обмін білків при ЦД При ЦД знижується синтез білків, підсилюється їх катаболізм з використанням амінокислот, як субстратів для синтезу глюкози. Це призводить до негативного азотистого балансу, підсилення екскреції сечовини, розвитку гіпераміноацидурії і гіперазотурії. Гормони мозкового шару наднирників У хромафінній тканині мозкового шару наднирників утворюються катехоламіни (адреналін - 85%, норадреналін). Адреналін (епінефрин) - гормон, який секретується в наднирниках при стресі (концентрація його в крові зростає в 4-5 разів) і є медіатором в деяких синапсах. За хімічною будовою є катехоламіном (L-1(3,4-Діоксіфеніл)-2-метиламіноетанол). Адреналін міститься в різних органах і тканинах, у значних кількостях утворюється в хромафинної тканини, особливо в мозковій речовині надниркових залоз. Встановлено також, що при стресі вміст в крові норадреналіну, який має переважно медіаторні властивості також зростає. Катехоламіни синтезуються з амінокислоти тирозину. Перетворення тирозину в норадреналін і потім в адреналін має чотири послідовні етапи: Гідроксилювання кільця (тирозингідроксилаза). Декарбоксилювання (ДОФА-декарбоксилаза). Гідроксилювання бічного ланцюга (дофамін-бета-гідроксилаза-ДБГ). N-метилювання (фенілетаноламін-N-метилтрансфераза). Послідовність реакцій синтезу виглядає таким чином:         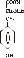 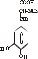    -ОН СО2 –ОН СН3 Тир ДОФА Дофамін Норадреналін Адреналін (діоксифенілаланін) Стадією, яка лімітує весь синтез є 1 - гідроксилювання Тир під дією тирозингідроксилази з утворенням ДОФА. У цьому ланцюгу реакцій також утворюється дофамін - катехоламін, який має переважно медіаторні властивості. Катехоламіни діють через два головні класи рецепторів: альфа-адренергічні і бета-адренергічні. Адреналін зв’язується з обома класами рецепторів. Норадреналін у фізіологічних концентраціях головним чином з альфа-рецептором. Біохімічні ефекти адреналіну Адреналін - це контрінсулярний гормон, дія якого спрямована насамперед на збільшення концентрації глюкози в крові. Крім того, цей гормон має катаболічну дію на обмін ліпідів. Вплив адреналіну на обмін вуглеводів полягає в стимуляції глікогенолізу в печінці і м’язах. Це досягається шляхом активації глікогенфосфорилази. У м’язах відбувається розщеплення глікогену до глюкозо-6-фосфату і далі до лактату. У м’язах розщеплення глікогену до глюкози не відбувається, тому що відсутня глюкозо-6-фосфатаза (яка розщеплює глюкозо-6-фосфат до глюкози). У печінці в результаті глікогенолізу утворюється вільна глюкоза, яка надходить у кров, що призводить до підвищення рівня глікемії. Це має велике значення для забезпечення інших тканин паливом в умовах стресу. Вплив адреналіну на обмін ліпідів полягає в стимуляції ліполізу в жировій тканині через активацію ключового ферменту цього процесу - ТАГ-ліпази. У результаті в крові підвищується вміст вільних жирних кислот, що є додатковим джерелом метаболічної енергії. Таким чином, сумарний біохімічний ефект адреналіну - це підготовка до ситуацій, в яких організм використовує значну кількість метаболічної енергії. В інактивації катехоламінів беруть участь два ферменти: моноамінооксидаза (МАО) - мітохондріальний фермент; катехол-О-метилтрансфераза - фермент цитозоля. Найбільша активність цих ферментів спостерігається в печінці і нирках. Визначення концентрації катехоламінів в крові є важливим діагностичним підтвердженням діагнозу феохромоцитом. Феохромоцитоми - це пухлини мозкового шару наднирників, які секретують катехоламіни у високих концентраціях. У 90 % випадків ці пухлини доброякісні. Як правило ці пухлини секретують адреналін і норадреналін, але переважно норадреналін. Дуже рідко переважаючим катехоламіном є дофамін (для злоякісних пухлин). Крім катехоламінів ці пухлини можуть продукувати серотонін, АКТГ, соматостатин, опіоїдні пептиди, кальцитонін та інші, що перешкоджає встановленню діагнозу. Для феохромоцитом характерні гіперглікемія і глюкозурія, порушується толерантність до глюкози. Механізм дії адреналіну Адреналін - це гормон, для якого було вперше встановлено наявність мембранно-цитозольного механізму дії. При дії гормону на α2- і β-адренорецептори активується аденілатциклаза і синтезується цАМФ - вторинний посередник адреналіну, який запускає каскад метаболічних змін. У разі зв’язування адреналіну з α1-адренорецептором активується фосфоінозитидний механізм, в якому роль месенджерів виконують ІТФ, ДАГ і Са2+. Мозковий шар наднирників також продукує деякі нейропептиди - нейротензин, мененкефалін, β-ендорфін. |
