нейропротекторы растительного происхождения и механизм их действия. НЕЙРОПРОТЕКТОРЫ РАСТИТЕЛЬНОГО ПРОИСХОЖДЕНИЯ И МЕХАНИЗМ ИХ ДЕЙСТВ. Нейропротекторы растительного происхождения и механизм их действия
 Скачать 1.51 Mb. Скачать 1.51 Mb.
|
|
ГЛАВА 2 ОБЗОР РАСТЕНИЙ КАК ПЕРСПЕКТИВНОГО СЫРЬЯ ДЛЯ СИНТЕЗА НЕЙРООПРОТЕКТОРОВ Гинго Билоба Среди лекарственных средств, зарекомендовавших себя в качестве эффективных нейропротекторов, особое место занимают препараты на основе экстракта гинкго билоба (танакан, мемоплант, билобил, гинкогинк)(рис.2). Благодаря наличию богатого комплекса биологически активных веществ (БАВ) экстракт гинкго билоба оказывает противоапоптозный, антиоксидантный, ноо-тропный, вазодилатирующий, антиагрегантный, противоишемический, противогипоксический, адаптогенный, стресс-протективный эффекты, что обусловливает широкое применение экстракта гинкго билоба в т.ч. и при заболеваниях центральной нервнойсистемы(ЦНС). Экспериментально установлено, что терапевтическое применение экстракта гинкго билоба препятствует накоплению концентрации ДК как в левом, так и в правом полушариях мозга, снижая данный показатель на 35,6% и 55,7% соответственно относительно контрольных опытов. При анализе накопления вторичных продуктов ПОЛ в мозге и в эритроцитах выявлено, что экстракт гинкго билоба не влияет на образование ТБК-активных продуктов относительно контрольной группы животных. Установлено также, что в опытах с экстрактом гинкго билоба увеличение активности фермента, обезвреживающего перекись водорода, была существенно ниже увеличения активности фермента, инактивирующего супероксидный анион. Так, терапевтическое введение животным экстракта гинкго билоба повышает активность каталазы на 42,6%, а супероксиддис-мутазы - на 320,5% относительно контрольной серии опытов. Таким образом, проведенное исследование свидетельствует о способности экстракта гинкго билоба мобилизировать защитные системы организма при ишеми-ческих повреждениях мозга. Следует отметить, что полученные нами результаты о влиянии экстракта гинкго билоба на процессы ПОЛ согласуются исследованиями других авторов. Анализируя полученные данные о влиянии экстракта гинкго билоба на изменение концентрации общего белка в плазме крови установлено, что применение экстракта гинкго препятствует гипопротеинемии, угнетая выраженность данного процесса относительно контрольных опытов на 14,5 % в артериальной и 17,8% в венозной крови. Экспериментально также показано, что в группе животных, которым вводили экстракт гинкго билоба, наблюдается ограничение «гипокальцие-мии» в артериальной пробе и отсутствие существенных отличий со стороны данного показателя в венозной пробе (рисЛ4). Но терапевтическое применение экстракта гинкго билоба в условиях ишемии мозга не оказывает значи- мого влияния на уровень средних молекул в плазме животных в сравнении с группой животных без лечения (рис.14). Установлено что введение экстракта гинкго билоба способствует ограничению гипергликемии в артериальной и венозной крови, снижая данный показатель относительно контрольных животных соответственно на 17,4% и 15,9%. При анализе влияния экстракта гинкго билоба на содержание молочной кислоты в условиях ишемии мозга установлено, что экстракт гинкго способствует повышению концентрации лактата на 18,8% в артериальной крови, а в венозной крови изменений уровня данного метаболита глюкозы относительно контрольных животных не выявлено. Экспериментально показано, что в условиях ишемического повреждения мозга применение экстракта гинкго билоба способствует повышению утилизации лактата мозгом на 11,6% относительно контроля. Вместе с тем, статистически значимых изменений со стороны утилизации глюкозы и пирувата мозгом не выявлено. Исследование эффективности совместного применения экстракта гинкго билоба и циннаризина на показатели метаболизма мозга при церебральной ишемии. Введение животным циннаризина в условиях ишемии мозга способствует снижению накопления первичных продуктов ПОЛ в правом полушарии мозга на 30,7%, и увеличению содержания данных продуктов пероксидации в левом на 33,3%. Совместное применение циннаризина с экстрактом гинкго билоба способствует снижению накопления ДК в обоих полушариях мозга. Так содержание исследуемых продуктов ПОЛ в левом полушарии было на 28,1%, а в правом - на 41,3% ниже, чем в контрольных опытах. 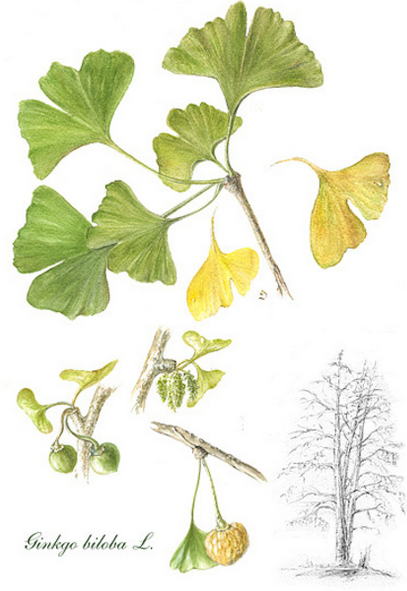 Рисунок 2−Гинко Билоба 2.2 Comarum palustre L. — сабельник болотный (побеги, корневища и корни) В современной медицинской практике широко применяется лекарственное растительное сырье сабельника болотного (корневище с корнями, трава) (рис.2). На их основе выпускают биологически активную добавку (БАД) «Сабельник-Эвалар» (настойка, таблетки, крем, капли), которая рекомендована Минздравом РФ в качестве общеукрепляющего средства при повышенных нагрузках на опорно-двигательный аппарат. Xимический состав сабельника болотного представлен полифенольным комплексом, в котором преобладают дубильные вещества, главным образом конденсированные. Конденсированные дубильные вещества – линейные полимерные производные катехи-нов, лейкоантоцианидинов и других восстановленных форм флавоноидов. Как правило, представляют собой линейные полимеры, отдельные мономеры (катехины и лейкоантоциа-нидины, соединенные С2-С6 связью) которых способны к ограниченному вращению вокруг соединяющей их связи, в результате чего молекула может приобретать стабильную спи-ральную конформацию с фенольными гидроксилами, расположенными по периферии такой спирали. Помимо высокополимерных, в растениях также содержатся олигомерные производные проантоцианидинов со степенью полимеризации 1-10. В список продуктов питания, богатых мономерными катехинами, входят виноград, клюква, яблоки, бобы, оболочки арахиса, пшеница, ячмень, какао и изделия из него, кофе, чай всех видов, особенно черный. Катехины семян винограда обладают антиоксидантной активностью в водной фазе: снижают интенсивность свободнорадикального окисления липопротеинов низкой плотно-сти у больных ишемической болезнью сердца, замедляют липосомальное окисление. Известен способ выделения катехина, заключающийся в экстракции этилацетатом водной фракции, полученной флэш-хроматографией на тальке. Недостатком данного способа является необходимость проведения сорбции, совмещенной с флэш-хроматографией, образование эмульсии при экстракции из водного раствора, невысокая степень очистки этилацетатом. Существует способ, при котором выделяют катехин из бутанолрастворимых фракций этилацетатных экстрактов методом колоночной хроматографии. Недостатком способа является его длительность (около 3 суток), невысокая степень очистки этилацетатом, выполнение анализа сопряжено с применением таких токсических растворителей как этилацетат, бутанол, хлороформ и метанол.  Рисунок 3−Сабельник болотный 2.3 Лабазник Вязолистный Filipcndula ulmaria (L.) Maxim (лабазник вязолистный, таволга) (рис.4) издавна используется в официальной и народной медицине для лечения широкого спектра заболеваний. Растение имеет значительный ресурсный потенциал на территории России и большую вегетативную массу, что подтверждают всесторонние ресурсные исследования, проведенные в последние годы в Ярославской, Тверской, Псковской н Ленинградской областях. Широко распространен лабазник вязолистный и на территории Красноярского края. Химический состав растений рода Filipendula достаточно хорошо изучен. Отмечается, что в цветках F. ulmaria обнаружены азотсодержащие соединения, в надземной части - фенолокислоты, флавоноиды, содержание которых варьирует в зависимости от места произрастания, танины, кумарины, катехины и халконы, а также алкалоиды, полисахариды, витамины и аминокислоты [11-18]. F. ulmaria относится к перспективным эфирномасличным растениям. В его цветках содержится 0,2- 1.25% эфирного масла, компонентный состав которого на протяжении ряда лет был объектом изучения многих исследований. Полученные результаты зависели как от места произрастания растения, так и от приборной базы анализа органических соединений, доступных на тот или иной период исследования. С открытием газовой хроматографии (после 1950-х гг.) и тем более с появлением хроматомасс-спектрометрического анализа (с середины 1970-х гг.) появилась возможность однозначной идентификации компонентов эфирного масла по линейным индексам удерживания и масс-спектрам веществ с содержанием 0,01% от суммы всех компонентов масла. Наибольшее количество эфирного масла в растении отмечается в период массовой бутонизации до конца цветения (исследования 2010 г.). Образцы полученных масел представляют собой легкоподвижные жидкости тяжелее воды интенсивно синего цвета, свидетельствующего о наличии, по всей видимости, хамазулена. Действительно, в электронных спектрах поглощения имеются характерные для хамазулена полосы поглощения при 732, 660 и 605 нм. Эфирное масло надземной части растения, собранной в фазу цветения, полностью застывает при температуре 18-20°С. Хромато-масс-спектрометрический анализ образцов эфирного масла F. ulmaria позволил установить наличие более 100 компонентов, 66 из которых являются известными соединениями и нами идентифицированы. Содержание более чем 30 компонентов составляет меньше 0,1%. Установлено, что состав эфирного масла в процессе развития растения претерпевает ряд качественных и количественных изменений, однако во все исследованные фенофазы обнаруживались салициловый альдегид и метилсалицилат. Практически во всех образцах масла присутствуют бориил-ацетат, минтсульфид, кариофиллен, гумулен, фитол, трикозан и хамазулен. Содержание хамазулена в масле практически не изменяется на протяжении всего периода развития растения и составляет 1,7-1,9%, в эфирном масле надземной части, собранной в фазе плодоношения, его содержание уменьшается до 0,4%. Именно хамазулен придаст синюю окраску эфирному маслу F. ulmaria. 2.4 Гравилат речной Одним из таких растений флоры России является Гравилат речной (Geum rivale L.) [4], который давно используется в народной медицине как противовоспалительное, вяжущее и ранозаживляющее средство [2]. Предварительные химические исследования Г. речного выявили в сырье (траве и корневищах с корнями), наличие полифенолов [10-12], для которых характерна противовоспалительная, вяжущая и ранозаживляющая активность [8]. Считают, что для медицинской практики наиболее ценны танниды пирогаллового ряда [6, 7], и соотношение между фракциями пирогалловых и пирокатехиновых производных характеризует терапевтическую ценность таннидоносных растений. В качестве сырья изучали надземную часть – траву (стебли, листья и цветки) и подземную часть (корневища с корнями) Г. речного. Идентификацию сырья проводили с учетом комплекса морфологических особенностей, которые оценивали макро- и микроскопически. Разделение таннидов на фракции проводили по методу для таннидов чая. В полученном экстракте определяли содержание производных пирогаллола и пирокатехина. Разделение таннидов на осаждаемые и неосаждаемые сульфатной кислотой концентрированной. Известно, что минеральные кислоты осаждают без нагревания наиболее конденсированные (пирокатехиновые) танниды. Приведенные данные свидетельствуют, что во всех частях Г. речного преобладает фракция дубильных веществ, неосаждаемая сульфатной кислотой концентрированной. Содержание данной фракции в % на воздушно-сухое вещество выявлено в корнях – 9,12; корневищах – 16,0; листьях – 7,05; стеблях – 2,23; причем, исследуемая фракция в подземной части (корневище с корнями) 10,2; доминирует над всей надземной частью (стебли и листья) 6,2 соответственно. Эта фракция представляет конденсированные танниды, относящиеся к производным пирогаллового ряда, наиболее ценным для использования в медицине. Фракция конденсированных веществ осаждается неполностью сернокислым аммонием, что указывает, по – видимому, на ее неоднородность. Определено количественное содержание таннидов в сырье Г. речного, а именно: в корнях – 11,35; корневищах – 21,85; листьях– 9,3; стеблях – 4,56; причем общее содержание таннидов в подземной части (корневище с корнями) 15,15 преобладает над всей надземной частью (стебли и листья) 6,56 соответственно. Проведенные исследования указывают, что на основании полученных результатов сырьё (корневище с корнями) Г. речного является наиболее перспективным для химического и фармакологического изучения и в дальнейшем может быть использовано при разработке препаратов нейропротекторного действия.  Рисунок 4−Лабазник вязолистный  Рисунок 5−Гравилат речной 2.5 Шлемник байкальский Шлемник байкальский (семейство Губоцветные) – это растение, иногда упоминаемое как хуан цинь или корень шлемника (по отношению к корню) и используемое в традиционной китайской медицине а также в качестве нейропротективного/улучшающего когнитивный процесс вещества. Шлемник байкальский представляет собой компонент многих комплексных методов лечения (традиционной китайской медицины), включающих Гэр-Гэнь-Чинь-Лянь-Тан (ризом коптиса китайского наряду с корнями Пуэрии лопастной, Лакрицы и шлемника байкальского), Сошихо-тан (Володушка серповидная, лакрица, Женьшень обыкновенный, Имбирь, Зисифус ююба и Пинеллия тройчатая с шлемником байкальским), а также шуанхуанглянь (плоды форзиции и жимолость с шлемником байкальским). Химический состав шлемника байкальского представлен: байкалин (байкалеин-7-глюкуронид) и его агликон байкалеин, а также другие гликозиды, известные как байкалеин-7-O-глюкозиды3); вогонозид (вогонин-7-глюкуронид) и его агликон вогонин, а также другие гликозиды, известные как вогонин-5-O-глюкозиды; ороксилин A (5,7-дигидрокси-6-метоксифлавон) и его 7-O-глюкозид; необайкалеин; скутеллярин и изоскутеллярин; хризин; висцидулин I и висдулин III; скуллкапфлавон I[13] и II (2R,3R)-2′,3,5,6′,7-пентагидроксифлаванон5, (2S)-5,7,2′,6′-тетрагидроксифлаванон, (2S)-5,7-дигидрокси-6-метоксифлаванон, 5,7,2'-тригидрокси-6,8-диметоксифлавон (K36), 6,2′-дигидрокси-5,7,8,6′-тетраметоксифлавон, 5,7,4′-тригидрокси-8-метоксифлавон; апигенин (как 6-C-глюкозид 8-C-арабинозид), лютеолин и 6-гидроксилютеолин, картамидин (как 7-O-глюкуроновая кислота) и изокартамидин-7-O-глюкуроновая кислота. Флавоноиды вогонин и байкалеин (а также их гликозиды) обычно рассматриваются в качестве основных активных компонентов шлемника байкальского, хотя в нем присутствуют и другие уникальные флавоноиды (под названием ороксилин A и K36), которые определяют некоторые полезные эффекты растения. Большая часть других биологически активных веществ либо представлена в маленьком количестве и обладает недостаточной силой действия, чтобы считаться активной, либо представляет собой широко распространенные структуры, присутствующие во многих растениях. Основные биологически активные вещества представлены в больших количествах в корнях, и отсутствуют на верхнем уровне надземных частей (стебель и лепестки). В связи с высокой концентрацией биологически активных веществ, основной используемой частью растения является корень. Байкалеин сам по себе хорошо абсорбируется, хотя он незамедлительно глюкуронидируется, и глюкуронид байкалеина возвращается в полость клетки (на основную стенку модели Caco-2). Вогонин и ороксилин A обладают одинаково хорошей абсорбируемостью изначально, в то время как глюкуронидированный байкалеин выводится и не подвергается обратному всасыванию. Выведение байкалеина и других флавоноидов (вогонин и ороксилин A) задействует белки множественной лекарственной резистентности (MRPs) и ингибитор MK571 (ингибитор MRP1), способные блокировать абсорбцию. P-гликопротеин не задействован в абсорбции этих флавоноидов. Хотя флавоноиды (байкалеин наиболее хорошо изучен) достаточно хорошо исследованы, они скоротечно метаболизируются и затем выводятся в кишечник, при этом продукты их метаболизма не подвергаются обратному всасыванию. В кишечной микрофлоре байкалин метаболизируется в байкалеин (посредством удаления группы глюкуронида), так как ослабление кишечной микрофлоры изменяет кинетику флавоноида. В некоторой степени может наблюдаться абсорбирование гликозидов (байкалин, вогонозид и т.д.) в толстом кишечнике после гидролиза кишечными бактериями. Прием флавоноидов по отдельности в дозе 5 мг/кг проявил сравнительно быстрое абсорбирование и пиковые значения, при этом измеренные значения Tmax равнялись 5.00 мин (байкалин), 12.0+/-10.4 мин (вогонин) и 4.33+/-1.15 мин (ороксилин A), и достигались соответственно значения Cmax в 1.10+/-0.49 мкг/мл (байкалин), 0.57+/-0.14 мкг/мл (вогонин) и 0.24+/-0.08 мкг/мл (ороксилин A).[22] В то время как ороксилин A обладает коротким периодом полувыведения (38.8 мин), два другие соединения имеют более замедленный период полувыведения (102-155 мин). При приеме комплекса флавоноидов, ороксилин A продемонстрировал повышение итоговой средней концентрации в моче до 170%, в то время как значения средней концентрации в моче для байкалина и вогонина снизились до 24% и 11.6%. Предполагается, что это связано с ферментами метаболизма (глюкуронизации), конкурирующих из-за питательной среды и, вероятно, обладающими меньшей аффинностью для ороксилина A, так как отсутствовало явное ингибирование на уровне транспортировщиков.9) Поскольку каждый флавоноид абсорбируется по-своему, предполагается, что введение множества флавоноидов снизит скорость метаболизма (возможно, с помощью агрессивных средств). Ороксилин A обладает более высокой средней концентрацией в моче в этих случаях, возможно за счет меньшей аффинности для ферментов (которые скорее метаболизируют байкалин и/или вогонин). Прием растительного сырья в качестве отвара в дозе 8мл/кг (байкалин 21.1 мг/мл, вогонозид 1.88 мг/мл, байкалеин 9.72 мг/мл, вогонин 8.22 мг/мл, ороксилин A 0.62 мг/мл и хризин 0.23 мг/мл) сопровождался двухуровневой абсорбцией с максимумом спустя 45 минут (что, предположительно, связано с прямым поглощением) и меньшим максимальным значением спустя 8-12 часов (возможно, в связи с ферментацией в толстом кишечнике). Пиковые значения, достигнутые в этом исследовании, были зарегистрированы для байкалеина (Cmax в 2228+/-463 нг/мл при Tmax в 0.23+/-0.09 ч), байкалина (13306+/-2626 нг/мл при 0.30+/-0.07 ч), вогонозида (816.4+/-144.9 нг/мл при 0.60+/-0.15 ч), вогонина (2526+/-378 нг/мл при 0.33+/-0.20 ч), ороксилина A (471.6+/-115.4 нг/мл при 0.20+/-0.07 ч) и хризина (90.22+/-19.55 нг/мл при 0.40+/-0.15 ч). Другие исследования подтвердили в некоторой степени близкие максимальные значения в крови для основных трех флавоноидов после перорального приема крысами10), использовался стандартизированный экстракт PF-2405. Прием корня растения приводит к повышению уровней в сыворотке всех биологически активных веществ, при этом максимальные значения флавоноидов достигают низкого микромолярного (мкм) диапазона. Метаболизм: байкалеин не подвергается гидроксиляции фазы I метаболизма в печени или кишечных микросомах. За счет того, что байкалин, вогонин и ороксилин A первоначально связываются с их гликозидами, они также могут быть объединены ферментами 5'-дифосфо-глюкуронозилтрансферазы (UGT) или сульфотрансферазы (SULT) в печени. Байкалин наиболее быстро соединяется UGT1A8 и 1A9, хотя все они за исключением 1A3 и 1A7 активны в преобразовании байкалина в глюкуронид байкалина. Флавоноиды подвергаются немедленной глюкуронизации, которая является основным путем метаболизма. Скорость объединения меньше, если принимаются сразу три основных флавоноида, по сравнению с приемом по отдельности, что предположительно связано с конкуренцией между глюкуронизирующими ферментами. В других исследованиях (байкалин в отдельности) было отмечено, что максимальная скорость метаболизма достигалась при 10 микромоль, при этом более высокие концентрации продемонстрировали низкую скорость, что свидетельствует о пределе насыщения.11) Так как все три основных флавоноида подвергаются глюкуронизации, скорость глюкуронизации флавоноидов в отдельности меньше, чем когда они принимаются одновременно. Нейронная кинетика. Байкалин способен преодолевать гематоэнцефалитический барьер (в дозе 24 мг/кг), при этом концентрация в спинномозговой жидкости достигала 344.235+/-71.406 мкг/л (27% концентрации в сыворотке). Байкалин в крови может преодолевать гематоэнцефалитический барьер, хотя его концентрация в головном мозге и крови не одинакова. Ороксилин A способен ингибировать транспортировщик P-гликопротеина (P-gp) в диапазоне доз 5-40 микромоль. Эффективность наблюдалась при приеме дозы 50 мг/кг крысами, изменяя фармакокинетику паклитаксела.12) Ороксилин A в высоких пероральных дозах представляет собой ингибитор P-гликопротеина. Компоненты шлемника байкальского взаимодействуют с АМФ-зависимой киназой (AMPK), белком, вовлеченным в энергетический обмен, и основной мишенью для берберина и метформина. АМФ-зависимая киназа регулируется белками LKB1 (прямое фосфорилирование, чувствительный к АДФ:АТФ) и CaMKKβ (внутриклеточное всасывание кальция, нечувствительный к АДФ:АТФ). Байкалин (гликозид) сохраняет уровень АМФ-зависимой киназы в печени, когда вводится внутрибрюшинно в дозе 80 мг/кг, что считается причиной устранения прироста массы при рационе с высоким содержанием жиров (рацион с высоким содержанием жиров способен снижать фосфорилирование АМФ-зависимой киназы). Было обнаружено, что АМФ-зависимая киназа активируется байкалином в диапазоне концентрации в 5-10 микромоль, и это связано скорее с CaMKKβ, чем с LKB1, и подобно ресвератролу,13) фосфорилирование АМФ-зависимой киназы было отмечено при концентрациях до 1 микромоль (5 микромоль обладают аналогичной силой действия) до уровня, в 4 раза превышающего контрольный в течение часа. Активация АМФ-зависимой киназы посредством байкалина не связывается с выработкой АФК (выработка АФК активирует АМФ-зависимую киназу), при этом и вогонин (в лабораторных условиях)14), и пероральный прием шлемника байкальского (10-100 мг/кг у крыс на протяжении четырех недель) повышают фосфорилирование АМФ-зависимой киназы. Активация АМФ-зависимой киназы обусловливает понижающее уровень жиров и холестерина действие байкалина. Компоненты шлемника байкальского активируют АМФ-зависимую киназу, с чем может быть связано действие этого растения, понижающее уровень жиров и направленное против ожирения. Неврология: ГАМК-эргическая нейропередача. Байкалеин является агонистом рецептора ГАМКA, при этом гликозид (байкалин) не обладает таким действием. Его сила действия больше, чем у хризина, и он имеет значение Ki 5.69+/-0.95 микромоль15) (ИК50 в 10.1+/-1.68 микромоль). Его гликозид, байкалин, обладает меньшим значением Ki в 77.10+/-4.79 микромоль и ИК50 ниже 100 микромоль. Что интересно, исключительно байкалеин может оказывать значительное влияние на субэлементы α2 и α3 рецепторов ГАМКA, что может объяснять анксиолитические свойства и отсутствие седативного действия. Вогонин также является агонистом ГАМКA со значением Ki в 2.03+/-0.24 микромоль в активном центре бензодиазепина.16) Байкалин эффективен в ингибировании судорог при пероральной дозе в 5 мг/кг, а вогонин – в дозе 5-10 мг/кг. Оба вещества эффективны при пероральном приеме. Байкалеин и вогонин являются сильными агонистами ГАМКA и могут активировать этот рецептор. Это объясняет некоторые ингибирующие и анксиолитические эффекты шлемника байкальского. 5,7,2'-тригидрокси-6,8-диметоксифлавон (K36) – это наиболее эффективный лиганд ГАМКA со значением Ki в 6.05+/-0.63 наномоль и положительный аллостерический модулятор в концентрациях 1 наномоль (ЭК50 в 24 наномоль), хотя максимально достигнутое стимулирование рецепторов ГАМКA составляет 54+/-8%, что наблюдалось при использовании диазепама (оба по 300 наномоль). В других исследованиях K36 значительно превосходил флунитразепам в связывании с бензодиазепином с ИК50 в 0.008+/-0.0002 микромоль (8.0+/-0.2 наномоль). Другие флавоноиды с аффинностью для рецепторов ГАМКA, включают скутеллярин, обладающий значением Ki для рецептора ГАМКA в 12.00+/-1.27 микромоль в активном центре бензодиазепина (ИК50 в 21.0+/-1.79 микромоль). Если не считать двух основных флавоноидов, K36 весьма эффективен в усилении передачи сигнала через бензодиазепиновый рецептор, при этом подавляет максимальную передачу данных. Ороксилин A является антагонистом рецептора ГАМКA (ингибирует всасывание хлорида17)) в активном центре бензодиазепина и может ингибировать связывание флунитразепама с ИК50 в 1.09+/-0.07 микромоль и ИК50 в 0.14+/-0.01 микромоль, отмеченной в других исследованиях; пероральный прием 3.75-60 мг/кг ороксилина A у крыс способен ингибировать действие диазепама. В других исследованиях он блокировал всасывание хлорида, вызванное мусцимолом (агонист ГАМКA) и байкалеином. Пероральный прием 50 мг/кг ороксилина A оказал незначительное проконвульсивное действие у крыс (типичное для антагонистов ГАМКA), при этом 5 мг/кг ороксилина A продемонстрировали антиамнестическое действие, объясняемое антагонизмом рецептору ГАМКA.18) Ороксилин A представляет собой сравнительно эффективный антагонист ГАМКA в активном центре бензодиазепина, при этом подтвердилась его активность при пероральном приеме, а его свойства противоположны байкалеину и вогонину. Допаминергическая нейропередача. Ороксилин A проявил способность блокировать транспортировщик допамина (DAT) в манере, близкой к метилфенидату, хоть и с низкой силой действия (сила действия ороксилина A близка к атомоксетину). При этом создаются синтетические производные (5,7-дигидрокси-6-метокси-4'-феноксифлавон) с силой действия, сопоставимой с метилфенидатом.19) Это лежит в основе стимулирующего внимание действия, наблюдаемого при 5-10 мг/кг ороксилина A (инъекции), которые обладают силой действия, близкой к 2 мг/кг метилфенидата в спонтанных нарушениях, в то время как 1-5 мг/кг были незначительно менее эффективны в снижении импульсивности. Ороксилин A является ингибитором транспортировщика допамина, близким к метилфенидату (риталину), что лежит в основе стимулирующего внимание действия. Нейрогенез. Ороксилин A повышает фосфорилирование цАМФ-ответного элемента и нейротрофического фактора головного мозга у мышей с когнитивными нарушениями при пероральном приеме 5 мг/кг и у мышей с вызванными бета-амилоидом нарушениями памяти, либо до 400% относительно контрольных мышей (без когнитивных нарушений) при 50 микромоль, что связано с активацией ERK1/2 (митоген-активируемой протеинкиназы) и следует за антагонизмом ГАМКA, так как это было имитировано бикукуллином и блокировалось NMDA-рецепторами.20) В связи с описанными выше механизмами, ороксилин A стимулирует нейрогенез с гиппокампе в дозозависимой манере при приеме в течение 7-14 дней нормальными мышами (5-10 мг/кг), при этом 5 мг/кг действуют равносильно 10 мг/кг, а прием в течение 14 дней не превосходит прием в течение 7 дней. Ингибирование рецепторов ГАМКA, наблюдаемое при приеме ороксилина A, косвенно повышает NMDA-зависимую передачу сигнала, что затем увеличивает образование нервной ткани. Это было подтверждено на грызунах вследствие приема низких доз этой молекулы. Байкалин может стимулировать нейронное образование стволовых/прогениторных клеток и гиппокампально-зависимый нейрогенез у крыс после церебральной ишемии, когда принимается в дозе 50 мг/кг ежедневно в течение трех недель, что связано с повышением экспрессии MASH1 при 7.5-30 микромоль. Нейропротективное действие: Белок температурного шока 70 (HSP70) – это индуцируемый белок теплового шока, который оказывает защитное действие на нейроны и отчасти эффективен против ишемического повреждения, при этом такие же нейропротективные свойства были отмечены у байкалина в дозе 200-300 мг/кг21), так как байкалин сохраняет концентрацию HSP70 во время ишемии, что связано с сохранением фосфорилирования ERK (цитопротекторной22)) и снижением фосфорилирования p38 MAPK и JNK (содействуют смерти клеток), оказывая цитопротекторнное действие. Нейровоспаление: Микроглия – это нейронные поддерживающие клетки, включенные в иммунную систему, которые способны становиться «активированными» посредством воспалительных сигналов, при этом данное воспаление способствует когнитивному нарушению, такому как болезнь Паркинсона, болезнь Альцгеймера и рассеянный склероз, за счет нейротоксичности, связанной с постоянной активацией.23) Ороксилин A способен ингибировать активацию микроглии (за счет липополисахаридов) в диапазоне концентрации 10-100 микромоль, что опредяется секрецией окиси азота, способной предотвращать активацию STAT1 (70-85% ингибирование при 50 микромоль), не оказывая влияния на перемещение NF-kB, что в конечном итоге ведет к меньшему выделению воспалительных цитокинов. Вогонин также способен подавлять активацию микроглии, хот и за счет угнетения NF-kB при 50 микромоль. Ороксилин A и вогонин причастны к предотвращению воспалительных реакций в клетках головного мозга, что лежит в основе нейропротективных воздействий. Снижение активации микроглии и последующего воспаления было отмечено в естественных условиях, когда крысы принимали с пищей 100 мг/кг экстракта ежедневно совместно с постоянными инъекциями липополисахаридов. Память и познание. Шлемник байкальский проявил антиамнестические и способствующие усилению памяти свойства против иботеновой кислоты (токсин, имитирующий болезнь Альцгеймера) при пероральном приеме 10-300 мг/кг (30 мг/кг – наиболее эффективная доза), белков бета-амилоида, постоянных вливаний липополисахаридов (100 мг/кг растения ежедневно, 200 мг/кг неэффективны), гамма-облучения (байкалин в отдельности), ишемии, а также на животных моделях старения (в диапазоне 35-115 мг/кг).25) Что касается реверсии связанной с возрастом амнезии, шлемник байкальский (50-200 мг/кг) обладает незначительно более сильным действием, чем 200 мг/кг препарата сравнения пирацетама на протяжении 47 дней. Шлемник байкальский обладает антиамнестическими свойствами, которые достаточно неспецифичны. В одном из исследований, оценивавшем антиамнестические свойства ороксилина A против скополамина, были проведены испытания на здоровых молодых мышах, и в то время как доза 2.5-20 мг/кг вызывала когнитивные улучшения (пассивное избегание), только доза 5-10 мг/кг достигала статистической значимых показателей. Существуют некоторые доказательства в поддержку применения ороксилина A для улучшения когнитивного процесса у здоровых молодых грызунов, что свидетельствует о ноотропном действии. Седативный эффект. 20 мг/кг байкалина у крыс (пропрепарат байкалеина, агонист ГАМКA) не оказали существенного влияния на двигательную активность, при этом 10 мг/кг вогонина также оказались неэффективными. Даже мощный модулятор ГАМКA K36 в дозе 1-8 мг/кг (инъекции) не вызвал изменений двигательной активности, несмотря на то, что проявил анксиолитические свойства. Внутрицеребральные инъекции байкалеина проявили седативные свойства в увеличении времени сна (108-120% от контроля), при этом антагонист бензодиазепина не смог устранить действие в одном из исследований, хотя был эффективен в предотвращении повышения времени сна в другом исследовании. И медленноволновой сон, и быстрая стадия сна были увеличены введением байкалина перед фазой глубокого сна (сна в ночное время).27) Неглубокие фазы сна (равносильные сну в дневное время) фактически были замедлены байкалином, что является результатом сталкивания с ИЛ-1β, вызывающим углубление медленноволнового сна. Байкалеин продемонстрировал анксиолитические свойства в испытании конфликтом у крыс, что связано с соединением с активным центром бензодиазепина рецептора ГАМКA К этому причастны рецепторы ГАМКA с субэлементами α2 и α3 (так как представляют собой мишени для байкалеина). У крыс со спонтанной гипертензией (модель дефицита внимания, связанного с измененной транспортировкой допамина), ороксилин A повышает внимание, что связано с его способностью блокировать транспортировщик допамина. Ороксилин A может обладать стимулирующими внимание свойствами, что связано с ингибированием транспортировщика допамина, такой механизм действия близок к метилфенидату (риталину). |
