Лабораторная работа Жидкость-Пар. Лабораторная работа №3 всё. Неограниченно смешивающиеся жидкости
 Скачать 343.77 Kb. Скачать 343.77 Kb.
|
|
Неограниченно смешивающиеся жидкости Давление пара над однородной жидкой смесью в зависимости от ее состава может быть представлено, как показал Коновалов, тремя основными типами кривых для идеальных и неидеальных растворов. И 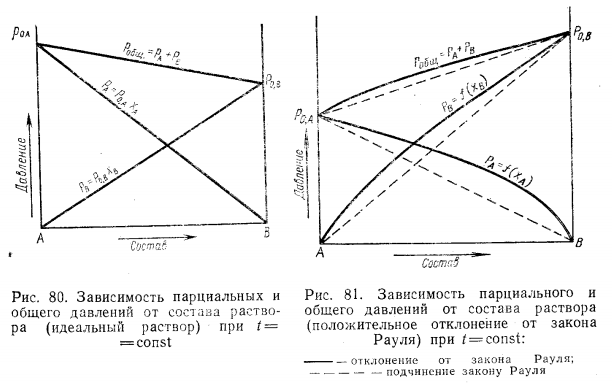 Растворы подчиняются закону Рауля, если силы взаимодействия между частицами разных веществ (А—В) равны силам, действующим между частицами одного и того же вещества (А—А и В—В), причем смещение компонентов не сопровождается ни поглощением, ни выделением теплоты или изменением объема. Растворы подчиняются закону Рауля, если силы взаимодействия между частицами разных веществ (А—В) равны силам, действующим между частицами одного и того же вещества (А—А и В—В), причем смещение компонентов не сопровождается ни поглощением, ни выделением теплоты или изменением объема. Неидеальные растворы. К неидеальным растворам применимо уравнение По отклонению свойств растворов от свойств идеальных растворов судят о силе взаимодействия между молекулами его компонентов. Отклонения эти растут с увеличением концентрации. Положительные отклонения от закона Рауля характерны для растворов: ацетон—сероуглерод, этанол — этиловый эфир и др. Положительные отклонения можно объяснить меньшими силами взаимодействия между молекулами разного типа (А—В), чем между молекулами одного и того же вещества (А—А и В—В). Положительные отклонения объясняются распадом (диссоциацией) ассоциированных молекул одного или обоих чистых компонентов при их смешении. Это повышает летучесть компонентов. Образование растворов такого типа, как правило, сопровождается увеличением объема и поглощением теплоты. 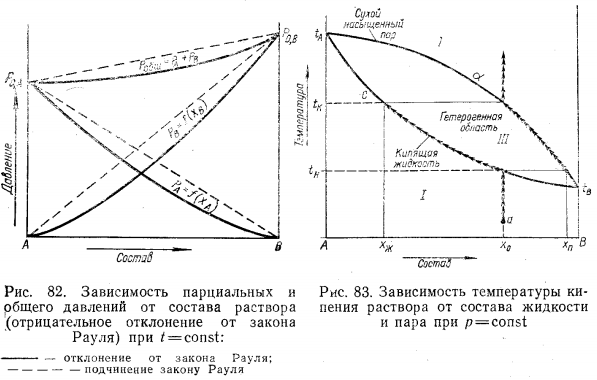 Отрицательные отклонения от закона Рауля характерны для растворов: вода — хлористый водород, вода — серная кислота и т. п. Для данных растворов наблюдается уменьшение давления пара по сравнению с идеальными растворами (рис. 82). Отрицательные отклонения обусловливаются большими силами притяжения между молекулами разных типов (взаимодействие А — В больше, чем А — А и В — В). Отрицательные отклонения наблюдаются у растворов, склонных к сольватации, в частности гидратации и т. п. Образование раствора такого типа, как правило, сопровождается уменьшением объема и выделением теплоты. Если отклонения от закона Рауля очень велики, кривая общего давления пара может иметь максимум или минимум, в зависимости от того, какие отклонения наблюдаются — положительные или отрицательные. Отрицательные отклонения от закона Рауля характерны для растворов: вода — хлористый водород, вода — серная кислота и т. п. Для данных растворов наблюдается уменьшение давления пара по сравнению с идеальными растворами (рис. 82). Отрицательные отклонения обусловливаются большими силами притяжения между молекулами разных типов (взаимодействие А — В больше, чем А — А и В — В). Отрицательные отклонения наблюдаются у растворов, склонных к сольватации, в частности гидратации и т. п. Образование раствора такого типа, как правило, сопровождается уменьшением объема и выделением теплоты. Если отклонения от закона Рауля очень велики, кривая общего давления пара может иметь максимум или минимум, в зависимости от того, какие отклонения наблюдаются — положительные или отрицательные.Состав пара смеси не всегда не совпадает с составом жидкости, находящейся в равновесии с паром. На различии составов жидкости и пара основана перегонка смесей, имеющая большое практическое значение. В условиях гомогенности двухкомпонентные системы имеют две степени свободы: состав и температуру. Экспериментально установлено, что пар обогащается более летучим компонентом. Эта закономерность впервые была выведена Ц. П. Коноваловым и известна как первый закон Коновалова: а) повышение относительного содержания данного компонента в жидкой фазе всегда увеличивает относительное содержание его и в парах; б) в двойной системе пар, по сравнению с находящейся с ним в равновесии жидкостью, относительно богаче тем из компонентов, прибавление которого к системе повышает общее давление пара, т. е. понижает температуру кипения смеси при данном давлении. 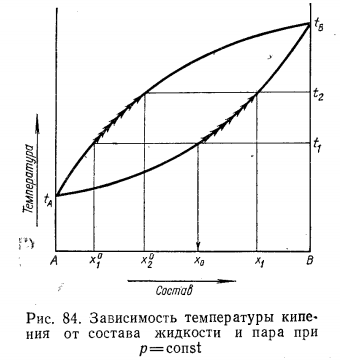 Первый закон Коновалова имеет большое значение для перегонки. При перегонке пар постепенно обогащается более летучим Первый закон Коновалова имеет большое значение для перегонки. При перегонке пар постепенно обогащается более летучимкомпонентом и на этом основано компонентов или обогащение смеси каким-либо компонентом. Одним из видов перегонки является перегонка в равновесии, которая основана на том, что при испарении части жидкости пар находится в соприкосновении с жидкой смесью, а затем он конденсируется. Перегонку ведут, сохраняя контакт фаз, но при этом непрерывно компенсируется образующийся пар. Таким образом, и процесс проходит через непрерывный ряд возможных равновесий. Если бинарная система не обладает экстремумом, то перегонка позволяет выделить любой компонент, если экстремум существует, то только один из них. Практически наибольшее значение имеет фракционная перегонка. Пар, полученный при испарении раствора первоначального состава, конденсируют и полученную жидкую смесь вновь перегоняют. При этом полученный пар будет еще более обогащен летучим компонентом. Повторяя эту операцию несколько раз, можно в конденсате получить почти легколетучий компонент. Состав же жидкости по мере нагревания будет обогащаться менее летучим компонентом. Таким образом, можно осуществлять разделение смесей. Фракционную перегонку можно проводить непрерывно. 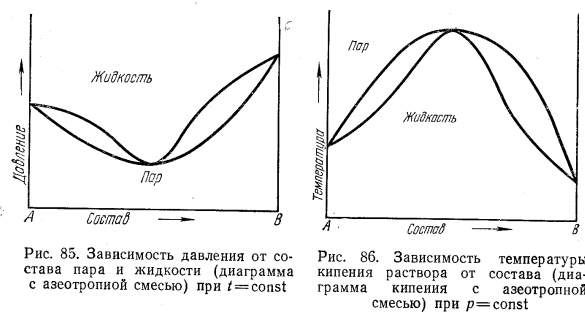 Для растворов, которые точно подчиняются закону Рауля, кривые температура — состав могут быть построены по расчетным данным. Если же смесь дает отклонения от закона Рауля, то кривая может быть построена по опытным данным. Однако если отклонения эти очень велики, то на кривых давление пара — состав может появиться максимум или минимум в зависимости от того, положительные или отрицательны отклонения проявляют эти растворы. В точках максимума или минимума кривая жидкости обязательно коснется кривой пара. Такая точка, в которой состав пара и состав жидкости одинаковы, называется азеотропной точкой. Смесь кипит как одно целое, и раз делить ее на составные части путем перегонки оказывается невозможным. Для растворов, которые точно подчиняются закону Рауля, кривые температура — состав могут быть построены по расчетным данным. Если же смесь дает отклонения от закона Рауля, то кривая может быть построена по опытным данным. Однако если отклонения эти очень велики, то на кривых давление пара — состав может появиться максимум или минимум в зависимости от того, положительные или отрицательны отклонения проявляют эти растворы. В точках максимума или минимума кривая жидкости обязательно коснется кривой пара. Такая точка, в которой состав пара и состав жидкости одинаковы, называется азеотропной точкой. Смесь кипит как одно целое, и раз делить ее на составные части путем перегонки оказывается невозможным.Свойства смесей с максимумом или минимумом температур кипения описываются вторым законом Коновалова, согласно которому в точках экстремума давления пара (или температуры кипения) составы жидкости и пара совпадают. Максимум на кривой давления пара отвечает минимуму на кривой температуры кипения, а минимуму на кривой давления отвечает максимум на кривой температуры кипения. Смеси при разделении дают чистый компонент и азеотропную смесь. Прекращение процесса ректификации в точках экстремума объясняется совпадением состава жидкости с составом пара при определенном соотношении компонентов, вследствие чего движущая сила разгонки (различие в составе фаз) становится равной нулю. Поэтому при равновесии азеотропная смесь испаряется как чистое вещество. Состав азеотропной смеси можно изменить давлением. Это положение было сформулировано в законах Вревского. Первый закон: при повышении температуры раствора заданного состава его пар обогащается тем компонентом, теплота испарения которого больше. Второй закон: если компоненты образуют азеотропную смесь, то следует различать два случая: при наличии максимума на кривой давления пара с повышением температуры азеотропной смеси в ней возрастает концентрация компонента, обладающего большей теплотой испарения; при наличии минимума на кривой давления пара возрастает концентрация того компонента, у которого теплота испарения меньше. Третий закон: с изменением температуры (или давления) состав пара и азеотропной смеси изменяется в одном и том же направлении при максимуме давления пара, и в противоположных направлениях— при минимуме давления пара. Таким образом, для разделения азеотропных смесей можно использовать изменение температуры и давления. Правило рычага. При расчетах фазовых равновесий необходимо определять, каким будет количество компонента в каждой из равновесных фаз при заданном общем составе. Для решения этих и других подобных задач (в том числе и задач, относящихся не только к фазовым равновесиям) удобно пользоваться правилом рычага и диаграммой. При равновесии жидкость — пар в двойной системе необходимо определять количественное соотношение между жидкостью и паром при различных температурах. 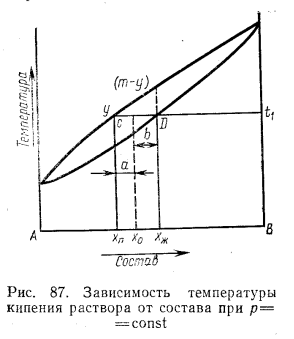 Рассмотрим исходную жидкую смесь состава х0 по компоненту В при t1, хп — содержание компонента В в паре; хж—содержание компонента В в жидкости. Пусть исходная жидкая смесь состоит из m моль обоих компонентов. Через y обозначим количество образовавшегося пара, через m-y — количество оставшейся жидкости, через х0 — общее количество компонента В в исходной смеси (х — молярная доля). Рассмотрим исходную жидкую смесь состава х0 по компоненту В при t1, хп — содержание компонента В в паре; хж—содержание компонента В в жидкости. Пусть исходная жидкая смесь состоит из m моль обоих компонентов. Через y обозначим количество образовавшегося пара, через m-y — количество оставшейся жидкости, через х0 — общее количество компонента В в исходной смеси (х — молярная доля).Составим материальный баланс по компоненту В: тх0 = у хп + (т — у) хж. После преобразований получим правило рычага: 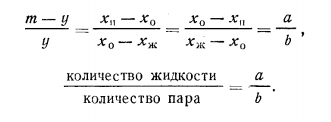 Соотношение равновесных количеств пара и жидкости равно соотношению противолежащих отрезков конноды, которые она образует с линией проведенной через суммарный состав смеси. Лабораторная работа №3 «Равновесие жидкость-пар в двухкомпонентных системах» 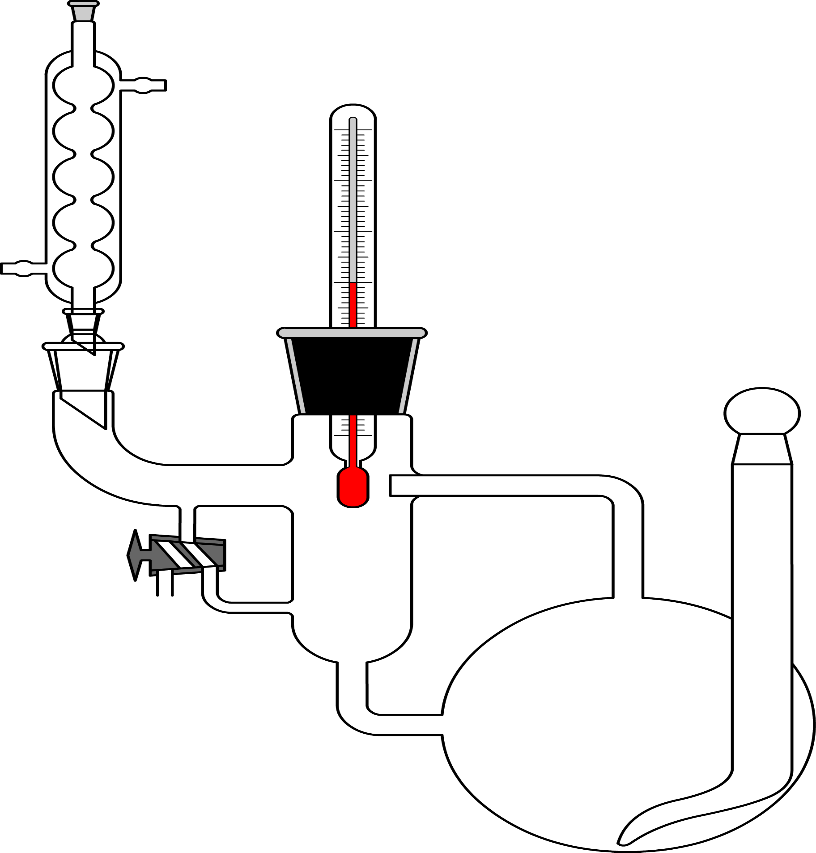 Для определения температур кипения жидкостей служат приборы называемые эбулиоскопами. Для определения температур кипения жидкостей служат приборы называемые эбулиоскопами. Раствор помещают в колбу и осторожно нагревают. После закипания нагрев уменьшают, пока не будет достигнута температура кипения при P=const (1 атм). Небольшое количество испаряющейся жидкости всё время конденсируется в обратном холодильнике и возвращается в колбу. Это обеспечивает равновесное состояние при исходном составе кипящей жидкости. При достижении температуры кипения отбирают конденсат для измерения показателя преломления. По калибровочной кривой определяют состава пара. Строят график температуры кипения от состава (T-x) Ход работы
2. Измеряем показатель преломления чистых жидкостей и растворов. Чертим график зависимости показателя преломления от состава (калибровочную кривую). 3. Нагреваем образцы в эбулиоскопе. При достижении температуры кипения, записываем её и отбираем конденсат для определения показателя преломления. 4. По калибровочной кривой определяем состав пара.
5. Строим график состав пара – состав жидкости для определения азеотропной точки. 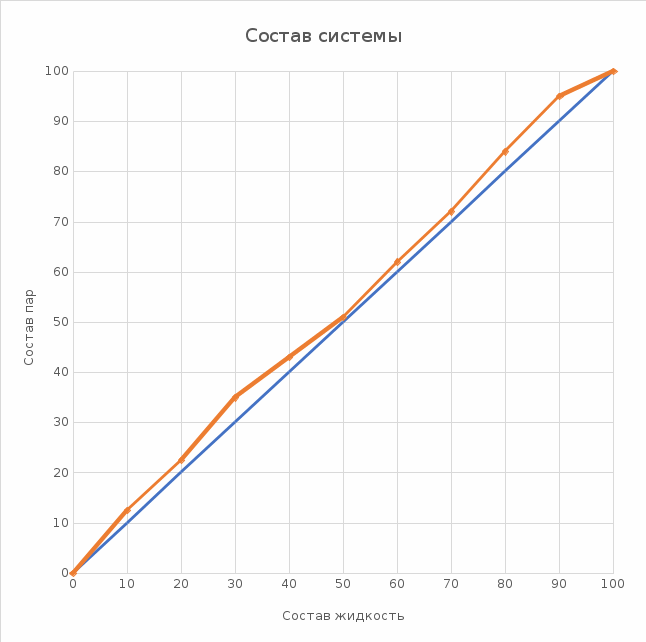 6. Строим линию жидкости и линию пара в координатах T-x 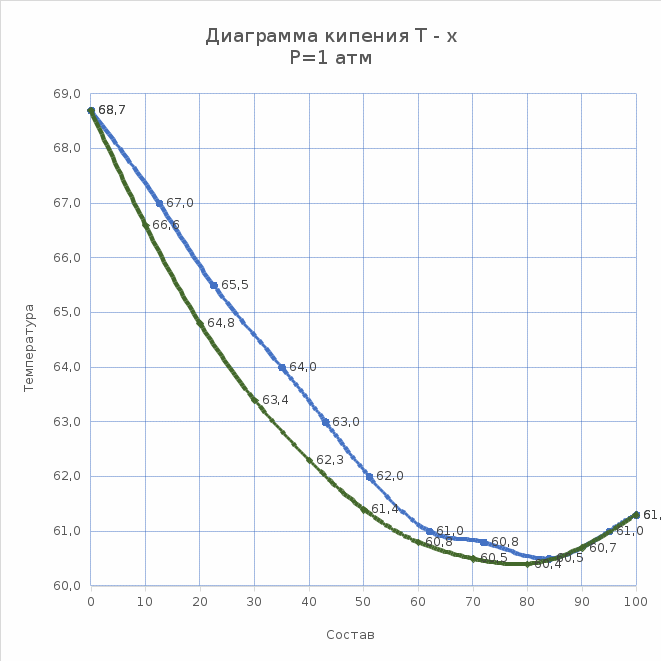 Вывод Из полученных данных и построенных графиков следует что система гексан – хлороформ имеет отрицательное отклонение от закона Рауля, без азеотропной точки. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
