Роль салициловой кислоты в перекисном гомеостазе растений. нижегородский государственный университет им. Н. И. Лобачевского биологический факультет
 Скачать 2.24 Mb. Скачать 2.24 Mb.
|
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ Государственное образовательное учреждение высшего профессионального образования «НИЖЕГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИМ. Н. И. ЛОБАЧЕВСКОГО» БИОЛОГИЧЕСКИЙ ФАКУЛЬТЕТ Кафедра Биохимии и физиологии растений Работа выполнена на базе кафедры Биохимии и физиологии растений ННГУ им. Н. И. Лобачевского Роль салициловой кислоты в перекисном гомеостазе растений Курсовая работа студента 3 курса дневного отделения Корпусова Е.В. Научный руководитель: cт. пр., к.б.н. Половинкина Е.О. Нижний Новгород 2011 Содержание Введение…………………………………………………………………………...…3 1. Обзор литературы………………………………………………………………....4 1.1. Химизм салициловой кислоты…………………………………………...- 1.2. Метаболизм салициловой кислоты……………………………………...- 1.3. Физиологическая роль салициловой кислоты в растении…………..…6 1.3.1. Формирование иммунитета……………………………………...- 1.3.2. Участие в термогенезе………………………………………......7 1.3.3. Защита от патогенов……………………………………………..8 1.3.4. Защита от биотического стресса………………………..............9 1.3.5. Влияние на работу устьиц……………………………………..10 1.3.6. Стабилизация рН клетки………………………………….……..- 1.4. Участие салициловой кислоты в биохимических процессах………...12 1.4.1. Регуляция перекисного гомеостаза…………………………..…- 1.4.2. Салициловая кислота - сигнальная молекула клетки……......16 1.4.2.1. Участие в НАДФН-оксидазной сигнальной системе..- 1.4.2.2. Участие в NO-синтазной сигнальной системе…........22 Заключение………………………………..……………………………………..….25 Цитированная литература…………………………………………………………26 Введение Проблема защиты клетки является актуальным вопросом в биологии. Это связано с тем, что условия среды часто становятся для растений стрессовыми, приводят к нарушению его метаболизма, подавляют нормальный рост, изменяют процессы развития и, в экстремальных случаях, наблюдается гибель организма. Одной из важнейших составляющих ответа растений на действие неблагоприятных факторов (стрессоров) является накопление в клетках и тканях стрессовых метаболитов. Особое место среди стрессовых метаболитов занимают вещества, выполняющие сигнальную роль. В последние годы значительный интерес исследователи проявляют к салициловой кислоте – стрессовому метаболиту, сочетающему свойства сигнального интермедиата и фитогормона (Dat et al., 1998; Wang, Li, 2006а). Стрессовые фитогормоны являются одним из компонентов системы, предотвращающей опасные повреждения в клетке, включающейся в ответ на отклонение множества параметров внутриклеточной, тканевой, органной, системной, внутриорганизменной сред. Салициловая кислота является участником NO-синтазной и НАДФН-оксидазной сигнальных систем. Известно, что активные формы кислорода играют большую роль при стрессе. АФК может окислять практически все классы биологических молекул – белки, липиды мембран, молекулы ДНК. Растительная клетка специально начинает продуцировать АФК, чтобы с их помощью включать те или иные процессы. Целью данной работы являются рассмотрение процессов поддержания перекисного гомеостаза, и физиологической роли салициловой кислоты, ее функций в регуляции этого процесса. Обзор литературы 1.1. Химизм салициловой кислоты Салициловая кислота является двухосновной кислотой: 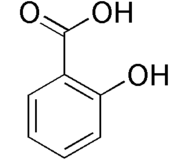 Реакционная способность бензольного ядра салициловой кислоты определяется наличием двух заместителей с противоположными мезомерным и индуктивным эффектами: донорной гидроксильной и акцепторной карбоксильной. В результате салициловая кислота значительно легче бензойной, но не так активно, как фенол, вступает в реакции электрофильного замещения вследствие стабилизации промежуточного σ-комплекса гидроксильной группой. Салициловая кислота впервые была выделена из ивы (Salix) еще в XIX столетии, и с тех пор в виде многочисленных производных широко применяется как лекарственный препарат, самое известное производное салицилата - аспирин или ацетилсалициловая кислота (Шакирова, 2000). Метаболизм салициловой кислоты Пути биосинтеза СК до сих пор продолжают уточняться (Васюкова, Озерецковская, 2007). Основным путем синтеза СК считается фенилпропаноидный (рис. 1). Прямым предшественником СК в этом пути является аминокислота фенилаланин, которая с участием фенилаланинаммонийлиазы превращается в транс-коричную кислоту. Фенилаланинаммонийлиаза активируется при действии на растение различных элиситоров. Это вещества, индуцирующие в устойчивых растениях экспрессию защитных генов. Транс-коричная кислота путем декарбоксилирования (β-окисление) превращается в бензойную кислоту, которая, в свою очередь, под действием фермента 2-гидроксилазы бензойной кислоты (принадлежащая к семейству цитохрома Р-450) превращается в СК (Шакирова, 2001). В то же время у бактерий и в отдельных компартментах растительных клеток (например, хлоропластах) установлено наличие альтернативного пути биосинтеза СК (Васюкова, Озерецковская, 2007). При этом исходным соединением для синтеза СК является шикимовая кислота, которая легко превращается в хоризмовую. Последняя под действием изохоризматсинтазы превращается в изохоризмовую кислоту, из которой с участием изохоризматпируватлиазы и образуется СК. 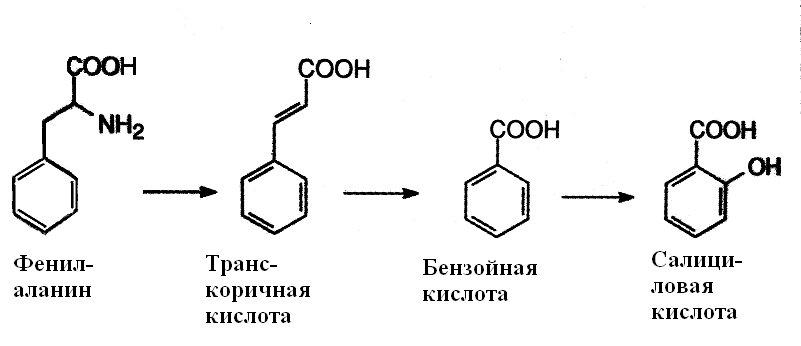 Рис. 1. Последовательность реакций синтеза салициловой кислоты (Тарчевский, 2002) Увеличение содержания СК в тканях растений может быть связано не только с активацией ее синтеза, но и с гидролизом О-β-D-глюкозилсалицилата, локализованного в клеточной стенке растений (Тарчевский, 2002). Так, показано, что при инфицировании тканей клубней картофеля несовместимой расой возбудителя фитофтороза и при обработке элиситором (хитозаном) происходил гидролиз связанных форм СК и накопление ее свободной формы (Панина и др., 2005). Наряду с глюкозилсалицилатом, в растениях присутствует еще одна конъюгированная форма СК – метилсалицилат. Если глюкозилсалицилат физиологически не активен и рассматривается как запасная форма СК (Chen et al., 1995), то метилсалицилат считается транспортной формой СК, в которую он легко превращается в тканях-мишенях (Sesekar et al., 1998). Увеличение содержания СК в органах и тканях растений может быть не только результатом ее синтеза или высвобождения из конъюгатов, но и транспорта к определенным мишеням. Так, показано, что меченая экзогенная СК, нанесенная на определенные листья растений винограда, обнаруживалась в других листьях, причем распределение СК изменялось под действием теплового стресса (Liu Yue-ping et al., 2005). Физиологическая роль салициловой кислоты в растении 1.3.1. Формирование иммунитета СК рассматривается как мобильная молекула, участвующая в передаче информации от клетки, атакуемой патогеном, к другим клеткам. Передвигаясь по сосудам растения, СК последовательно превращает его ткани в иммунизированные, формируя дистанционный тип индуцированной устойчивости (Васюкова, Озерецковская, 2007; Rocher et al., 2006). В то же время далеко не все имеющиеся факты позволяют рассматривать СК в качестве мобильного сигнала для системной приобретенной устойчивости (СПУ) (Дмитриев, 2001). Так, решающим аргументом в пользу существования альтернативных СК путей индуцирования устойчивости к фитопатогенам служат результаты, полученные с использованием NahG-трансгенных растений с высокой активностью салицилатгидроксилазы, которая превращает СК в неактивный катехол. При заражении некоторыми патогенами или обработке элиситорами такие растения развивали не только локальную, но и системную устойчивость (Шакирова, Сахабутдинова, 2003). 1.3.2. Участие в термогенезе О физиологическом эффекте салицилатов в растениях стали говорить только в 1980-е годы, когда было подробно изучено явление термогенеза у ароидных. Классический объект исследования - Sauromatum guttatum - субтропическое растение, которое имеет типичную для ароидных стратегию опыления. Первый термогенный эпизод начинается около полуночи с нагревания верхнего стерильного придатка и длится приблизительно 7 часов. Насекомые вынуждены остаться на день в базальной камере, а с вечера их ожидает второй (14-часовой) термогенный эпизод. Термогенные эпизоды распределены в течение суток так, чтобы начало первого у одних растений популяции совпадает с освобождением насекомых после второго у других. Как оказалось, в предшествующий цветению день в стерильном верхнем придатке идет накопление салициловой кислоты, которое начинается в 12 и достигает максимума в 17 часов. Концентрация салицилата повышается в 100 раз. В середине ночи уровень салицилата повышается также и в нижней части початка. После термогенеза уровень салицилата возвращается к исходному (около 10-15 mmol). Термогенез можно вызвать и во "внеурочное" время. Изолированный придаток початка сохраняет чувствительность к экзогенной салициловой кислоте и отвечает повышением температуры, причем, в темноте для индукции термогенеза необходима большая концентрация салицилата, чем на свету, так как Sauromatum не склонен к термогенезу, пока соцветие находится в почве и не доступно для опылителей. Предположительно, механизм термогенеза заключается в том, что запускает синтез м-РНК для альтернативной оксидазы. Кроме того, под действием салициловой кислоты в придатке повышается содержание летучих веществ, привлекающих насекомых. Однако повышение ее уровня зарегистрировано не у всех термогенных видов растений. Например, при развитии стробила Cycas (голосеменные), цветка Victoria regia или соцветия у пальм температура также может повышаться за счет работы альтернативной оксидазы, однако у этих растений термогенез не связан с повышением уровня салицилата, что свидетельствует скорее о сигнальной роли СК. Регуляция термогенеза салициловой кислотой относится к частной физиологии семейства ароидных и некоторых других растений, так как например, у риса повышенный уровень СК не приводит к термогенезу, а у ряски добавление салициловой кислоты стимулирует цветение (Тарчевский, 2002; Шакирова, 2000). 1.3.3. Защита от патогенов Уровень салициловой кислоты возрастает в ответ на внедрение патогенов. Впервые это было показано при инфицировании табака вирусом табачной мозаики в 1990 г. Устойчивость к вирусу можно было повысить, обрабатывая растения салициловой кислотой. Интересно, что даже при простом механическом повреждении активизируется начальный фермент биосинтеза салицилата - ФАЛ. Если растение не может синтезировать салицилат (например, в результате блокирования гена ФАЛ или гена гидроксилазы бензойной кислоты), у него снижается иммунная реакция ко многим патогенам. В ответ на обработку растений салициловой кислотой начинается синтез PR-белков (pathogenesis related proteins). Их делят на несколько классов. Белки PR-1 класса отвечают за проявление системной устойчивости (т.е. устойчивости во всем растении далеко от непосредственного места контакта с патогеном). PR-1 белки токсичны для многих грибов, хотя механизм токсического действия пока еще не достаточно изучен. PR-2 белки оказались b-1,3-глюканазами, расщепляющими глюканы клеточной стенки растений и некоторых грибов на более короткие фрагменты. Фрагменты глюканов также способны вызывать иммунную реакцию растительных клеток. PR-3 класс белков - хитиназ которые расщепляют хитин клеточных стенок грибов. Появление низкомолекулярных продуктов деградации хитина является сигналом о том, что в место повреждения попали гифы гриба. К PR-4 классу относят гевеин-подобные белки, которые отвечают за "склеивание" латекса при повреждениях. Эти физиологические ответы частично перекрываются с ответами на этилен и жасминовую кислоту (Шакирова, 2000). 1.3.4. Защита от биотического стресса Салициловая кислота вызывает синтез ФАЛ, и тем самым усиливает собственный биосинтез. Кроме того, салициловая кислота может связываться с некоторыми Fe-содержащими белками (например, с каталазой). Реализация эффектов СК при биотических стрессах в значительной степени обусловлена увеличением под ее влиянием содержания АФК в клетках. Считается, что один из основных механизмов действия СК связан с ингибированием каталазы (Chen et al., 1993), которую рассматривают как рецептор СК (Conrath et al., 1995; Dong, 1995). Ингибирование каталазы приводит к увеличению содержания пероксида водорода, который и выполняет сигнальные функции в индуцировании экспрессии защитных генов (Durner, Klessing, 1996). Правда, не все имеющиеся данные вписываются в такую простую схему (Шакирова, 2001). Имеются сведения и о влиянии СК на активность других ферментов, причастных к регулированию про-антиоксидантного равновесия, в частности, НАДФН-оксидазы (Geetha, Shetty, 2002), пероксидазы (Kawano, Muto, 2000), супероксиддисмутазы (Rao et al., 1997). Тем не менее, защитные реакции, в индуцировании которых принимает участие СК, так или иначе связаны с накоплением АФК. При взаимодействии с салицилатом активность каталазы падает, концентрация перекиси водорода и других активных форм кислорода растет. К этому же эффекту приводит взаимодействие салицилата с аскорбат-оксидазой. Повышение концентрации активных форм кислорода стимулирует образование новых порций салициловой кислоты, что приводит к усилению эффекта. В крайнем выражении обработка салициловой кислотой может вызвать гибель клеток (запускается реакции сверхчувствительности). 1.3.5. Влияние на работу устьиц На уровне целого растения СК может принимать участие в регуляции состояния устьиц. Показано индуцирование экзогенной СК закрывания устьиц у Vicia faba (Mori et al., 2001). Данный эффект, по-видимому, связан с генерацией АФК – супероксидного радикала (Mori et al., 2001) и пероксида водорода (Jin-Miao et al., 2007) в замыкающих клетках. Важно, что такой эффект СК подавлялся как СОД, так и ингибитором пероксидазы салицилгидроксамовой кислотой. На основании этого авторы (Mori et al., 2001) делают вывод о роли активации внеклеточной пероксидазы под действием СК. Данный фермент принимает участие в генерации супероксида. Индуцирование закрытия устьиц под действием СК показано также на примере листьев растений табака (Chaerle et al., 2002). Таким образом, зарегистрированное уменьшение потерь воды у растений, обработанных СК, при действии водного стресса может быть объяснено ее влиянием на состояние устьиц (Маменко, Роїк, 2008). При этом регуляторные эффекты СК, по-видимому, реализуются с участием АФК. 1.3.6. Стабилизация рН клетки В некоторых исследованиях показано усиление работы протонных помп у растений под действием СК. Так, у растений винограда экзогенная СК, как и высокотемпературная аклимация, увеличивала стабильность Н+-АТФазы (Liu et al., 2006). Похожий эффект СК оказывала и при действии на засухоустойчивые линии кукурузы (Молодченкова, 2008). Такую реакцию можно рассматривать как защитную, направленную на стабилизацию внутриклеточного рН в условиях действия стрессоров. Таким образом, салицилат, в отличие от других гормонов, не только регулирует процессы через соответствующие рецепторные системы, но и непосредственно участвует в аллостерической регуляции работы ряда ферментов. Т.е. для развития физиологического ответа необходима более высокая концентрация салицилата (до 10-3 - 10-5 моль/л). Такие высокие концентрации не характерны для "типичных" гормонов, поэтому часто дискутируют о том, стоит ли салициловую кислоту включать в список растительных гормонов (Тарчевский, 2002). Переход организма, клетки из состояния покоя к более или менее активной жизнедеятельности, в том числе, связанной со стрессовыми состояниями, сопряжен с увеличением расхода энергии, интенсификацией окислительного фосфорелирования в электротранспортных цепях митохондрий, что ведет к окислителтному стрессу растения. В регуляции этого процесса большую роль играют фитогормоны, а именно салициловая кислота (Барабой, 2006). Участие салициловой кислоты в биохимических процессах 1.4.1. Регуляция перекисного гомеостаза Стресс-реакция живых организмов возникает в ответ на непосредственный контакт со стрессором механической, физической (изменения температуры, радиация) или химической природы (изменения солености, токсические вещества). Для большинства клеток многоклеточного организма стрессовые сигналы поступают опосредованно, через гиперсекрецию гормонов. Многоклеточный организм реагирует на угрозы, исходящие извне, либо на внутренние нарушения целостности генетически запрограммированной и эволюционно обусловленной реакцией, осуществляемой стресс-системой. Стрессор вызывает изменение химизма биологических сред, активацию свободнорадикального окисления (СРО). Эти изменения имеют сигнальную природу (Барабой, 2006). Беспрецедентный интерес мировой научной общественности к проблеме свободных радикалов (СР) возник сравнительно недавно, в начале 90-х годов XX в., и был вызван публикациеи серии эффектных молекулярно-генетических исследований, однозначно указывающих на значительную роль CP-форм кислорода в ускорении процесса старения организмов (Растинг, 1993), хотя предпосылки для таких заключений, базирующихся на ином фактическом материале, существовали в научной литературе уже давно (Harman,1956; Эмануэль,1963; Эмануель и др., 1977). Свободные радикалы- это химические соединения с неспаренными электронами, которые обладают чрезвычайно высокой реакционной способностью, которая реализуется случайным образом. Они реагируют быстро и беспорядочно с любыми клеточными структурами, которые встречаются на их пути, результатом чего становятся разнообразные повреждения. Н.Н. Семенов (1929) и его последователь Н.М. Эмануель (1966) выяснили, что СР или атомы, в отличие от молекул, обладают свободными ненасыщенными валентностями, что определяет легкость их взаимодействия с другими молекулами, при этом происходит разрыв одной из валентных связей последних и всегда образуется новый СР. Этот СР в свою очередь легко реагирует с другой исходной молекулой, вновь образуя СР. Возникнув первоначально в органических стуктурах под влиянием УФ-излучения Солнца, излучений радиоактивного фона и т. п., эти активные продукты инициируют в липидах и в меньшей степени в других легкоокисляющихся органических соединениях цепные окислительные реакции. Они протекают по моно- и диоксигеназному типу, с присоединением к окисляющемуся субстрату одного или двух атомов кислорода, с образованием новых каталитических центров. Постепенно в процесс вовлекаются все новые молекулы кислорода, и окислительная деструкция липидов лавинообразно нарастает; лимитируют ее доступ молекулярного кислорода и наличие окисляемого субстрата. Поскольку в процессе перекисного окисления липидов (ПОЛ) образуются в качестве его промежуточных продуктов все те же свободные радикалы и перекиси, которые выступали в качестве инициаторов процесса, вся эта последовательность событий может в благоприятных условиях развертываться аутокаталитически самоускоряясь. Совокупность этих элементарных актов называется разветвленной цепной реакцией (Тодоров, 2010). Согласно предложенной Ю.А. Владимировым и его сотрудниками (1992) классификации, подавляющее большинство СР, образующихся в организме, можно поделить на природные и чужеродные. Первые в свою очередь разделяются на первичные, т.е. продукты нормального метаболизма (•ОО-; •NO; HQ• - супероксиды, нитроксиды и семихиноны, соответственно). Из супероксида, а также в результате ряда других реакций в организме могут образовываться такие активные продукты, как перекись водорода, гипохлорит и гидроперекиси липидов. Реакции этих соединений с ионами металлов переменной валентности, главным образом с ионами Fe2+, генерируют образование вторичныхрадикалов •ОН; LO•; L•; LOO• - радикал гидроксила и набор липидных радикалов, соответственно), которые оказывают разрушительное действие на клеточные структуры. Наконец, третичные радикалы - это радикалы антиоксидантов, которые образуются при их взаимодействии с теми или иными из упомянутых выше радикалов. Первичные и вторичные радикалы являются природными, поскольку в определенных количествах всегда образуются в клетках. Чужеродные радикалы могут появляться в клетках под воздействием ионизирующей и ультрафиолетовой радиаци или в результате превращения каких-либо неприродных соединений (ксенобиотиков). Cупероксидный анион-радикал О2ˉ (супероксид) может образовываться в результате многих ферментативных и неферментативных реакций в клетке при одноэлектронном восстановлении молекулярного кислорода (Барабой, 1991). Важнейшим достижением органической эволюци на Земле стало формирование фотосинтеза, а именно способности простейших живых систем к усвоению свовбодной энергии солнечной радиации. Благодаря выработке и наследственному закреплению защитных антиоксидантных механизмов, обеспечивается относительную стабильность организмов. Центральную роль в этом занимает комплекс антиоксидантных ферментов- изоформы супероксиддисмутазы(СОД), каталазы и преоксидазы. Наряду с этим, деструктивный потенциал перекисного окисления был использован природой для совершенствования ряда катаболческих процессов, например окислительной деструкции чужеродных и токсичных веществ (Арчаков, 1975). Реакции перекисного окисления липидов играют крайне важную роль в клеточной патологии при стрессе (Владимиров, 2000). Одним из наиболее важных последствий повышенного образования АФК и цепных реакций ПОЛ является нарушения структуры и функции клеточных мембран, что не может не сказываться на нормальной жизнедеятельности клеток (рис. 2) 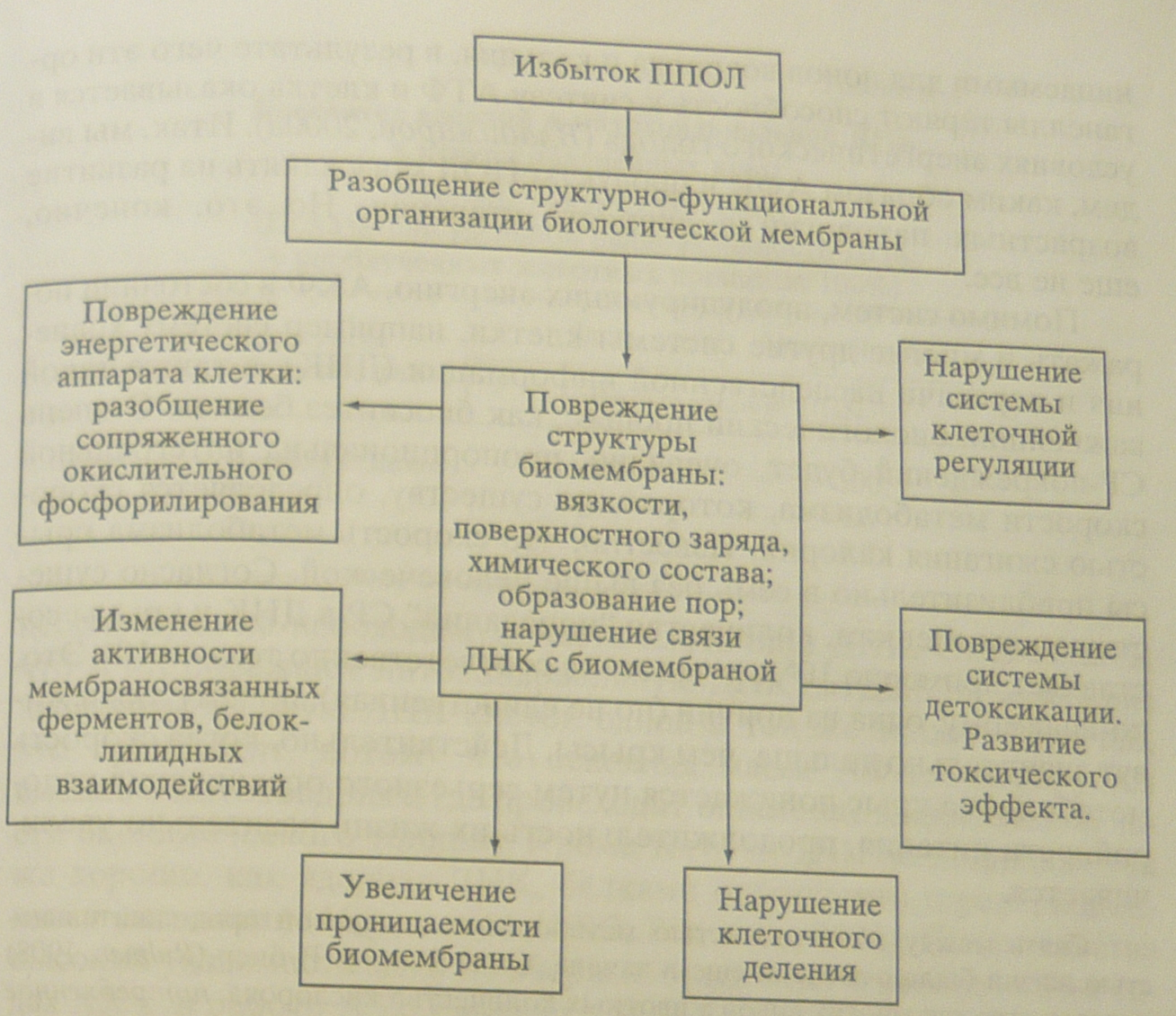 Рис. 2. Схема токсического действия продуктов перекисного окисления липидов на клетку (Барабойи др., 1992) В процессе эволюции у клеток выработались приспособления, позволяющие воспринимать, преобразовывать и усиливать приходящие из окружающей среды сигналы химической и физической природы и с помощью генетического аппарата реагировать на них, не только адаптируясь к изменившимся условиям, перестраивая свои обмен веществ и структуру, но и выделяя различные летучие и нелетучие соединения во внеклеточное пространство. Одни из них выполняют роль защитных веществ против патогенов, другие могут рассматриваться в качестве сигнальных молекул, вызывающих ответ других клеток, расположенных на большом расстоянии от места действия на растения первичного сигнала. Можно считать, что все эти адаптивные события происходят в результате изменений в информационном поле клеток. Первичные сигналы с помощью различных сигнальных систем вызывают реакцию со стороны генома клеток, проявляющуюся в репрограммировании экспрессии генов. По сути дела, сигнальные системы регулируют работу основного вместилища информации - молекул ДНК. С другой стороны, они сами находятся под контролем генома. Впервые в нашей стране целенаправленно исследовать сигнальные системы клеток начали Е.С. Северин (Северин, Кочеткова, 1991) на животных объектах и О.Н. Кулаева (Кулаева и др., 1989; Kulaeva,1990; Kulaeva et al., 1992; Кула ева, 1995; Бурханова и др., 1999) - на растительных. При изучении механизмов влияния на растения различных патогенов и элиситоров было обнаружено, что они вызывают достаточно быстрое и интенсивное накопление так называемых стрессовых фитогормонов. К ним относят соединения различной химической природы: салициловую кислоту (и метилсалицилат), абсцизовую кислоту, этилен, жасмоновую кислоту (и метилжасмонат), брассиностероиды, системин. Образовавшиеся стрессовые фитогормоны вызывают синтез различных защитных соединений и повышение устойчивости как в клетках, подвергшихся действию элиситоров (местная или локальная устойчивость), так и на удалении от них (системная устойчивость). Последнее объясняется способностью большинства фитогормонов транспортироваться на большие расстояния или вызывать в клетках появление транспортных вторичных элиситоров (Тодоров, 2009). В настоящее время интерес исследователей главным образом направлен на выяснение роли салициловой кислоты, по-видимому связанной с ее участием в регуляции защитных реакций, ключевой роли в индукции системной приобретенной устойчивости растений к инфицированию фитопатагенами. СК участвует в развитии защитных реакций в ответ на неблагоприятные факторы среды биотической и абиотической природы (Шакирова, 2000). 1.4.2. Салициловая кислота - сигнальная молекула клетки 1.4.2.1. Участие в НАДФН-оксидазной сигнальной системе Салицилат принимает непосредственное участие в активации ряда сигнальных систем, таких как НАД(Ф)Н-оксидазная, NO-синтазная, МАР-киназная, а возможно и других систем (Тарчевский, 2002). Салициловая кислота играет большую роль в функционировании НАДФН-оксидазной системы. Концентрация салицилата при действии патогенов, элиситоров или экзогенной перекиси водорода повышается в десятки раз (Leon et al., 1995; Н. Wu et al., 1997; и др.). Одной из причин "салициловой вспышки" является элиситор-индуцируемое образование фенилаланин-аммиак-лиазы, в результате чего активируется метаболическая цепь фенилаланин Снижение содержания салицилата в элиситированных клетках через некоторое время после "салицилатного взрыва" объясняется несколькими причинами: его выходом из клеток в апопласт и проводящие пути растений, превращением в летучий метилсалицилат и его диффузией в окружающее растение воздушное пространство, образование глюкозильного эфира салицилата и его отложением в клеточные стенки, деградацией салициловой кислоты. Для выяснения функций салициловой кислоты начался поиск салицилатсвязывающих белков. Оказалось, что таким белком является каталаза (Chen et al., 1993). Считается, что салициловая кислота действует ингибирующе на каталазу и, перекрывая основной расходный канал баланса Н2О2, способствует ее накоплению. Некоторые исследователи не разделяют этого мнения о роли салициловой кислоты в НАДФН-оксидазной системе, однако полученные данные о существовании нескольких органоспецифичных изоформ каталазы, отличающихся способностью ингибироваться салицилатом, рассеяли эти сомнения. Было обнаружено, что салициловая кислота- это ингибитор не только каталазы, но и других железосодержащих ферментов (Chen еt al, 1997) - аскорбат-пероксидаз, аконитаз, АСС-оксидазы. Последнее объясняет, почему салициловая кислота затормаживает синтез этилена (Leslie, Romani, 1986; 1988). Имеются результаты, свидетельствующие о существовании активируемых салицилатом МАР-киназах (SIPK) (Zhang, Klessig, 1997; Zhang et al, 1998; Romeis et al, 1999; Mikolajczyk et al, 2000) и о салицилатиндуцируемых рецепторных киназах (Не et al, 1999), которые активировались также патогенами и окислительным стрессом (Czernic et al, 1999). Если иметь в виду, что расположение двух гидроксильных групп у салициловой кислоты и перекиси водорода может быть сходным (Тарчевский и др., 1999), то не исключено, что салицилатактивируемые протеинкиназы являются и Н2О2-активируемыми протеинкиназами (Guyton et al, 1996). Одним из важных последствий активации патогенами и элиситорами НАДФН-оксидазной системы можно считать появление так называемой сверхчувствительности инфицированных и рядом расположенных клеток, что приводит к их гибели и появлению некротических пятен. Отмирание клеток - это результат включения специальной генетической программы. У растений программируемая смерть клеток (апоптоз) начала изучаться позднее, чем у животных, причем было обнаружено, что механизмы апоптоза в основном идентичны (Самуилов и др., 2000; Shirasu, Schulze-Lefert, 2000). Необходимо отметить, что в апоптозе принимают участие перекись водорода и салициловая кислота НАДФН-оксидазной системы и некоторые интермедиаты кальциевой, липоксигеназной, МАР-киназной и NO-синтазной сигнальных систем. Ранее (Тарчевский и др., 19966) было показано, что инфицирование микоплазмой Acholeplasma laidlawii 118 приводит к появлению ряда новых белков, синтез одного из которых (38 кДа) индуцируется также салицилатом и янтарной кислотой (Тарчевский и др., 1999). Полученные данные позволяют утверждать, что экзогенные салицилат и сукцинат включают тот же сигнальный путь, который вызывает образование части индуцируемых микоплазмами белков. Так как это мог быть НАДФН-оксидазный путь, в котором важную роль играет перекись водорода, то это побудило ученых проводить сравнительное изучение действия экзогенных салицилата (ингибитора каталазы) и сукцината на каталазную активность. Оказалось, что оба эти соединения в одних и тех же концентрациях тормозят разложение Н2О2, т.е. являются ингибиторами каталазы. В связи с этим с помощью программы "Oxford molecular modelling program" построены молекулярные модели Н2О2, салициловой и янтарной кислот. Близость расстояний между водородными атомами гидроксильных групп во всех трех типах молекул (у перекиси водорода - 2,62 А, салицилата - 2,56 А, у одной из возможных конформаций сукцината - 2,64 А) позволяет предполагать, что салициловая и янтарная кислоты могут связываться с активным центром каталазы, выступая в роли конкурентных ингибиторов в реакции разложения перекиси водорода. Освобождаемые из одних клеток салициловая и янтарная кислоты могут в качестве первичных сигналов взаимодействовать с одним и тем же рецепторным белком плазмалеммы других клеток, изменяя его конформацию и "включая" метаболические цепи преобразования и умножения сигнального импульса, завершающиеся экспрессией генов и синтезом защитных белков и фитоалексинов. При исследовании влияния экзогенной салициловой кислоты на полипептидный спектр и (качественно, по почернению рентгеновской пленки) на включение 14С-аминокислот в отдельные полипептиды оказалось, что салициловая кислота очень сильно повышала содержание полипептида 29 кДа из группы кислых белков, а также увеличивала набор щелочных белков, среди которых появлялись новые полипептиды 11, 38, 42 и 72 кДа (Тарчевский и др., 1999). Полипептиды 72 и 11 кДа можно отнести к белкам с высокой скоростью оборота (turnover), отличающимся интенсивным образованием (что определяет их высокую радиоактивность) и быстрым распадом (это приводит к столь низкому содержанию этих полипептидов, что они не проявляются на гелях). Обычно такие соединения играют в обмене веществ роль оперативных регуляторов, достаточно чутко реагирующих на изменение внутриклеточной или внешней ситуации. Обращает на себя внимание, что салицилатиндуцированный кислый белок 29 кДа имел очень высокую радиоактивность, наивысшую среди всех рассматриваемых полипептидов. В то же время в полипептидах 38 и 42 кДа не обнаруживалось высокой радиоактивности. Не исключено, что в двух последних случаях салициловая кислота не столько усиливала синтез этих полипептидов, сколько подавляла интенсивность их деградации. Быть может, установленный ранее факт стимулирования салицилатом образования ингибиторов протеиназ (Jung et al., 1993) белковой природы свидетельствует о возможности действия некоторых из этих ингибиторов не только на протеиназы патогена, но и на некоторые протеиназы растения-хозяина. Не установлено случаев полной репрессии салицилатом образования полипептидов, наблюдалось лишь сильное снижение содержания полипептида 27 кДа. Электрофоретическое разделение белков показало, что салициловая и янтарная кислоты вызвали сходное изменение набора полипептидов. Эти данные позволяют заключить, что экзогенные салицилат и сукцинат включают одни и те же механизмы экспрессии генов. Особенности изменения синтеза различных белков под влиянием экзогенного салицилата изучались многими авторами (Antoniw, White, 1980; Van Loon, Antoniw, 1982; Pennazio et al., 1983; и др.). В одной из таких работ (Jung et al., 1993) было обнаружено индуцирование ацетилсалициловой кислотой в растениях подсолнечника синтеза полипептидов 17 кДа (из группы PR 1 белков), 40 кДа (из группы PR 2 белков), 29 и 37 кДа (из группы PR 3 белков) и 20 кДа (из группы PR 5 белков), причем все они экскретировались в межклеточное пространство. Для белков группы PR 2 характерна β-глюканазная активность, для группы PR 3 - хитиназная, к белкам группы PR 5 относят ингибиторы протеиназ. По всей вероятности, найденные в растениях гороха салицилатиндуцированные белки 29 и 38 кДа аналогичны белкам группы PR 3 подсолнечника с близкими молекулярными массами (Тарчевский, 1997). Как и ожидалось, сходным с салицилатом действием обладает не только янтарная кислота, но и другие ди- и трикарбоксиловые органические кислоты цикла Кребса со сходным с салицилатом расположением гидроксильных групп. Было показано, что салициловая, янтарная, яблочная, фумаровая и лимонная кислоты активируют внеклеточную пероксидазу, что приводит к значительной интенси-фикации образования супероксида (Minibayeva et al., 2001). Можно предположить, что освобождение янтарной кислоты и других ди- и трикарбоксиловых органических кислот во внеклеточное пространство происходит при механическом повреждении клеток или начинающемся апоптозе. По всей вероятности, эти соединения являются одними из тех молекулярных "сигналов бедствия", которые включают защитные механизмы в соседних клетках (Тарчевский, 1993). Роль перекиси водорода и салицилата в растениях не ограничивается их участием в функционировании НАДФН-оксидазной системе клетки, подвергшейся действию элиситоров. Оказалось, что они активируют программируемую смерть клеток (апоптоз), подавляют развитие патогенов. Кроме того, салициловая кислота может быть одним из факторов индукции системного иммунитета в частях растении, удаленных от места инфицирования патогенами. Это объясняется ее способностью транспортироваться по флоэме ( Shulaev et аl,1995) и служить элиситором, включающим сигнальные системы клеток. Некоторые исследователи оспаривали роль салицилата в качестве индуктора системноиммунитета, но опыты с использованием трансгенных растений (Gaffhey et al., 1993; Delaney et al., 1994) с привнесенным геном бактериальной салицилатгидроксилазы (не способных накапливать салициловую кислоту после инфицирования патогенами и осуществлять с ее помощью системный иммунитет) устранили эти возражения. Салициловая кислота может метилироваться, а летучий метилсалицилат - принимать участие в аллелопатических взаимоотношениях в фитоценозах, наряду с летучими производными липоксигеназного метаболизма (гексеналями, гексенолами, ноненалями, ноненолами, метилжасмонатом) и летучими терпеноидными фитоалексинами. Окислительный взрыв может играть одну из главных ролей в появлении разнообразных защитных ответов (Grant, Loake, 2000) и что многие вопросы функционирования НАДФН-оксидазной сигнальной системы остаются еще неизученными. 1.4.2.2. Участие в NO-синтазной сигнальной системе В NO-синтазной системе растений салициловая кислота принимает участие в качестве посредника между NО и геномом (Durner et al., 1998; Hausladen Stamler, 1998; McDowell, Dangl, 2000; Kumar, Klessig, 200). Изучение с помощью иммуноблотинга синтеза некоторых белков, индуцируемых различными интермедиатами NO-синтазной системы, в сочетании с использованием ингибиторов гуанилатциклазы и трансгенных растений с привнесенным бактериальным геном салицилат-гидроксилазы позволил прийти к выводу о разветвленной структуре этого сигнального пути. О первой точке ветвления можно судить по открытию цГМФ-зависимой и независимой NO-индукции фенилаланин-аммиак-лиазы, о второй - по NO-индуцированному салицилатзависимому образованию матричных РНК белка PR-1 и NO-индуцированному салицилатнезависимому образованию фенилаланин-аммик-лиазы (Durner et al., 1998). Многократное накопление салицилата под влиянием NO было показано во многих работах, и в связи с этим были оправданы исследования взаимосвязей NO и салицилата при функционировании NO-синтазной сигнальной системы. Существование NO-индуцированного цАДФ- рибозазависимого и цАДФ -рибозанезависимого синтеза белков (PR-1) (Klessig et al., 2000) предполагает еще одну точку ветвления NO-сигнального пути. Обслуживает NO-синтазную систему, помимо NO-синтазы, еще целый ряд ферментов, активируемых различными интермедиатами этого сигнального пути (Klessig et al., 2000). Монооксид азота активирует гуанилатциклазу, катализирующую образование цГМФ, который, в свою очередь, активирует цГМФ-зависимую протеинкиназу, а последняя - факторы регуляций транскрипции (NO Неферментативными путями вмешательства NO в белковый метаболизм тканей растений могут быть объяснены данные о влиянии донора NO - нитропруссида, на набор белков, полученные в лаборатории В.Г. Яковлевой. Введение в проростки гороха нитропруссида привело уже через сутки после начала опыта к изменению набора полипептидов в растениях. Исчезли характерные для контрольных растений полипептиды 19 и 30 кДа и появились новые с молекулярными массами 32 и 36 кДа. На проростках гороха проводятся исследования на набор и содержание белков салициловой (Тарчевский и др., 1996а, б; 1999; 2001), янтарной (Тарчевский и др., 1999), абсцизовой (Тарчевский и др., 2001), жасмоновой (Тарчевский и др., 1996а, б) кислот, а также инфицирования микоплазмами (Тарчевский и др., 1996а, б). Во всех случаях наблюдаемое изменение набора полипептидов в растениях отмечалось лишь через несколько дней после начала воздействия того или иного исследуемого соединения. Через сутки после начала воздействия на проростки гороха салициловой кислоты не произошло изменения набора полипептидов, наблюдалось лишь некоторое относительное (по сравнению с контрольными растениями) повышение содержания полипептида 34 кДа. Быстрое салицилатнезависимое появление этого полипептида, вызванное донором NO нитропруссидом, могло объясняться неферментативной активацией матричной РНК с помощью монооксида азота. Ранее (Durner et al., 1998; Klessig et al., 2000) было уставлено, что NO вызывал достаточно быстрое появление двух белков - PR 1 и фенилаланин-аммиак-лиазы - менее чем через 24 ч после начала воздействия, но эти результаты были получены в опытах с использованием более чувствительного метода иммуноблотинга. Быстрое NO-индуцированное салицилатнезависимое чезновение полипептидов 19 и 30 кДа в опытах, проведение в нашей лаборатории, можно было бы объяснить прекращением их синтеза. Но это происходило бы лишь в том случае если скорость их оборота была бы очень велика. Возможно что непосредственное взаимодействие NO с этими белками приводило к изменению их конформации и, вследствие этого, к быстрой деградации с помощью протеаз. Заключение Салициловая кислота является важным эндогенным соединением, характеризующимся широким спектром физиологического действия, в котором особое место занимает антистрессовый эффект. Множество исследований показывают неоспоримую роль салицилата в регуляции прооксидантно-антиоксидантного равновесия в растительной клетке. Салициловая кислота оказывает антиоксидантный эффект, который выражается в снижении образования продуктов перекисного окисления липидов и активации антиоксидантной системы в хлоропластах растений. Салицилат оказывает выраженный антиоксидантный эффект, а при действии теплового шока способствует поддержанию постоянного уровня продуктов перекисного окисления липидов. Салициловая кислота принимает непосредственное участие в функционировании НАДФН-оксидазной, и NO-синтазной сигнальных системах. Тем самым, салицилат является неотемлемым компонентом стессоустойчивой системы клеток растения, обеспечивающим процессы жизнедеятельности растительного организма в целом. Таким образом, исследование биохимических изменений, вовлеченных в растительные стрессовые ответы, могут быть использованы для повышения устойчивости растений к различным видам стресса. Цитированная литература 1. Барабой В.А. Механизмы стресса и перекисное окисление липидов // Успехи современной биологии. 1991. Т. 111. Вып. 6. С. 923-931. 2. Васильева Е.А. Действие физических факторов на гомеостаз хлоропластов гороха // Дипломная работа. Нижний Новгород. 2007. 48с. 3. Веселова Т.В., Веселовский В.А., Чернавский Д.С. Стресс растений (биофизический подход).М.:МГУ. 1993. 144с 4. Веселовский В.А., Веселова Т.В., Чернавский Д.С. Стресс растений. Биофизический подход //Физиология растений. 1993. Т.48. Вып.1.С. 124-131. 5. Владимиров Ю.А., Арчаков А. И. Перекисное окисление липидов в биологических мембранах. М.: Наука . 1972. 252 с. 6. Гордеева А.В., Звягильская Р.А., Лабас Ю.А. Взаимосвязь между активными формами кислорода и кальцием в живых клетках // Биохимия. 2003. Т.68. Вып.10. С.1318-1322. 7. Гунес А., Инал А., Багси И.Г. Окислительный стресс у растений //Физиология растений. 2009. Т. 56. №4. С. 555-562. 8. Дмитриев А.П. Сигнальные молекулы растений для активации защитных реакций в ответ на абиотический стресс // Физиология растений. 2003. Т.50. №3. С.465-474. 9. Еремеев С.А. и др. Механизмы превращения митотропных хинонов // Биохимия. 2009. Т.74. Вып.10. С. 1368-1378. 10. Зенков Н.К., Меньшикова Е.Б., Вольский Н.Н., Козолв В.А. Внутриклеточный окислительный стресс и апоптоз // Успехи современной биологии. 1999.Т.119. №5. С. 440-450. 11. Кулинский В.И. Активные формы кислорода и окислительные модификации макромолекул: польза, вред и защита // Соросовский образовательный журнал.1999.№1. С.56-63. 12. Мерзляк М.Н. Активированный кислород и окислительные процессы в мембранах растительной клетки //Итоги науки и техники. Физиология растений. М.: ВИНИТИ.1989.168 с. 13. Рубяшкина Н.А. Синергизм действия метаболитов в ответных реакциях растений на стрессовые факторы // Физиология растений. 2005. Т.52. №4. С.614-621. 14. Тарчевский И.А. Сигнальные системы клеток растений. М.: Наука.2002. 294 с. 15. Тодоров И.Н., Тодоров Г.И. О природе высокой частоты мутаций мДНК и тДНК // Биохимия. 2009.Т.74.Вып.9. С.1184-1194. 16. Шакирова Ф.М. СК- индуктор устойчивости растений // Агрохимия. 2000, №11. С.87-95. 17.James F., Christin H., Scott M. Parallel changes in H2O2 and catalase during thermotollerance induced by salicylic acid or heat acclimation in Mustsrd Seedling // Plant Physiol. 1998. V.116. P.1351-1357. 18. Mulpuri V., del Rio. Influence of salicylic acid H2O2- metabolizing enzymes // Plant Physiol. 1997. V.117. P.137-149. 19. Reals J.A., Neunschwander U.H., Willits M.G., Molina A., Steiner H.-Y., Hunt M.D. Systemic acquired resistance // Plant cell. 1996. V.8. P.1809-1819. |
