Обмен липидов коллоквиум вопросы
 Скачать 337.5 Kb. Скачать 337.5 Kb.
|
|
Рис. 8-22. Депонирование жира в адипоцитах в абсорбтивном периоде. После еды при повышении концентрации глюкозы в крови увеличивается секреция инсулина. Инсулин активирует транспорт глюкозы внутрь адипоцитов, действуя на ГЛЮТ-4, и синтез ЛП-липазы в адипоцитах и её экспонирование на поверхности стенки капилляров. ЛП-липаза, связанная с эндотелием сосудов, гидролизует жиры в составе ХМ и ЛПОНП. АпоС-II на поверхности ХМ и ЛПОНП активирует ЛП-липазу. Жирные кислоты проникают в адипоцит, а глицерол транспортируется в печень. Так как в адипоцитах нет фермента глицеролкиназы, то свободный глицерол не может использоваться для синтеза ТАГ в этой ткани. Активированные жирные кислоты взаимодействуют с глицерол-3-фосфатом, образующимся из дигидроксиацетонфосфата, и через фосфатидную кислоту превращаются в ТАГ, которые депонируются в адипоцитах. Сокращения: ТАГ* - триацилглицеролы в составе ХМ и ЛПОНП; ДАФ - дигидроксиацетонфосфат. Нарушения жирового обмена. Oжирение Жировая ткань составляет 20-25% от общей массы тела у женщин и 15-20% у мужчин. Однако избыточное накопление жира в адипоцитах (ожирение) широко распространено. Среди взрослого населения некоторых стран около 50% людей страдает ожирением. Ожирение - важнейший фактор риска развития инфаркта миокарда, инсульта, сахарного диабета, артериальной гипертензии и желчнокаменной болезни. Ожирением считают состояние, когда масса тела превышает 20% от "идеальной" для данного индивидуума. Образование адипоцитов происходит ещё во внутриутробном состоянии, начиная с последнего триместра беременности, и заканчивается в препубертатный период. После этого жировые клетки могут увеличиваться в размерах при ожирении или уменьшаться при похудании, но их количество не изменяется в течение жизни. Первичное ожирение Первичное ожирение характеризуется множеством гормональных и метаболических особенностей у лиц, страдающих этим заболеванием. В самом общем виде можно сказать, что первичное ожирение развивается в результате алиментарного дисбаланса - избыточной калорийности питания по сравнению с расходами энергии. Суточные потребности организма в энергии складываются из:
Затраты энергии, необходимые для физической активности, разделяют на 3 уровня:
В зависимости от интенсивности нагрузки и возраста суточная потребность в энергии колеблется у женщин от 2000 до 3000 ккал в день, а у мужчин - от 2300 до 4000 ккал. Количество потребляемой пищи определяется многими факторами, в том числе и химическими регуляторами чувства голода и насыщения. Эти чувства определяются концентрацией в крови глюкозы и гормонов, которые инициируют 398 чувство насыщения: холецистокинина, нейротензина, бомбезина, лептина. Причины первичного ожирения:
Роль лептина в регуляции массы жировой ткани У человека и животных имеется "ген ожирения" - obese gene (ob). Продуктом экспрессии этого гена служит белок лептин, состоящий из 167 аминокислот, который синтезируется и сек-ретируется адипоцитами и взаимодействует с рецепторами гипоталамуса. В результате его действия снижается секреция нейропептида Y. Нейропептид Y стимулирует пищевое поведение, поиск и потребление пищи у животных. Другие пептиды, участвующие в регуляции чувства сытости, например холецистокинин, также влияют на секрецию нейропептида Y. Таким опосредованным путём лептин выступает регулятором жировой массы, необходимой для роста и репродукции. Уровень лептина у больных ожирением может быть различным. У 80% больных концентрация лептина в крови тучных людей больше в 4 раза, чем у людей с нормальной массой тела. В этих случаях имеется генетический дефект рецепторов лептина в гипоталамусе, поэтому, несмотря на продукцию лептина, центр голода в гипоталамусе продолжает секрецию нейропептида Y. 20% больных имеют изменения в первичной структуре лептина. К настоящему времени описаны 5 одиночных мутаций в гене лептина, которые приводят к развитию ожирения. У этих больных наблюдают повышение отложения жиров в жировой ткани, чрезмерное потребление пищи, низкую физическую активность и развитие сахарного диабета типа II. Патогенез ожирения при дефекте гена ob может быть следующим: низкий уровень лептина в крови служит сигналом недостаточного количества запаса жиров в организме; этот сигнал включает механизмы, приводящие к увеличению аппетита и в результате к увеличению массы тела. Следовательно, можно сделать вывод о том, что первичное ожирение - не просто следствие переедания, а результат действия многих факторов, т.е. ожирение - полигенное заболевание. Вторичное ожирение - ожирение, развивающееся в результате какого-либо основного заболевания, чаще всего эндокринного. Например, к развитию ожирения приводят гипотиреоз, синдром Иценко-Кушинга, гипогонадизм и многие другие заболевания
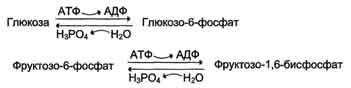
Ацетил коэнзим А или ацетил-КоА – важное соединение в обмене веществ, используемое во многих биохимических реакциях. Его главная функция – доставлять атомы углерода с ацетил-группой в цикл трикарбоновых кислот, чтобы те были окислены с выделением энергии. По своей химической структуре ацетил-КоА – тиоэфир между коферментом А (тиолом) и уксусной кислотой (носителем ацильной группы). Ацетил-КоА образуется во время второго шага кислородного клеточного дыхания, декарбоксилирования пирувата, который происходит в матриксе митохондрии. Ацетил-КоА затем поступает в цикл трикарбоновых кислот. Ацетил-КоА – важный компонент биологического синтеза нейротрансмиттера ацетилхолина. Холин, в соединении с ацетил-КоА, катализируется ферментом холинацетилтрансферазой, чтобы образовать ацетилхолин и коэнзим А. Метаболизм жирных кислот У животных ацетил-КоА является основой баланса между углеводным обменом и жировым обменом. Обычно ацетил-КоА из метаболизма жирных кислот поступает в цикл трикарбоновых кислот, содействуя энергетическому обеспечению клеток. В печени, когда уровень циркуляции жирных кислот высок, производство ацетил-КоА от разрыва жиров превышает энергетические потребности клетки. Чтобы использовать энергию, доступную из лишних ацетил-КоА, создаются кетоновые тела, которые затем могут циркулировать в крови. В некоторых обстоятельствах это может привести к высокому уровню кетоновых тел в крови, состоянию, называемому кетозом, которое отличается от кетоацидоза, опасного состояния, способного повлиять на диабетиков. У растений синтез новых жирных кислот происходит в пластидах. Многие семена запасают большие количества масел в семенах, чтобы поддерживать прорастание и ранний рост саженцов, пока они не перешли на питание от фотосинтеза. Жирные кислоты включены в липиды мембраны, главнейший компонент большинства мембран. Кетогенез образование кетоновых тел. Они являются нормальным продуктом метаболизма липидов и могут использоваться для пополнения запасов энергии в организме. В случае образования избыточного количества кетоновых тел у человека может развиться кетоз. Кетоновые тела - это способ транспорта ацетильной группы При состояниях, сопровождающихся снижением глюкозы крови, клетки органов и тканей испытывают энергетический голод. Так как окисление жирных кислот процесс "трудоемкий", а нервная ткань вообще неспособна окислять жирные кислоты, то печень облегчает использование этих кислот тканями, заранее окисляя их до уксусной кислоты и переводя последнюю в транспортную форму – кетоновые тела. К кетоновым телам относят три соединения близкой структуры – ацетоацетат, 3-гидроксибутират и ацетон. 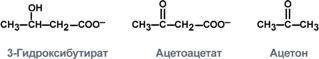 Строение кетоновых тел Стимулом для образования кетоновых тел служит поступление большого количества жирных кислот в печень. Как уже указывалось, при состояниях, активирующих липолиз в жировой ткани, не менее 30% образованных жирных кислот задерживаются печенью. К таким состояниям относится голодание, сахарный диабет I типа, длительные физические нагрузки. Так как синтез ТАГ в этих условиях невозможен, то жирные кислоты из цитозоля попадают в митохондрии и окисляются с образованием кетонов. Кроме отмеченных ситуаций, количество кетоновых тел в крови возрастает при алкогольном отравлении и потреблении жирной пищи. При богатой жирами диете, особенно у детей, жирные кислоты не успевают включиться в состав ТАГ и ЛПОНП и частично переходят в митохондрии, что увеличивает синтез кетоновых тел. При алкогольном отравлении субстратом для синтеза кетонов является ацетил-SКоА, синтезируемый при обезвреживании этанола. В обычных условиях синтез кетоновых тел также идет, хотя в гораздо меньшем количестве. Для этого используются как жирные кислоты, так и безазотистые остатки кетогенных и смешанных аминокислот Синтез кетоновых тел (кетогенез) Синтез ацетоацетата происходит только в митохондриях печени, далее он либо восстанавливается до 3-гидроксибутирата, либо спонтанно декарбоксилируется до ацетона. Далее все три соединения поступают в кровь и разносятся по тканям. Ацетон, как летучее вещество, легко удаляется с выдыхаемым воздухом и потом. Все кетоновые тела могут выделяться с мочой. 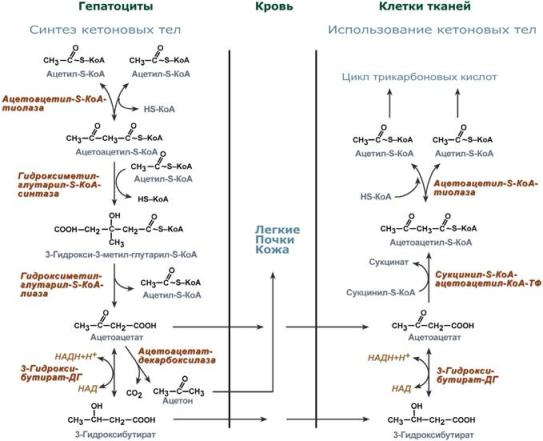 Реакции синтеза и утилизации кетоновых тел Используются кетоновые тела клетками всех тканей, кроме печени и эритроцитов. Особенно активно, даже в норме, они потребляются миокардом и корковым слоем надпочечников. Реакции утилизации кетоновых тел примерно совпадают с обратным направлением реакций синтеза. В цитозоле 3-гидроксибутират окисляется, образующийся ацетоацетат проникает в митохондрии, активируется за счет сукцинил-SКоА и превращается в ацетил-SКоА, который сгорает в ЦТК.
Эйкозаноиды - это общая группа физиологически и фармакологически активных соединений включающая в себя простаноиды (простагландины, простоциклины, тромбоксаны) и лейкотриены. Они имеют очень короткий Т1/2, поэтому оказывают эффекты как "гормоны местного действия". Главный субстрат для синтеза эйкозаноидов у человека - арахидоновая кислота, так как её содержание в организме человека значительно больше остальных полиеновых кислот - предшественников эйкозаноидов.
заменимые жиры - это те, которые могут самостоятельно синтезироваться в организме из других жиров и элементов, а вот незаменимые – нет. к незаменимым жирным кислотам относятся всего две жирных кислоты: линолевая и линоленовая, из которых в нашем организме синтезируются ещё три. Из линолевой – арахидоновая кислота, а из линоленовой – эйкозапентаеновая и докозагексаеновая кислоты, которые обладают очень сильными и многообразными биологическими свойствами. В ходе синтеза жирных кислот в каждом цикле удлинения используется не сам Ацетил-КоА, а его производное - малонил-КоА (при -окислении каждый цикл укорочения приводит к образованию Ацетил-КоА). Эту реакцию катализирует фермент АЦЕТИЛ-КоА-КАРБОКСИЛАЗА. Это ключевой фермент в мультиферментной системе синтеза ЖК. Этот фермент регулируется по типу отрицательной обратной связи. Ингибитором является продукт синтеза: ацил-КоА с длинной цепью (n=16) - пальмитоил-КоА. Активатором является цитрат. В состав небелковой части этого фермента входит витамин H (биотин). Далее происходит поэтапное удлинение молекулы Ац-КоА на 2 углеродных атома за каждый этап за счет малонил-КоА. В процессе удлинения малонил-КоА теряет СО2. После образования малонил-КоА основные реакции синтеза жирных кислот катализируются одним ферментом - синтетазой жирных кислот (фиксирован на мембранах эндоплазматического ретикулума). Синтетаза жирных кислот содержит 7 активных центров. Участок, связывающий малонил-КоА, содержит небелковый компонент – витамин B3 (пантотеновую кислоту). После этого ацил-АПБ вступает в новый цикл синтеза. К свободной SH-группе ацилпереносящего белка присоединяется новая молекула малонил-КоА. Затем происходит отщепление ацильного остатка, и он переносится на малонильный остаток с одновременным декарбоксилированием, и цикл реакций повторяется. Таким образом, углеводородная цепочка будущей жирной кислоты постепенно растет (за каждый цикл – на два углеродных атома). Это происходит до момента, пока она не удлинится до 16 углеродных атомов (в случае синтеза пальмитиновой кислоты) или более (синтез других жирных кислот). Вслед за этим происходит тиолиз, и образуется в готовом виде активная форма жирной кислоты – ацил-КоА.
Холестерин - это стерин, содержащий стероидное ядро из четырех колец и гидроксильную группу. Холестерин в составе клеточной плазматической мембраны играет роль модификатора бислоя, придавая ему определенную жесткость за счет увеличения плотности «упаковки» молекул фосфолипидов. Таким образом, холестерин — стабилизатор текучести плазматической мембраны. Холестерин открывает цепь биосинтеза стероидных половых гормонов и кортикостероидов, служит основой для образования жёлчных кислот и витаминов группы D, участвует в регулировании проницаемости клеток и предохраняет эритроциты крови от действия гемолитических ядов. СИНТЕЗ ХОЛЕСТЕРИНА Протекает в основном в печени на мембранах эндоплазматического ретикулума гепатоцитов. Этот холестерин - эндогенный. Происходит постоянный транспорт холестерина из печени в ткани. Для построения мембран используется также пищевой (экзогенный) холестерин. Ключевой фермент биосинтеза холестерина - ГМГ-редуктаза (бета-гидрокси, бета-метил, глутарил-КоА редуктаза). Этот фермент ингибируется по принципу отрицательной обратной связи конечным продуктом - холестерином. ТРАНСПОРТ ХОЛЕСТЕРИНА. Пищевой холестерин транспортируется хиломикронами и попадает в печень. Поэтому печень является для тканей источником и пищевого холестерина (попавшего туда в составе хиломикронов), и эндогенного холестерина. В печени синтезируются и затем попадают в кровь ЛОНП - липопротеины очень низкой плотности (состоят на 75% из холестерина), а также ЛНП - липопротеины низкой плотности(в их составе есть апобелок апоВ100.
Жировая инфильтрация печени связана с накоплением в клетках печени триглициридов и других жиров. В тяжелых случаях на долю жиров может приходиться до 40% веса печени (в норме это 5%), а вес печени может увеличиться с 1,5 до 5 кг. Причина. С биохимических позиций накопление жира в цитоплазме гепатоцитов происходит тогда, когда скорость образования в печени триглицеридов превышает скорость их утилизации (липолиз триглицеридов и последующее окисление жирных кислот, включение триглицеридов в преВлипопротеиды и их секреция в кровяное русло). Особенно закономерно жировая инфильтрация печени возникает при хронической алкогольной и другой интоксикации, при декомпенсированном сахарном диабете, ожирении, белковой недостаточности, в том числе алиментарной, при отравлении различными токсическими соединениями (четырехлористый углерод, фосфор и др.), при дефиците липотропных веществ, например, обусловленных экзокринной недостаточностью поджелудочной железы и др. Одним из наиболее распространенных нарушений жирового обмена с избыточным накоплением жира в печени является кетоз повышенное образование кетоновых тел в результате нарушенного метаболизма и накопления их в тканях при декомпенсированном сахарном диабете 2 типа. Жировая дистрофия печени часто сочетается с дискинезиями желчного пузыря, особенно при наличии желчнокаменной болезни. Известно, тучному больному нередко угрожает тяжелая прогрессирующая патология, в частности, ишемическая болезнь и ее осложнения, а жировой гепатоз в принципе является обратимой патологией, если устраняется причина, обусловливающая ее развитие, и проводятся соответствующие лечебные мероприятия. Например, если жировой гепатоз связан с беременностью, то приостановить его развитие и прогрессирование может только прерывание беременности с последующим проведением соответствующих лечебных мероприятий. Именно на этот неоспоримый факт обращается внимание врача, то есть имеется в виду своевременное распознавание (диагностика) жирового гепатоза и возможно более раннее начало адекватного лечения. Важно предотвратить развитие некрозов и воспаления (стеатогепатита), лечение которых намного сложнее. Жир в клетках печени откладывается в результате: Избыточного поступления в печень свободных жирных кислот (СЖК); Снижения скорости b–окисления СЖК в митохондриях гепатоцитов; Избыточного образования и всасывания СЖК в кишечнике; Снижения синтеза липопротеинов разной плотности в самой печени; Функциональной печеночной недостаточностью, обусловленной заболеванием печени. Липотропные вещества (от греч. lipos — жир и trepo — поворачиваю, отвращаю) — соединения, обладающие способностью предотвращать жировую инфильтрацию печени, возникающую у животных и человека под действием некоторых факторов. К числу наиболее активных липотропных веществ относятся холин (см.), метионин (см.), инозит (см.), лецитины (см.), казеин (см.), метилированные производные пуринов (кофеин), а также препараты поджелудочной железы (см. Липокаин). Введение этих соединений в организм предотвращает или резко уменьшает степеньожирения печени, возникающего при нарушениях внешней секреции поджелудочной железы, при состояниях эндогенной или экзогенной белковой недостаточности, при длительном потреблении пищи, содержащей большие количества липидов, в том числе холестерина, и при усиленном образовании в печени жиров из углеводов под влиянием витамина В1 или других факторов. Механизм действия указанных липотропных веществ выяснен не полностью. Все эти липотропные вещества значительно различаются по силе липотропного действия, по выраженности его при ожирениях печени различного происхождения. Однако все они оказывают эффект в тех случаях ожирения печени, которые обусловлены либо усилением синтеза в печени жиров из углеводов, либо нарушением переноса жирных кислот из печени в жировые депо. В тех случаях ожирения, которые вызваны усилением перехода жиров из жировых депо в печень (введение экстрактов передней доли гипофиза, отравление фосфором или четыреххлористым углеродом), указанные Л. в. либо вовсе не эффективны, либо оказывают очень незначительный эффект.
Атеросклероз – это патология, характеризующаяся появлением атерогенных бляшек на внутренней поверхности сосудистой стенки. Одна из основных причин развития такой патологии – нарушение баланса между поступлением холестерола с пищей, его синтезом и выведением из организма. У пациентов, страдающих атеросклерозом, повышены концентрации ЛПНП и ЛПОНП. Существует обратная зависимость между концентрацией ЛПВП и вероятностью развития атеросклероза. Это согласуется с представлениями о функционировании ЛПНП как переносчиков ХС в ткани, а ЛПВП – из тканей. Базовой метаболической «предпосылкой» развития атеросклероза является гиперхолестеролемия. (повышенное содержание холестерола в крови). Гиперхолестеролемия развивается: · вследствие избыточного поступления ХС, углеводов и жиров; · генетической предрасположенности, заключающейся в наследственных дефектах структуры рецепторов ЛПНП или апоВ-100, а также в повышенном синтезе или секреции апоВ-100 (в случае семейной комбинированной гиперлипидемии, при которой в крови повышены концентрации и ХС и ТАГ). Важную роль в механизмах развития атеросклероза играет модифицирование ЛП. Изменения нормальной структуры липидов и белков в составе ЛПНП делает их чужеродными для организма и поэтому более доступными для захвата фагоцитами. Модифицирование ЛП может происходить по нескольким механизмам: - гликозилирование белков, происходящее при увеличении концентрации глюкозы в крови; - перекисная модификация, приводящая к изменениям липидов в липопротеинах и структуры апоВ-100; - формирование аутоиммунных комплексов ЛП-антитело (изменённые ЛП могут становиться причиной образования аутоантител).
Все гормоны, влияющие на мобилизацию жира, можно разделить на 2 группы
АДРЕНАЛИН Мембраны адипоцитов содержат адренорецепторы двух типов ( и ). Взаимодействие адреналина с рецепторами обоих типов вызывает изменение концентрации цАМФ. Однако, это влияние разнонаправленное. -адренорецептор связан с ингибирующим G-белком (Gi), свызывающим понижение активности аденилатциклазы. Это приводит к уменьшению концентрации цАМФ, и, в конечном счете, торможению липолиза. -адренорецептор связан со стимулирующим G-белком (Gs) – эффектом будет стимуляция липолиза. Соотношение - и -адренорецепторов зависит от индивидуальных особенностей организма. Это касается как организма в целом, так и распределения этих рецепторов в разных частях тела – поэтому в процессе липолиза разные части тела у разных людей «худеют» неодинаково. Однако в целом у человека преобладают -адренорецепторы, поэтому суммарное действие адреналина приводит к активации липолиза. СОМАТОТРОПНЫЙ ГОРМОН – стимулирует липолиз, воздействуя через аденилатциклазную систему. Действие ИНСУЛИНА связано с повышением активности внутриклеточной фосфодиэстеразы, что приводит к снижению концентрации цАМФ и угнетению липолиза. Таким образом, инсулин усиливает синтез жира и уменьшает скорость его мобилизации.
При сахарном диабете клетки постоянное сильнейшее углеводное голодание, потому что глюкоза плохо проникает в клетки. Наблюдается активация липолиза и повышается образование кетоновых тел. При тяжелых формах сахарного диабета концентрация кетоновых тел в крови может быть еще выше, и достигать опасных для жизни значений: до 20 ммоль/л и более. |
