Качественный анализ на обнаружение КАТОНОВ. Общая характеристика группы
 Скачать 203.5 Kb. Скачать 203.5 Kb.
|
Реакции обнаружения катионов V аналитической группыРЕАКЦИИ КАТИОНОВ ЖЕЛЕЗА (III) 1. Аммония роданид NH4CNS или калия KCNS с катионами Fe3+ образует железа (III) роданид, раствор которого обладает интенсивной кроваво-красной окраской:  FeCl3 + 3 NH4CNS ↔ Fe(CNS)3 + 3 NH4Cl Fe3+ + 3 CNS‾ ↔ Fe(CNS)3 Этой реакцией Fe3+ может быть обнаружен в присутствии любых катионов. Предельная открываемая концентрация Fe3+ этой реакцией 10 мг/л. 2. Калия гексацианоферрат (II) K4[Fe(CN)6] (желтая кровяная соль) образует с катионами трехвалентного железа темно-синий осадок берлинской лазури: 4 FeCl3 + 3 K4[Fe(CN)6] → Fe4[Fe(CN)6]3↓ + 12 KCl 4 Fe3+ + 3 [Fe(CN)6]4‾ → Fe4[Fe(CN)6]3 Обнаружению катионов Fe3+ данной реакцией мешают Mn2+ (грязно-белый осадок), Bi3+(бело-желтый осадок), Hg2+, Cu2+, Co2+, Ni2+. При действии данным реагентом на раствор соли железа (III) появляется голубой осадок, что не является доказательством образования берлинской лазури. Предельная открываемая концентрация катионов железа равна 30 мг/л. РЕАКЦИИ КАТИОНОВ ЖЕЛЕЗА (II) 1. Калия гексацианоферрат железа (III) K3[Fe(CN)6] (красная кровяная соль) образует с катионами Fe2+ осадок турнбулевой сини: 3 FeCl2 + 2 K3[Fe(CN)6] → Fe3[Fe(CN)6]2↓ + 6 KCl 3 Fe2+ + 2 [Fe(CN)6]3‾ → Fe3[Fe(CN)6]2 Обнаружению катионов Fe2+ данной реакцией мешают Mn2+ (бурый осадок), Bi3+ (горчичный осадок), Hg2+, Cu2+, Co2+, Ni2+. При действии данным реагентом на раствор соли железа (II) появляется темно-зеленый осадок, что не является доказательством образования турнбулевой сини. Предельная открываемая концентрация катионов железа равна 30 мг/л. РЕАКЦИЯ КАТИОНОВ МАРГАНЦА (Mn2+) Наиболее характерной реакцией на Mn2+, дающей возможность обнаруживать его следы даже в присутствии смеси катионов всех аналитических групп, является реакция окисления до перманганат-иона MnO4‾, обладающего интенсивной малиновой окраской. Для этого применяются различные окислители (PbO2, NaBiO3, (NH4)2S2O8 и другие), окислительный потенциал которых выше 1,52 В. Окисление Mn2+ натрия висмутатом протекает по уравнению: 2MnSO4 + 5NaBiO3 + 16HNO3 → 2HMnO4 + 5Bi(NO3)3 + NaNO3 + 2Na2SO4+ 7H2O M  n2+ + 4 H2O – 5 ē → MnO4‾ + 8 H+ 2 n2+ + 4 H2O – 5 ē → MnO4‾ + 8 H+ 2BiO3‾ + 6 H+ + 2 ē → Bi3+ + 3 H2O 5  2 Mn2+ + 5 BiO3‾ + 16 H+ → 2 MnO4‾ + 5 Bi3+ + 7 H2O + 2 H+ РЕАКЦИИ КАТИОНОВ ВИСМУТА (Bi3+) 1. При взаимодействии солей висмута (III) с небольшим количеством раствора KI выпадает черный осадок, растворяющийся в избытке реагента. Образующаяся комплексная соль окрашивает раствор в красновато-желтый цвет. Предельная открываемая концентрация Bi3+ этой реакцией равна 50 мг/л. Обнаружению висмута (III) мешают катионы Fe3+, Ag+, Pb2+, Cu2+ и др. Bi(NO3)3 + 3 KI → BiI3 ↓ + 3 KNO3 Bi3+ + 3 I‾ → BiI3 BiI3 + KI → K[BiI4] BiI3 + I‾ → [BiI4]‾ 2. Восстановление катионов Bi3+ до металлического висмута. Если к раствору соли висмута прилить небольшое количество щелочного раствора соли двухвалентного олова, то из раствора немедленно (лучше при нагревании) выпадет бархатисто-черный осадок металлического висмута: SnCl2 + 4 NaOH → Na2[Sn(OH)4] + 2 NaCl Sn2+ + 4 OH‾ → [Sn(OH)4]2‾ Bi(OH)3 + Na2[Sn(OH)4] → Bi↓ + Na2[Sn(OH)6] B  i(OH)3 + 3ē→ Bi + 3 OH‾ 2 i(OH)3 + 3ē→ Bi + 3 OH‾ 2[Sn(OH)4]2-+ 2 OH‾ – 2 ē → [Sn(OH)6]2‾ 3  2 Bi(OH)3 + 3 [Sn(OH)4]2‾ → 2 Bi + 3 [Sn(OH)6]2‾ Обнаружению мешают катионы железа (III) при их высокой концентрации в растворе. 3. Гидролиз солей висмута протекает сравнительно легко и сопровождается образованием белого осадка висмутила: Bi(NO3)3 + H2O ↔ BiONO3↓ + 2 HNO3 Bi3+ + H2O ↔ BiONO3↓ + 2 H+ Предельная открываемая концентрация висмута реакцией гидролиза его солей зависит от кислотности среды. В нейтральной среде она составляет 100-150 мг/л. Мешают катионы Sn2+, Fe3+. РЕАКЦИИ КАТИОНОВ МАГНИЯ (Mg2+) 1. Образование магния-аммония фосфата MgNH4PO4. Предельная открываемая концентрация катионов этой реакцией равна 1,2 мг/л. Данная реакция на катион магния не является специфической и позволяет обнаруживать его только после выделения из смеси других катионов. 2. Образование магния гидроксокарбоната (MgOH)2CO3. Магния гидроксокарбонат выпадает из раствора в виде белого аморфного осадка. Приведенная реакция на катион магния не является специфической и позволяет обнаруживать данный катион только после его выделения из смеси других катионов. 2 MgCl2 + 2 (NH4)2CO3 + H2O → (MgOH)2CO3↓ + CO2 + 4 NH4Cl 2 Mg2+ + 2 CO32- + H2O → (MgOH)2CO3 + CO2 Реакции обнаружения катионов VI аналитической группыОбщая характеристика группыК шестой аналитической группе катионов относятся Cu2+, Hg2+, Cd2+, Сo2+ и Ni2+. Из характеристики катионов данной группы известно, что все они со щелочами образуют осадки, растворимые в избытке водного аммиака с образованием соответствующих комплексных солей – аммиакатов. РЕАКЦИИ КАТИОНОВ МЕДИ (Cu2+) 1. При взаимодействии с аммония роданидом NH4CNS катионы меди (II) образуют черный осадок: CuSO4 + 2 NH4CNS → Cu(CNS)2↓ + (NH4)2SO4 Cu2+ + 2 CNS‾→ Cu(CNS)2 Осадок постепенно белеет вследствие его разложения: 2 Cu(CNS)2 → 2 CuCNS↓ + (CNS)2 (родан) Предельная открываемая концентрация катионов меди этой реакцией меньше 1 мг/л. Другие катионы YI группы не мешают открытию Cu2+ этой реакцией. 2. При взаимодействии с натрия тиосульфатом выпадает бурый осадок Cu2S. Реакция протекает в кислой среде при нагревании. 2 CuSO4 + 2 Na2S2O3 + 2 H2O → Cu2S↓ + S↓ + 2 H2SO4 + 2 Na2SO4 2 Cu2+ + 2 S2O32‾ + 2 H2O → Cu2S + S + 4 H+ + 2 SO42‾ РЕАКЦИИ КАТИОНОВ РТУТИ (Hg2+) Реагентом на Hg2+ является KI, образующий ярко-красный осадок HgI2, растворимый в избытке реагента: Hg(NO3)2 + 2 KI → HgI2↓ + 2 KNO3 Hg2+ + 2 I‾ → HgI2 HgI2 + 2 KI → K2[HgI4] HgI2 + 2 I‾ → [HgI4]2‾ бесцветный раствор Применяя микроспособы, можно использовать эту реакцию для открытия Hg2+ в присутствии всех катионов любых аналитических групп. Один из микроспособов заключается в том, что в раствор осторожно погружают кончик стеклянной палочки, смоченной раствором KI, при этом вокруг палочки образуется яркое оранжево-красное кольцо HgI2, которое очень быстро исчезает. РЕАКЦИЯ НА КАТИОН КАДМИЯ (Cd2+) Катионы кадмия с избытком KI и NH4OH образуют белый осадок комплексной соли [Cd(NH3)4]I2: Cd(NO3)2 + 4 NH4OH + 2 KI → [Cd(NH3)4]I2↓+ 2 KNO3 + 4 H2O Cd2+ + 4 NH4OH + 2 I‾ → [Cd(NH3)4]I2 + 4 H2O Открытию Cd2+ этой реакцией не мешают ни один из других катионов. Открываемая концентрация составляет не менее 50-100 мг/л. РЕАКЦИЯ НА КАТИОН КОБАЛЬТА (Со2+) Обнаружению Co2+ аммония роданидом мешают катионы Fe3+, Bi3+. Однако этого можно избежать, если выполнить реакцию капельным методом. CoCl2 + 4 NH4CNS → (NH4)2[Co(CNS)4] + 2 NH4Cl Co2+ + 4 CNS‾ → [Co(CNS)4]2‾ РЕАКЦИЯ КАТИОНОВ НИКЕЛЯ (Ni2+) 1. Специфическим реактивом на катион Ni2+ является диметилглиоксим (реактив Л.А. Чугаева). В результате этой реакции образуется внутрикомплексная соль диметилглиоксимина никеля, обладающая характерной ало-красной окраской: 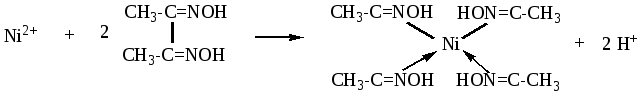 Эта реакция легко протекает в аммиачной среде, когда никель предварительно переведен в комплексный аммиакат. При добавлении диметилглиоксима к аммиачному раствору соли никеля выпадает ало-красный осадок комплексной соли. Обнаружению катиона Ni2+ этой реакцией мешают только катионы Fe2+, которые легко перевести в Fe3+ окислением водорода пероксидом. Предельная открываемая концентрация Ni2+ диметилглиоксимом равна 4 мг/л. 2. Реакция со щелочами. Катионы никеля (II) Ni2+ осаждаются щелочами из водных растворов в виде малорастворимого гидроксида никеля (II) Ni(OH)2 зеленого цвета: Ni2+ + 2ОН- → Ni(OH)2 Осадок растворяется в растворах кислот и аммиака: Ni(OH)2 + 2Н+ → Ni2+ + 2 Н2О Ni(OH)2 + 6NН3 → [Ni (NH3)6 ]2+ + 2ОH- |
