Качественный анализ на обнаружение КАТОНОВ. Общая характеристика группы
 Скачать 203.5 Kb. Скачать 203.5 Kb.
|
Реакции обнаружения катионов I аналитической группыОбщая характеристика группыБольшинство солей, образованных катионами K+, Na+, NH4+, растворимы в воде. Растворимы также и гидроксиды этих катионов. Калия и натрия гидроксиды являются сильными основаниями, гидроксид же аммония относят к основаниям слабым. Соли натрия и калия (сульфаты, нитраты, хлориды) гидролизу не подвергаются, соли же аммония и сильных кислот гидролизу подвергаются (в результате гидролиза растворов этих солей создается кислая среда). Водные растворы солей катионов I группы бесцветны. Группового реактива I группа катионов не имеет. Реакции катиона калия (K+)1. Натрия гексанитрокобальтат (III) – Na3[Co(NO2)6] дает с растворами солей калия желтый кристаллический осадок K2Na[Co(NO2)6]: 2 KCl + Na3[Co(NO2)6] → K2Na[Co(NO2)6]↓ + 2 NaCl 2 K+ + Na+ + [Co(NO2)6]3‾ → K2Na[Co(NO2)6] ↓ Реакцию нужно вести в слабокислой (уксусной) или нейтральной среде. Сильные кислоты разрушают реактив с выделением азотистой кислоты. Щелочная среда также недопустима, так как при действии щелочей реактив разрушается с образованием бурого осадка кобальта (III) гидроксида. Эта реакция очень чувствительна – предельное разбавление 1:13000, а предел обнаружения калия составляет 20 мкг. Реакцию используют для осаждения иона K+ из сыворотки при перманганатометрическом определении калия в крови. Нужно иметь ввиду, что ион аммония с натрия гексанитрокобальтатом (III) также дает желтый осадок и, следовательно, в присутствии иона аммония эту реакцию использовать для открытия иона калия нельзя. 2. Винная (виннокаменная) кислота H2C4H4O6 и натрия гидротартрат NaHC4H4O6 осаждают ионы калия из нейтральных и слабокислых растворов (рН 4-5) в виде очень мелких белых кристаллов калия гидротартрата: H2C4H4O6 + KCl + CH3COONa → KHC4H4O6↓ + NaCl + CH3COOH H2C4H4O6 + K+ + CH3COO‾ → KHC4H6O6↓ + CH3COOH NaHC4H4O6 + KCl → KHC4H4O6↓ + NaCl HC4H4O6‾ + K+ → KHC4H4O6↓ Калия гидротартрат хорошо растворим в минеральных кислотах и щелочах, но мало растворим в воде и органических кислотах (уксусной, муравьиной и др.). Однако повышение температуры значительно увеличивает растворимость калия гидротартрата в воде и в органических кислотах. При растворении его в минеральных кислотах образуется винная кислота, а в щелочах – средняя соль или, соответственно, двойная соль этой кислоты, которые в воде хорошо растворимы: KHC4H4O6 + HCl → H2C4H4O6 + KCl КHC4H4O6↓ + H+ → H2C4H4O6 + K+ KHC4H4O6 + KOH → K2C4H4O6 + H2O KHC4H4O6↓ + OH‾ → K+ + C4H4O62‾ + H2O KHC4H4O6 + NaOH → KNaC4H4O6 + H2O KHC4H4O6↓ + OH‾ → K+ + C4H4O62‾ + H2O В связи с тем, что при взаимодействии ионов калия с винной кислотой образуется свободная минеральная кислота и поэтому создается кислая среда раствора, эту реакцию следует проводить в присутствии натрия ацетата. Последний, вступая в обменное разложение с образующейся при реакции минеральной кислотой, нейтрализует ее и тем самым создает уксуснокислую среду, в которой осадок KHC4H4O6 нерастворим: H2C4H4O6 + KCl → KHC4H4O6↓ + HCl HCl + CH3COONa → CH3COOH + NaCl или суммарно: H2C4H4O6 + KCl + CH3COONa → KHC4H4O6↓ + CH3COOH + NaCl Таким образом, при изучении химического взаимодействия катионов калия с натрия гидротартратом или винной кислотой, необходимо соблюдать следующее непременное условие: реакцию вести на холоду и в нейтральной среде. Если при этом оказывается, что среда, из которой необходимо обнаружить ионы калия, кислая, ее нейтрализуют натрия гидроксидом (по лакмусу), если же щелочная – нейтрализуют кислотой (лучше уксусной). Предел обнаружения калия – 1,2 мг. Натрия гидротартрат дает осадок и с катионом аммония (NH4HC4H4O6), который по свойствам аналогичен KHC4H4O6. Следовательно, ион аммония мешает открытию иона калия указанным реактивом. Реакции катиона натрия (Na+)Калия гексагидроксостибиат (Y) K[Sb(OH)6] c катионом натрия в нейтральных и слабощелочных растворах образует белый кристаллический осадок Na[Sb(OH)6]: K[Sb(OH)6] + NaCl → Na[Sb(OH)6] ↓ + KCl [Sb(OH)6]‾ + Na+ → Na[Sb(OH)6] ↓ С повышением температуры растворимость Na[Sb(OH)6] значительно увеличивается. В разбавленных щелочах этот осадок не растворяется. С минеральными кислотами калия гексагидроксостибиат (Y) вступает в химическое взаимодействие с образованием ортосурьмяной кислоты, которая тотчас же разлагается с выделением метасурьмяной кислоты в виде аморфного осадка: К[Sb(OH)6] ↓ + HCl → HSbO3↓ + КCl + 3H2O [Sb(OH)6]‾ + H+ → HSbO3↓ + 3H2O Следовательно, в кислой среде открывать катионы натрия калия гексагидроксостибиатом (Y) нельзя, так как в этой среде образуется осадок, даже в отсутствии ионов натрия. Хотя образующийся при этом осадок и аморфный, однако, по внешнему виду отличить его от кристаллического осадка довольно трудно. Таким образом, кислая среда всегда вызывает "переоткрытие" катионов натрия (калия гексагидроксостибиатом (Y)), так как всякий кислый раствор, если он и не содержит эти катионы, будет давать осадок. Катионы всех остальных аналитических групп (за исключением Ag+, Ni2+ и Co2+) в той или иной степени с калия гексагидроксостибиатом (Y) также образуют осадок: или в виде соответствующей соли ортосурьмяной кислоты, или же в виде HSbO3 за счет гидролиза их солей и создания тем самым кислой среды раствора. Таким образом, при открытии катионов натрия калия гексагидроксостибиатом (Y) должны соблюдаться следующие условия: а) концентрация ионов натрия должна быть достаточно велика; б) производить эту реакцию следует на холоду; в) анализируемый раствор должен быть нейтральным или слабощелочным, но ни в коем случае не кислым; г) в нем должны отсутствовать почти все остальные катионы (за исключением Ag+, Ni2+, Co2+); наличие даже следовых количеств NH4+ разлагают К[Sb(OH)6] с выделением белого аморфного осадка HSbO3, который можно принять за осадок Na[Sb(OH)6]. д) следует перемешать содержимое пробирки стеклянной палочкой и слегка потереть ею о стенки пробирки (для создания центров кристаллизации). Реакции катиона аммония (NH4+) 1. Едкие щелочи – NaOH или KOH выделяют из растворов солей аммония при нагревании газообразный аммиак: t NH4Cl + NaOH → NaCl + NH3↑ + H2O NH4+ + ОН‾ → NH3↑ + H2O Эта реакция очень специфична. Предел обнаружения аммония 0,2 мкг. 2  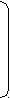 . Реактив Несслера – K2[HgI4]+KOH образует с ионами аммония характерный красно-бурый осадок: . Реактив Несслера – K2[HgI4]+KOH образует с ионами аммония характерный красно-бурый осадок:Hg 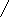 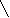 N 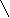 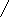 H4Cl + 2 K2[HgI4] + 4 KOH → O NH2 I ↓ + 7 KI + KCl + 3 H2O H4Cl + 2 K2[HgI4] + 4 KOH → O NH2 I ↓ + 7 KI + KCl + 3 H2OHg NH4+ + 2[HgI4] 2‾ + 4 ОН‾ → [Hg2ONH2]I↓ + 7 I ‾ + 3H2O Реакция чувствительна и специфична. Предел обнаружения аммония 0,15 мг. Однако нужно иметь ввиду, что реактив Несслера в своем составе содержит щелочь (КОН); большинство же катионов со щелочами дают нерастворимые в воде основания и многие из них окрашены (например, железа (III) гидроксид – красно-бурого цвета). 3. При изучении реакций на катион К+ катион NH4+ мешает открытию иона калия, т.к. с реактивом натрия гексанитрокобальтатом (III) ион аммония дает желтый осадок, образующийся при действии натрия гексанитрокобальтата (III). Из этого следует, что открывая ион калия, нужно быть уверенным в отсутствии иона аммония. Если же ион аммония присутствует в задаче, то его нужно удалить. Для этого пользуются летучестью солей аммония при нагревании. Если соль – хлорид аммония, то реакция идет по следующей схеме: t 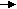 NH4Cl ↔ NH3 ↑ + HCl NH4Cl ↔ NH3 ↑ + HCl Проверяют полноту удаления солей аммония обработкой сухого остатка щелочью при нагревании на часовом стекле. Реакции обнаружения катионов II аналитической группыОбщая характеристика группыИз солей этих катионов хорошо растворимыми в воде являются лишь нитраты. Оксиды и гидроксиды трудно растворимы. Cеребра (I) гидроксид неустойчив: в момент образования большая часть молекул разлагается по схеме: 2 AgOH ↔ Ag2O↓ + H2O С  еребра (I) гидроксид – сильное основание и поэтому растворимые его соли (например, нитрат) гидролизу практически не подвергается, т.к. является солью сильного основания и сильной кислоты. еребра (I) гидроксид – сильное основание и поэтому растворимые его соли (например, нитрат) гидролизу практически не подвергается, т.к. является солью сильного основания и сильной кислоты.Свинца (II) гидроксид – слабое основание, проявляющее амфотерные свойства. Отсюда следует, что свинца (II) нитрат гидролизу подвергается, и раствор этой соли имеет кислую реакцию. Соляная кислота с ионами серебра, свинца, ртути (I) образует трудно растворимые осадки хлоридов. Так как остальные катионы, изучаемые нами, не дают нерастворимых хлоридов, соляная кислота может быть использована в качестве группового реактива на катионы II группы. Химический анализ катионов II группы имеет большое значение в определении качества изделий из стекла, пищевых продуктов и т.д., поэтому при изучении реакций катионов II группы и при проведении анализа смеси катионов этой группы, следует быть очень внимательными и вдумчиво относиться к условиям проведения тех или иных реакций. РЕАКЦИИ ОБНАРУЖЕНИЯ КАТИОНОВ СВИНЦА (Pb2+)1. Калия иодид KI – дает с ионами свинца осадок ярко-желтого цвета: Pb(NO3)2 + 2 KI → PbI2↓ + 2 KNO3 Pb2+ + 2 I‾ → PbI2↓ Осадок растворим в горячей воде в уксусной среде. После охлаждения выпадают красивые золотистые кристаллы свинца (II) иодида. Предел обнаружения свинца – 100 мкг. Реакция неселективна: Ag+, Hg22+, Cu2+, Fe3+ взаимодействуют с KI. Поэтому для обнаружения свинца предварительно выделяют осадок хлоридов свинца, серебра и ртути (I). При обработке этого осадка горячей водой растворяется только свинца хлорид. К полученному водному раствору после охлаждения прибавляют калия иодид и наблюдают выпадение желтого осадка. 2. Серная кислота и растворимые сульфаты образуют с ионами свинца белый кристаллический осадок свинца (II) сульфата. Осадок растворим при нагревании в едких щелочах с образованием натрия тетрагидроксоплюмбата (II): Pb(NO3)2 + H2SO4 → PbSO4↓ + 2 HNO3 Pb2+ + SO42‾ → PbSO4↓ t PbSO4 + 4 NaOH → Na2[Pb(OH)4] + Na2SO4 PbSO4 + 4 OH‾ → [Pb(OH)4]2‾ + SO42‾ Осадок растворим также в растворе аммония ацетата при нагревании. 3. При добавлении калия дихромата или калия хромата к нейтральному или уксуснокислому раствору соли свинца образуется осадок ярко-желтого цвета PbCrO4: 2 Pb(NO3)2 + K2Cr2O7 + 2 CH3COONa + H2O → 2 PbCrO4↓ + 2 CH3COOH + 2 KNO3 + 2 NaNO3 2 Pb2++ Cr2O72‾ + 2 CH3COO‾ + H2O → 2 PbCrO4↓ + 2 CH3COOH Осадок PbCrO4 малорастворим в разбавленных HNO3 или HCl; практически нерастворим в аммиаке, уксусной кислоте, ацетате и тартрате аммония. Растворяется в NaOH и концентрированной HNO3. Например: PbCrO4↓ + 4 NaOH → Na2[Pb(OH)4] + Na2CrO4 Эта реакция позволяет отличить PbCrO4 и BaCrO4, который не растворяется в NaOH. Предел обнаружения свинца – 20 мкг. Мешают Ba (II), Sr (II), Bi (III), Hg (II), Ag (I), образующие с хромат-ионами окрашенные осадки. Реакции обнаружения катионов ртути (I) (Hg22+) 1. Наиболее характерной, достаточно чувствительной и в то же время, по существу, специфической реакцией на катионы одновалентной ртути является рассмотренное выше взаимодействие ртути (I) хлорида с раствором аммиака (образование черного осадка, состоящего из смеси хлорида меркураммония и металлической ртути). Этой реакцией, как правило, и пользуются в аналитических лабораториях для открытия катионов Hg22+. 2. Характерной реакцией для катиона Hg22+ является также взаимодействие их с калия иодидом, при которой образуется темно-зеленый осадок Hg2I2. Однако в присутствии катионов Ag+ и Pb2+ открывать ионы Hg22+ этой реакцией нельзя, так как они с калия иодидом образуют осадки AgI и PbI2, желтый цвет которых будет маскировать окраску осадка ртути (I) иодида. Из катионов других групп открытию Hg22+ этой реакцией мешают Cu2+ и при значительных концентрациях – Bi3+ и Fe3+. При наличии примеси катиона Hg2+ с недостатком KI сначала образуется осадок HgI2 морковного цвета, а при добавлении избытка калия иодида HgI2 растворяется, а в осадок выпадает Hg2I2 темно-зеленого цвета, растворимый в избытке реактива c образованием черного осадка металлической ртути: Hg2(NO3)2 + 2 KI → Hg2I2↓ + 2 KNO3 Hg22+ + 2 I‾ → Hg2I2↓ Hg2I2 + 2 KI → K2[HgI4] + Hg↓ Hg2I2 + 2 I‾ → [HgI4]2‾ + Hg↓ Таким образом, если в растворе отсутствуют катионы Ag+, Pb2+, Cu2+ и в значительных концентрациях Bi3+ и Fe3+, то калия иодид будет специфическим реактивом на катионы одновалентной ртути, так как все остальные катионы не будут мешать открытию Hg22+ этим реактивом. 3. Металлическая медь восстанавливает ртуть из ее солей в виде металлической ртути (осадок черного цвета). Эту реакцию рекомендуют проводить капельным методом. При очень малых концентрациях Hg22+ пятно получается светло-серого цвета, так как на поверхности медной пластинки образуется амальгама меди. Cu + Hg2(NO3)2 → 2 Hg↓ + Cu(NO3)2 Cu + Hg22+ → 2 Hg↓ + Cu2+ 4. Калия хромат дает при нагревании с солями ртути (I) кирпично-красный осадок Hg2CrO4, растворимый в азотной кислоте. Hg2(NO3)2 + K2CrO4 → Hg2CrO4↓ + 2 KNO3 Hg22+ + CrO42‾ → Hg2CrO4↓ Реакции обнаружения катионов серебра (Ag+) 1. Калия иодид KI – дает с ионами серебра осадок бледно-желтого цвета: AgNO3 + KI → AgI↓ + KNO3 Ag+ + I‾ → AgI↓ Осадок нерастворим в растворе аммиака, кислотах. Открытию катиона Ag+ данной реакцией мешают катионы Hg22+, Pb2+, Cu2+, Fe3+. 2. Калия хромат при взаимодействии с солями серебра образует кирпично-красный осадок Ag2CrO4, растворимый в азотной кислоте и NH4OH, но нерастворимый в уксусной кислоте: Ag2(NO3)2 + K2CrO4 → Ag2CrO4↓ + 2 KNO3 2 Ag+ + CrO42‾ → Ag2CrO4↓ Реакции обнаружения катионов III аналитической группы |
