Качественный анализ на обнаружение КАТОНОВ. Общая характеристика группы
 Скачать 203.5 Kb. Скачать 203.5 Kb.
|
Реакции обнаружения катионов IVаналитической группыОбщая характеристика группыДля катионов четвертой группы характерным является то, что в щелочной среде они переходят в форму соответствующего кислотного остатка, например: Al3+ + 4 OH‾ → [Al(OH)4]‾ Кислотные и основные свойства этих остатков у элементов, составляющих группу амфотерных гидроксидов, изменяются в следующем порядке: увеличение кислотных свойств  Cr(OH)63‾ Al(OН)4‾ Zn(OН)42‾ Sn(OН)42‾ AsO43‾  увеличение основных свойств Таким образом, при действии любых щелочей на растворы солей металлов, составляющих катионы этой группы, образующиеся осадки в избытке едкой щелочи легко растворяются. Подобным свойством обладают только указанные катионы (а также катионы свинца и, в значительной степени, сурьмы). Поэтому избыток едкой щелочи, дающий возможность отделить катионы алюминия, хрома, цинка, олова и мышьяка от катионов остальных аналитических групп (кроме первой и, частично, третьей), является типичным групповым реактивом на эти катионы. Второй характерной особенностью катионов этой группы является то, что почти все их соли в той или иной степени подвергаются гидролизу. Наиболее полному гидролизу подвергаются соли мышьяка и олова. Поэтому олово и мышьяк в форме катионов могут находиться только в кислых растворах (главным образом, солянокислых). В нейтральных же растворах олово переходит в осадок соответствующих гидроксидов, а мышьяк – в форму кислотного остатка AsO33‾ или, соответственно, AsO43‾: Sn2+ + H2O ↔ Sn(OH)2↓ + 2 H+ As5+ + 4 H2O ↔ AsO43‾ + 8 H+ Все соли хрома, алюминия и цинка также, в известной степени, подвергаются гидролизу: водные растворы их хлоридов в той или иной мере являются кислыми, а их карбонаты под действием воды образуют соответствующие гидроксиды или (в случае цинка) переходят в основные соли: Al2(CO3)3 + 3 H2O → 2 Al(OH)3↓ + 3 CO2↑ 2 ZnCO3 + 2 H2O → [ZnOH]2CO3↓ + H2CO3 На каждый из катионов четвертой группы имеются или специфические реакции, или довольно характерные реакции из общеаналитических. Из всех этих катионов практически наиболее трудными для обнаружения представляются катионы алюминия. РЕАКЦИИ КАТИОНОВ АЛЮМИНИЯ (Al3+) 1. Кристаллический аммония хлорид NH4Cl или насыщенный раствор этой соли, взятый в избытке, осаждает Al(OH)3 из щелочного раствора, содержащего гидроксокомплекс (гидроксокомплекс получается при прибавлении раствора щелочи к раствору соли Al3+ до полного растворения выпадающего осадка): AlCl3 + 4 NaOH → Na[Al(OH)4] + 3 NaCl бесцветный Al3+ + 4 OH‾ → [Al(OH)4]‾ Na[Al(OH)4] + NH4Cl → Al(OH)3↓ + NaCl + NH3↑ + H2O [Al(OH)4]‾ + NH4+ → Al(OH)3↓ + NH3↑ + H2O При этом Al(OH)3 в присутствии NH4Cl не растворяется, т.к. Кs(Al(OH)3) – величина сравнительно небольшая. 2. Ализарин в аммиачной среде образует с катионом алюминия нерастворимое в воде и уксусной кислоте соединение "алюминиевый лак", обладающее характерной оранжево-красной, а при значительных концентрациях алюминия – яркой малиновой окраской. Предельная минимальная концентрация алюминия 10 мг/л. Реакция алюминия с ализарином хотя и очень характерна, но не специфична, т.к. катионы хрома, цинка, олова, железа, бария, меди и др. также образуют с ализарином нерастворимые окрашенные лаки. Однако маскирующее действие других катионов можно устранить, выполняя реакцию капельным способом. РЕАКЦИИ КАТИОНОВ ХРОМА (Cr3+) Окисление катионов хрома Cr3+ до хромат- и дихромат-ионов (CrO42‾ и Cr2O72‾ и далее, до пероксида хрома CrO5 (или, что тоже, до соответствующих ей надхромовых кислот: H2CrO6, H2Cr2O12, H6CrO10 и т.п.) является наиболее характерной и в тоже время специфической реакцией на катионы хрома, дающей возможность открывать их в присутствии всех других катионов. Первые из этих ионов (CrO42‾) обладают желтой окраской, вторые (Cr2O72‾) – оранжевой, а пероксид хрома CrO5 и соответствующие ей надхромовые кислоты имеют интенсивно-синюю окраску. Окисление хрома можно вести как в кислой, так и в щелочной среде. Окислительный потенциал хрома в щелочной среде (φoCrO42‾/Cr(ОН)4‾) равен 0,12 В, а в кислой среде (φо Сr2O72‾/ 2Cr3+) – +1,36 В. Следовательно, в качестве окислителя для катионов хрома в щелочной среде могут служить хлорная и бромная вода, аммония персульфат, калия перманганат, водорода пероксид и другие вещества, окислительный потенциал которых в этой среде больше 0,12 В. Наиболее же употребительных в лабораторной практике веществ, обладающих окислительным потенциалом выше +1,36 В (в кислой среде), немного: калия перманганат и аммония персульфат. Процесс образования хрома пероксида CrO5 или, соответствующих ей надхромовых кислот (CrO62-, (CrO6)22- и т.п.), протекает только через дихромат-ионы и с участием активного (двухзарядного) кислорода: Cr2O42‾ + 3 O22‾ → 2 CrO5 или Cr2O72‾ + 5 O2‾ → 2 CrO62‾ Следовательно, этот процесс протекает только в кислой среде, так как лишь кислая среда обеспечивает сдвиг равновесия в сторону образования дихромат-ионов: K2CrO4 + 2 H2SO4 → 2 K2SO4 + 2 H2CrO4 ↓↑ 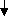 H2Cr2O7 + H2O 2 CrO42‾ + 4 H+ ↔ 2 H2CrO4 ↔ Cr2O72‾ + H2O + 2 H+ В качестве общеупотребительного окислителя при этом применяется водорода пероксид, который при восстановлении обеспечивает выделение активного кислорода и создает соответствующие условия для процесса образования надхромовых кислот. РЕАКЦИИ КАТИОНОВ ЦИНКА (Zn2+) 1. Калия гексацианоферрат (II) и калия гексацианоферрат (III) образуют осадки с катионом цинка в виде соответствующих цианидных солей 3 ZnCl2 + 2 K4[Fe(CN)6] → Zn3K2[Fe(CN)6]2↓ + 6 KCl бледно-желтый 3 Zn2+ + 2 [Fe(CN)6]4‾ + 2 K+ → Zn3K2[Fe(CN)6]2↓ 3 ZnCl2 + 2 K3[Fe(CN)6] → Zn3[Fe(CN)6]2↓ + 6 KCl белый 3 Zn2+ + 2 [Fe(CN)6]3‾ → Zn3[Fe(CN)6]2↓ Осадки калия-цинка гексацианоферрата (II) и цинка гексацианоферрата (III) в воде и разбавленных кислотах практически нерастворимы, вследствие чего реакции катионов цинка с растворами калия гексацианоферрата (II) и гексацианоферрата (III) дают возможность открывать ничтожно малые концентрации катионов. Открытию цинка этими реакциями мешают катионы олова, так как соли олова в ацетатной среде и тем более в присутствии калия гексацианоферрата (II) и калия гексацианоферрата (III) легко подвергаются гидролизу. 2. Открытие цинка в виде «РИНМАНОВОЙ ЗЕЛЕНИ» 3. Аммония тетрароданомеркурат (II) (NH4)2[Hg(SNC)4] в присутствии ионов меди с катионами цинка в кислой среде образует оливково-зеленый осадок тетрароданомеркуратов меди и цинка: 2 (NH4)2[Hg(SNC)4] + ZnSO4 + CuSO4 → ZnCu[Hg(SNC)4]2↓+ 2 (NH4)2SO4 2 [Hg(SNC)4]2‾ + Zn2+ + Cu2+ → ZnCu[Hg(SNC)4]2↓ В присутствии же ионов кобальта этот реактив с катионами цинка образует фиолетово-голубой осадок тетрароданомеркуратов кобальта и цинка: 2 (NH4)2[Hg(SNC)4] + ZnCl2 + CoCl2 → ZnCo[Hg(SNC)4]2↓ + 4 NH4Cl 2 [Hg(SNC)4]2‾ + Zn2+ + Cо2+ → ZnCo[Hg(SNC)4]2↓ Ни один из катионов группы амфотерных гидроксидов при любой их концентрации не мешает открытию цинка этой реакцией. Предельная открываемая концентрация цинка для этой реакции равна около 100 мг/л. Из катионов других групп открытию этой реакцией мешают Co2+, Cu2+, Ag+, Pb2+, Mn2+ в том случае, если их концентрация в растворе значительно превышает концентрацию открываемых катионов Zn2+. Эти реакции при открытии катионов цинка можно проводить капельным методом. Для этого на фарфоровую пластинку наносят каплю исследуемого раствора (подкисленного серной кислотой), затем каплю 0,1%-го раствора CuSO4 или 0,02%-го раствора СoCl2 и каплю реактива. На пластинке образуются соответствующие осадки тетрароданомеркуратов цинка и меди или, соответственно, цинка и кобальта. РЕАКЦИИ КАТИОНОВ ОЛОВА (Sn2+) Из общеаналитических реакций практически ни одна не используется при открытии катионов олова из его раствора. Открытие их производится специфическими реакциями, используя при этом, главным образом, восстановительные свойства двухвалентного олова (φo(Sn2+/Sn4+) = + 0,20 в), а также высокую гидролизуемость солей четырехвалентного олова. При этом естественно, что при открытии катионов олова, основанном на их восстановительных свойствах, олово в растворе должно быть двухвалентным. Поэтому прежде, чем проводить ту или иную окислительно-восстановительную реакцию с этими катионами раствор должен быть предварительно обработан при нагревании в солянокислой среде железными опилками (или стружкой), которые восстанавливают четырехвалентное олово до двухвалентного: SnCl4 + Fe → SnCl2 + FeCl2 Sn4+ + Fe → Sn2+ + Fe2+ Наоборот, если требуется окислить двухвалентное олово в четырехвалентное, то достаточно для этого к раствору прилить несколько капель водород пероксида или хлорной воды и подогреть. При этом Sn2+ немедленно окислятся в Sn4+. Восстановление двухвалентным оловом рекомендуется всегда проводить в щелочной среде, т.е. переведя его предварительно в [Sn(OH)4]2‾-ионы: SnCl2 + 4 KOH → K2[Sn(OH)4] + 2 KCl Sn2+ + 4 OH‾ → [Sn(OH)4]2‾ так как восстановительный потенциал системы Sn(OH)42‾/Sn4+ значительно выше, чем потенциал системы Sn2+/Sn4+. 1. Восстановление двухвалентным оловом солей висмута и ртути. Если к щелочному раствору солей двухвалентного олова прилить небольшое количество какой-либо соли висмута или ртути (BiCl3, Bi(NO3)3, HgCl2, Hg(NO3)2 и т.п.), то из раствора немедленно (лучше при нагревании) выпадут осадки: бархатисто-черный – металлического висмута или темно-серый – металлической ртути: SnCl2 + 4 KOH → K2[Sn(OH)4] + 2 KCl Sn2+ + 4 OH‾ → [Sn(OH)4]2‾ 2 Bi(NO3)3 + 3 K2[Sn(OH)4] + 6 KOH → 2 Bi↓ + 3 K2[Sn(OH)6] + 6 KNO3 2 Bi3+ + 3 [Sn(OH)4]2‾ + 6 OH‾ → 2 Bi + 3 [Sn(OH)6]2‾ HgCl2 + K2[Sn(OH)4] + 2 KOH → Hg↓ + K2[Sn(OH)6] + 2 KCl Hg2+ + [Sn(OH)4]2‾ + 2 OH‾ → Hg + [Sn(OH)6]2‾ Ни один из катионов четвертой группы не мешает открытию этим способом. Из катионов других групп открытию этим способом мешают только ионы трехвалентной сурьмы Sb3+, так как они тоже восстанавливают висмут и ртуть из их солей. Однако если производить эту реакцию капельным способом, в присутствии анилина, то открытие олова при этом можно производить и при наличии в растворе ионов сурьмы. Открытие Sn2+ при помощи Bi3+ или Hg2+ с анилином капельным методом можно производить в присутствии катионов всех аналитических групп. 2. Калия гексацианоферрат (II) и калия гексацианоферрат (III) с катионом олова Sn2+ образуют белые осадки олова (II) гидроксида: 2 SnCl2 + K4[Fe(CN)6] + 4 H2O → 2 Sn(OH)2↓ + H4[Fe(CN)6] + 4 KCl Sn2+ + 2 H2O → Sn(OH)2↓ + 2 H+ 3 SnCl2 + 2 K3[Fe(CN)6] + 6 H2O → 3 Sn(OH)2↓ + 2 H3[Fe(CN)6] + 6 KCl Sn2+ + 2 H2O → Sn(OH)2↓ + 2 H+ 3. Гидролиз солей олова. Наиболее полно протекает гидролиз четырехвалентного олова при нагревании в присутствии нитратных или сульфатных солей: SnCl4 + 4 NaNO3 + 4 H2O → Sn(OH)4↓ + 4 HNO3 + 4 NaCl Sn4+ + 4 H2O → Sn(OH)4 + 4 Н+ 4. При действии на кислый раствор солей двухвалентного олова, так называемой, молибденовой жидкостью (нитратный раствор (NH4)2MoO4) или, лучше аммония фосфоро-молибдатом (нитратный раствор (NH4)3PO4·12MoO3) при высоких концентрациях реагентов и большом избытке Sn2+ шестивалентный молибден восстанавливается до четырехвалентного с образованием темного осадка молибдена (IV) оксида: Sn(NO3)2 + (NH4)2MoO4 + 4 HNO3 → Sn(NO3)4 + MoO2 ↓+ 2 NH4NO3 + 2 H2O Sn2+ + MoO42‾ + 4 H+ → Sn4+ + MoO2 + 2 H2O Sn(NO3)2 + MoO3 + 2 HNO3 → Sn(NO3)4 + MoO2 ↓+ H2O Sn2+ + MoO3 + 2 H+ → Sn4+ + MoO2 + H2O При малых концентрациях катионов олова или молибдат-ионов, а также при избытке Мо6+ по сравнению со Sn2+ раствор окрашивается в интенсивно-синий цвет, так как Sn2+, окисляясь до Sn4+, восстанавливает шестивалентный молибден, при этих условиях до соединений, соответствующих, главным образом, пятивалентному молибдену, обладающих синей и зеленой окраской (образуется так называемая "молибденовая синь"). Следует отметить, что "молибденовая синь", полученная взаимодействием молибденовой жидкости с Sn2+, очень неустойчива; через 2-3 минуты после ее появления окраска раствора уже исчезает. Однако если в растворе имеются ионы мышьяка, то в их присутствии "синь" устойчива, и окраска раствора сохраняется довольно продолжительное время. Если вместо молибденовой жидкости пользоваться аммония фосфоро-молибдатом, то полученная при этом окраска раствора ("молибденовая синь") довольно устойчива и в отсутствии ионов мышьяка. Эта реакция является чрезвычайно чувствительной и специфической на двухвалентное олово и ею можно открывать Sn2+ в присутствии (без удаления из раствора) не только катионов четвертой группы, но и катионов всех других аналитических групп (включая и Sb3+). Предельная открываемая концентрация олова этой реакцией равна 2-3 мг/л. |
